盐酸溶液浓度的标定-硼砂法
实验 硼砂标准溶液的配制和盐酸溶液浓度的标定
实验目的:
1. 学会直接法配制标准溶液的方法。
2. 学会盐酸溶液的标定方法。
3. 学会使用分析天平称取试样。
4. 练习容量瓶、移液管、滴定管的操作方法。
实验原理:
1. 用硼砂标定盐酸溶液的反应:
化学计量点时的pH=5.27, 可选甲基红作批示剂。

2. 硼砂标准溶液浓度计算:
硼砂标准液浓度:0.38 /(382*0.25)= 0.00398(0.00399) M
实验仪器及试剂:
仪器:万分之一分析天平,50ml酸碱滴定管各1支,20ml移液管1支,10ml量筒1支,表面皿1个,250ml锥形瓶2只,250ml容量瓶2只,250ml烧杯,洗耳球1只,玻璃棒1根,移液管架1个,药匙1个,滴定台。
试剂:浓盐酸(密度1.19g·cm-3, 质量分数37%),硼砂(分析纯,摩尔质量381.37或382),甲基红指示剂(0.1%:0.1g 甲基红 20ml 乙醇 80ml蒸馏水 混合100ml 不够补乙醇至100ml)
实验内容及步骤:
1. 配制0.01 (0.012)M盐酸250mL
用量筒量取计算所需体积的浓盐酸0.5ml或1ml(36%-11.74 ,37%-12.06,38%-12.39)
注入事先盛有少量蒸馏水的烧杯中,稀释后转入500mL(1000ml)容量瓶中定容。将所配溶液转入洁净的试剂瓶中,用玻璃瓶塞塞住瓶口,摇匀,贴好标签,待标定(约0.012M)。
2. 硼砂标准溶液的配制
取一个洁净且干燥的表面皿,在分析天平上用直接称量法称取硼砂(Na2B4O7●10H2O : 十水合四硼酸钠)基准物0.3800g (1.9000g,称准至0.1mg),转移至洁净的250ml烧杯中,从洗瓶中挤出少量蒸馏水冲洗表面皿3次,洗液一并转入烧杯,加入蒸馏水至约100ml,搅拌溶解(浓度大的要加热)。将溶液全部转入洁净的250mL容量瓶中定容。计算硼砂标准溶液的浓度(0.00398或0.0199M)。
3. 盐酸的标定
取洁净的20mL移液管一支,用少量硼砂标准溶液淌洗3次。准确移取硼砂标准溶液20.00mL于250mL洁净的锥形瓶中,加入甲基红指示剂2滴,用待定的盐酸溶液滴定,至溶液颜色由黄色转变为橙色,即为滴定终点。记录所消耗盐酸的体积(约15-17ml),平行滴定3-4次。计算盐酸溶液的浓度。
硼砂是如何来滴定盐酸的,过程是什么,硼砂中的水有什么作用?
问题补充:
1. 这是我在做一道化学题时,硼砂失水后用来标定盐酸,会使盐酸的浓度偏高还是偏底
硼砂易溶于水,并水解使溶液呈强碱性,Na2B4O7·10H2O + 2HCl = 4H3BO3+ 2NaCl + 5H2O
失水后标定盐酸会使盐酸浓度偏低。
2. 0.01M 硼砂溶液要怎样配制呢?多少克的水?多少克的硼砂呢?
硼砂是Na2B4O7●10H2O (十水合四硼酸钠)
硼砂的摩尔质量=382克/摩尔
要制备1升0.01M 硼砂溶液,需要硼砂的质量=0.01*1*382=3.82克,将3.82克硼砂溶于水,再转移到1000毫升容量瓶中,加水至刻度,摇匀即可。
第二篇:硼砂标定盐酸
盐酸标准溶液的标定
一、实验目的
考察移液管使用、容量瓶定容、滴定分析等基础实验技能。
二、实验原理
硼砂(Na2B4O7 · 10H2O)易于制得纯品,吸湿性小,摩尔质量大,但由于含有结晶水,当空气中相对湿度小于39%时,有明显的风化失水现象,常保存在相对湿度为60%的恒温器(下置饱和的蔗糖和食盐溶液)中。其标定盐酸溶液的反应为:
Na2B4O7·10H2O + 2HCl ==== 4H3BO3 + 2NaCl + 5H2O
在化学计量点时,由于生成的硼酸(H3BO3)是弱酸,其溶液的pH值约为5.1,可用甲基红作指示剂。
三、实验仪器与试剂
仪器:50 mL酸碱两用滴定管、100 mL容量瓶、250 mL锥形瓶、20mL移液管、洗耳球、胶头滴管、100mL烧杯。
试剂:0.2500 mol·L-1硼砂标准母液、待标定HCl标准溶液、甲基红指示剂(0.1%的60%乙醇溶液)。
四、实验操作(约1 h)
1. 0.05000 mol·L-1硼砂标准溶液的配制
准确移取20.00 mL硼砂标准母液于100 mL容量瓶中,加水稀释,定容到标线。
2. HCl标准溶液的标定
准确移取20.00 mL上述0.05000 mol·L-1硼砂标准溶液于250 mL锥形瓶中,加入2~3滴甲基红指示剂,摇匀,用HCl标准溶液滴定,至溶液由黄色转变为橙色,即为滴定终点。平行测定3份,计算HCl标准溶液的浓度及相对平均偏差。
五、实验数据记录和处理
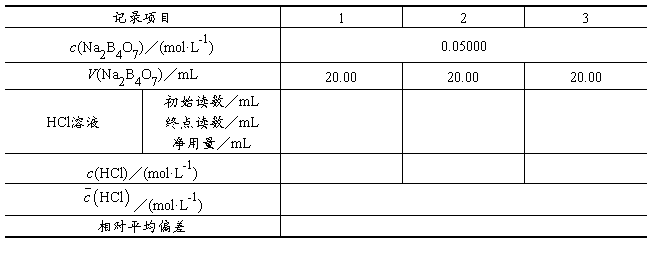
c(HCl)计算公式(自拟):
- 酸碱标准溶液浓度的标定
-
实验报告_酸碱标准溶液的配制和标定
大学化学实验实验一酸碱标准溶液的配制和标定实验目的1掌握标准溶液的配制方法2掌握滴定法定量测定溶液浓度的原理熟悉滴定管移液管的准备…
-
_酸碱标准溶液浓度的标定3
酸碱标准溶液浓度的标定院系化学化工系年级专业10级化学师范姓名孙璇璇手机号码182xxxxxxxx一实验目的1通过中和滴定实验掌握…
-
实验三 酸碱标准溶液配制、浓度的比较和标定
实验三酸碱标准溶液配制浓度的比较和标定1实验目的11熟练分析天平的使用方法12掌握酸碱标准溶液的配制浓度的比较和标定的表达2实验仪…
-
实验 酸碱标准溶液的配制和标定
酸碱标准溶液的配制和标定20xx1213化学化工系11化工与制药2班蒋晓濛手机号150xxxxxxxx一实验目的1掌握NaOHHC…
-
12.5国际志愿者日宣传活动总结
滁州电大12.5国际志愿者日活动总结为大力弘扬志愿者服务精神,广泛普及志愿者服务理念,积极营造学习宣传贯彻当的十八大的良好氛围,根…
-
20xx年秋季新进教师入格课展示活动总结
9月x日至29日,我校组织各年级学科教研组长及相关学科教师对今年秋季新调进我校的7名教师进行了入格课听评课活动,现将基本情况作以下…
-
医院科室工作总结
医院工作总结查阅次数:95次发布人:范文网编辑推荐阅读:一、全科人员在政治上认真学习邓小平理论知识、江泽民同志的七一讲话和十六大报…
-
“弘扬中国传统节日文化”活动的总结
“弘扬中国传统节日文化”活动的总结中国传统节日,凝结着中华民族的民族精神和民族情感,承载着中华民族的文化血脉和思想精华,并成为了维…
-
服装技术工作总结54
自我工作技术总结本人圣凤兰,19xx年来厂部参加工作,现在在厂部担任机缝车间组长一职。多年的实践生产,让我在工作中学到了很多,感谢…