实验三 酸碱标准溶液配制、浓度的比较和标定
实验三 酸碱标准溶液配制、浓度的比较和标定
1.实验目的
1.1熟练分析天平的使用方法。
1.2掌握酸碱标准溶液的配制、浓度的比较和标定的表达。
2.实验仪器
2.1量筒(10ml、100ml)、试剂瓶(500ml)、洗瓶、移液管(25ml)、酸式滴定管(50ml)、碱式滴定管(50ml)、滴定台、锥形瓶(250ml)
2.2浓盐酸、NaOH(10mol/L)、Na2CO3、Na2B4O7 10H2O、邻苯二甲酸氢钾、酚酞指示剂(2g/L的乙醇)、甲基橙指示剂(2g/L)、甲基红指示剂(2g/L)
3.实验原理
用已知浓度的Na2CO3与HCL反应,在指示剂的作用下观察滴定终点,根据反应式算得HCL得浓度,再用相同的方法用HCL来测定未知NaOH的浓度。
4.实验步骤
4.1实验前准备:
4.11检查移液管管尖是否破损,是否漏水,容量瓶是否严密。
4.12分别用自来水、蒸馏水洗涤仪器
4.2 HCL与 NaOH溶液的配制:
4.21用量筒取4~4.5ml浓盐酸,倒入500ml试剂瓶中,加水稀释至500ml,盖上玻璃塞并摇匀。
4.22用量筒取10mol/L NaOH溶液5ml,倒入500ml试剂瓶中,加水稀释至500ml,盖上橡皮塞并摇匀。
4.3用酸和碱溶液分别润洗滴定管,在滴定管中加入酸溶液,将液面调到0刻度线或以下,读出初始读数。
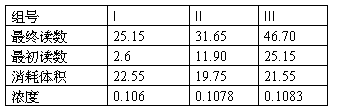
4.4用分析天平称量0.11~0.14g Na2CO3固体3份,置于3个250ml的锥形瓶中,加20~30ml水后加入2滴甲基橙指示剂,分别用盐酸滴定至溶液由黄色变橙色,读出读数
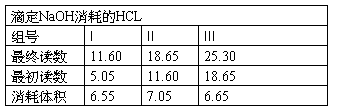
4.5用盐酸滴定NaOH溶液,至溶液由黄色变橙色,实验3次结束
5.结果记录
消耗的HCL
Na2CO3的质量
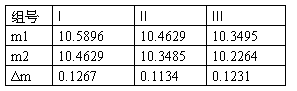
5.1由消耗的HCL和Na2CO3的质量可算出HCL的浓度c=(0.106+0.1083+0.1078)/3=0.1074
5.2由滴定NaOH消耗的HCL算得NaOH的浓度c=0.0291mol/L
滴定Na2CO3  滴定NaOH
滴定NaOH 
6.总结讨论
这次滴定过程中要求合理掌握溶液流出的速度,在第一次实验时我掌握得不够好,,所以溶液偏红,这会导致误差,之后能较好地掌握速度,开始应该比较快,到后来就稍微慢点,最后再一滴一滴地滴,或者半滴,直到溶液变成橙色。实验时我的合作者做得比我好,有些地方我都向她学习,希望实验做得更好,也希望以后合作更加愉快。
2010/3/15
资料: 





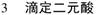
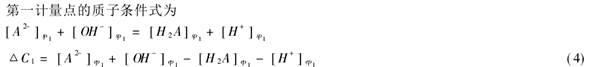
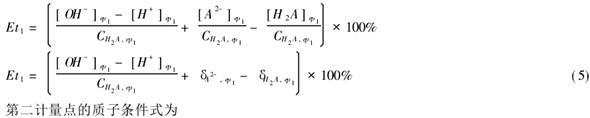
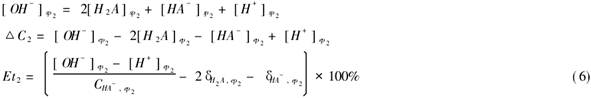
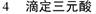
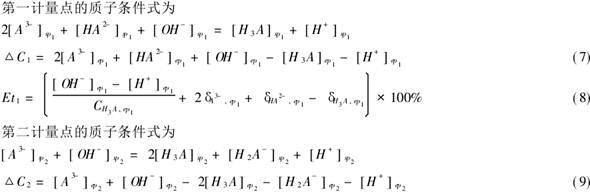
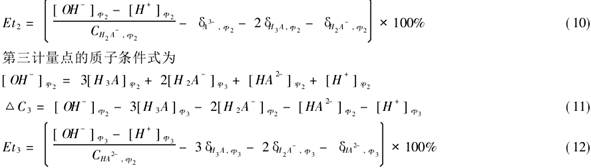
5. 


第二篇:分析化学实验 酸碱溶液的配制和浓度的比较
实验一 酸碱溶液的配制和浓度的比较
重点:①酸碱滴定管的洗涤、调零,滴定管体积读数及滴定管的正确使用;②有效数字的取用。 难点:指示终点的判别(强调近终点时逐滴加入,并用锥形瓶内壁将滴定剂靠下,尽量控制半滴的加入)。
一、实验目的
1、学习滴定管的基本使用方法
2、掌握滴定操作的要领,掌握滴定终点的判断和滴定管的读数方法
3、学习酸碱溶液的配制方法
二、实验原理
滴定分析法是将滴定剂(已知准确浓度的标准溶液)滴加到含有被测组分的试液中,直到化学反应完全时为止,然后根据滴定剂的浓度和消耗的体积计算被测组分含量的一种方法。
三、仪器和试剂
50mL酸式滴定管;50mL碱式滴定管;250mL锥形瓶;
NaOH(s);浓HCl(ρ=1.18g.mL);酚酞2g.L乙醇溶液;甲基橙1g.L水溶液。
四、实验内容
1、溶液的配制
① 0.1mol.LHCl溶液的配制(量取4-4.5mL浓HCl配制成500mL溶液)
② 0.1mol.LNaOH溶液的配制(称取2gNaOH配制成500mL溶液)
2、滴定管的使用方法
①使用前的检查与准备 (三步洗)
②操作溶液的加入 (用操作溶液10mL润洗2-3次→加入标准溶液后→排气泡→调零) ③滴定管的读数
3、滴定分析操作练习
① 从酸式滴定管放25mLHCl于锥形瓶中→加入1-2滴酚酞→用NaOH溶液滴定至微红色(半分钟不褪色)(平行滴定三次)
② 从碱式滴定管放25mLNaOH于锥形瓶中→加入1-2滴甲基橙→用HCl溶液滴定由黄色至橙色(平行滴定三次)
五、数据记录与处理
六、注意事项
1、检查旋塞转动是否灵活,是否漏水。
2、应先擦干旋塞和旋塞槽内的水,再按正确的方法涂上少许凡士林。
3、将操作溶液倒入滴定管之前,应将其摇匀,直接倒入滴定管中,不得借用任何别的器皿,以免标准溶液浓度改变或造成污染。
4、兰带滴定管及有色溶液的读数方法。 -1-1-1-1-1
七、实验讨论
1、HC1和NaOH标准溶液能否用直接配制法配制?为什么?
答:浓HCl浓度不确定,易挥发;NaOH不易制纯,在空气中易吸收CO2和水份。因此,酸碱标准溶液要采用间接配制法配制,即先配制成近似浓度的溶液,再用基准物质标定。
2、配制酸碱标准溶液时,为什么用量筒量取HC1,用台秤称取NaOH(s),而不用吸量管和分析天平?
答:因为采用的是间接配制法,浓度不十分准确,所以就不需要使用准确度十分高的仪器。
3、标准溶液装入滴定管之前,为什么要用该溶液润洗滴定管2-3次?而锥形瓶是否也需先用该溶液润洗或烘干,为什么?
答:滴定管经过蒸馏水反复清洗之后,会残留少量的蒸馏水,用标准溶液润洗2-3次,可防止标准溶液浓度的改变。
锥形瓶不需要用溶液润洗或烘干,因为放入锥形瓶中的溶液的体积和物质摩尔数是一定的。
4、滴定至临近终点时加入半滴的操作是怎样进行的?
答:轻轻挤压皮管中的玻璃球或轻微旋转活塞,使滴定管中溶液悬于尖嘴口,将锥形瓶轻轻靠上,清尖嘴口溶液沿瓶壁淌下,然后用少许蒸馏水冲洗锥形瓶瓶壁。
- 酸碱标准溶液浓度的标定
-
实验报告_酸碱标准溶液的配制和标定
大学化学实验实验一酸碱标准溶液的配制和标定实验目的1掌握标准溶液的配制方法2掌握滴定法定量测定溶液浓度的原理熟悉滴定管移液管的准备…
-
_酸碱标准溶液浓度的标定3
酸碱标准溶液浓度的标定院系化学化工系年级专业10级化学师范姓名孙璇璇手机号码182xxxxxxxx一实验目的1通过中和滴定实验掌握…
-
实验三 酸碱标准溶液配制、浓度的比较和标定
实验三酸碱标准溶液配制浓度的比较和标定1实验目的11熟练分析天平的使用方法12掌握酸碱标准溶液的配制浓度的比较和标定的表达2实验仪…
-
实验 酸碱标准溶液的配制和标定
酸碱标准溶液的配制和标定20xx1213化学化工系11化工与制药2班蒋晓濛手机号150xxxxxxxx一实验目的1掌握NaOHHC…
-
实验报告_酸碱标准溶液的配制和标定
大学化学实验实验一酸碱标准溶液的配制和标定实验目的1掌握标准溶液的配制方法2掌握滴定法定量测定溶液浓度的原理熟悉滴定管移液管的准备…
-
化学实验报告——盐酸溶液的标定
化学实验报告无机及分析化学题目盐酸溶液的标定学院班级姓名学号指导老师年月日制时间盐酸浓度的标定一实验目的1练习酸碱标准溶液的标定方…
-
实验二 酸碱标准溶液的配制和浓度比较
实验二酸碱标准溶液的配制和浓度比较一实验目的1巩固滴定管的使用学习移液管的使用方法2掌握NaOHHCI标准溶液的配制浓度的比较滴定…
-
实验三 酸碱标准溶液的配制和标定
基础化学实验教案一授课计划1基础化学实验教案二课时教学内容2基础化学实验教案3基础化学实验教案4基础化学实验教案5基础化学实验教案…
-
实验 酸碱标准溶液的配制和标定
酸碱标准溶液的配制和标定20xx1213化学化工系11化工与制药2班蒋晓濛手机号150xxxxxxxx一实验目的1掌握NaOHHC…
-
实验一 1酸碱标准溶液的配制标定
实验一1酸碱标准溶液的配制标定2有机酸摩尔质量测定一实验目的1巩固分析天平使用方法及熟悉滴定方法2掌握用基准物质标定盐酸溶液的方法…