实验十五 过氧化氢催化分解
2.3 动力学部分
实验十五 过氧化氢催化分解
1 目的要求
(1) 测定过氧化氢分解的反应速度常数。
(2) 了解用体积法研究动力学的基本原理。
(3) 了解实验测定活化能E的原理和方法。
2 基本原理
过氧化氢在没有催化剂时,分解反应进行得很慢,加入催化剂时能促进其分解。过氧化氢分解的化学计量式如下:
H2O2→H2O+1/2O2
很多物质都能对这一反应起催化作用,如铂、银、铅、二氧化锰、三氯化铁以及三氯化铁和氯化铜的混合物等。本实验是以三氯化铁和氯化铜混合物作催化剂,研究H2O2分解反应的动力学。其中CuCl2是助催化剂,单独使用它,并不能催化该反应。
在本实验条件下,过氧化氢的分解是一级反应。若 以 a 表示H2O2的起始浓度,x表示在时刻 t 时已经分解掉的H2O2的浓度,则所剩余的H2O2的浓度为(a-x),于是有:

积分上式: ln(a-x)= -k1t + lna
式中k1为反应速率常数,它的大小表征着反应速率的快慢。lna为积分常数,可由t=0,x=0这一边界条件得出。
在H2O2的催化分解中,t 时刻H2O2的浓度Ct 可通过测量在相应的时间内分解放出的氧气的体积得出。因分解过程中放出氧气的体积与分解了的H2O2的浓度成正比,其比例常数为定值。.令V∞ 表示H2O2全部分解放出的氧气体积,Vt 表示H2O2在 t 时刻分解放出的氧气的体积,则:
C0 ∝V∞; Ct∝(V∞-Vt)
式中,C0、Ct分别代表H2O2在t = 0 和 t =t 时的浓度。将上面关系式代入一级反应速率方程的定积分表达式,则有:

或者 lg(V∞-Vt) = - k1t/2.303 + lgV∞,
根据上式,如果以lg(V∞-Vt)对t作图得一直线,即可验证该反应是一级反应。此时由直线的斜率可求出反应速率常数k1。
V∞可由两种方法得出:
(1)实验得出。
(2)公式算出:
计算公式如下:按H2O2分解反应的化学计量式,1mol H2O2放出1/2molO2。在酸性溶液中以KMnO4标准溶液滴定H2O2溶液,V∞则等于:
V∞ =MH2O2·VH2O2·RT/p (m3)
式中:MH2O2·——H2O2的起始摩尔浓度mol·L-1;
V H2O2——H2O2溶液的体积(m 3);
p——氧气的分压,即大气压减去实验温度下水的饱和蒸气压(Pa);
T ——实验的热力学温度(K);
R——气体常数,取8.314J·K-1·mol-1。
由于这种方法需用KMnO4滴定H2O2的浓度,比较麻烦,所以一般都用实验法直接获得。 如果我们改变分解反应的温度,求得不同温度下的反应速率常数k1,则根据阿仑尼乌斯公式,有:

积分后可知,若以lnk对1/T作图,由斜率则可求得在该反应温度范围内的平均活化能。
体积法是研究化学反应动力学的基本方法之一。只要反应过程中体系的体积发生明显的变化,一般都可用这种方法研究该反应的动力学。
3 仪器试剂
恒温槽 1套;秒表 1只;
混合液 0.05mol·L-1FeCl3-0.005mol·L-1CuCl2-0.4mol·L-1HCl;0.2mol ·L-1H2O2
4 实验步骤
(1) 实验装置图如图2.15.1所示。
实验前需检查测量系统是否漏气,为此,打开活塞A,拔开塞子B,提高水准瓶C,使量气管D内的水面升至上部,关闭活塞A,把水准瓶放在桌面上。塞紧塞子B,打开活塞A,任水面自!由下落,若降至某一位置保持静止,则证明系统不漏气,即可开始实验。
(2) 拔开塞子B,打开活塞A,提高水准瓶C,使D管内的水平面升至量气管0刻度以上, 关闭A。再调节A,使D管内的水面恰在刻度0的位置。移取20mL H2O2溶液注入B,加入 10mL混合液,随即把塞子塞紧。此时H2O2已开始分解,不断调节活塞A,使量气管内两壁的水面保持相同,当气体放出速度趋于稳定后(约10min),记下D管内水平面的刻度,同时打开秒表,每5min记录一次D管内水面的位置。记录8个~10个数据。
为得到H2O2全部分解后的体积V∞,将测得8个~10个Vt 后的试管瓶放在80℃水浴中加热,并不断摇动,待反应管内不再有气泡放出为止。取出反应管,仍放回原恒温槽内恒温后,读取量气管内水面刻度,即V∞数值。

图2.15.1 过氧化氢分解装置
本实验可用来求H2O2分解反应的活化能,改变反应温度,分别测定25℃、30℃、35℃、40℃等温度下的速率常数,方法同上。
5 数据处理
(1)可按下列格式记录实验数据。
室温: 大气压: 恒温槽温度: V∞=

(2)以lg(V∞-Vt)为纵坐标,时间t 为横坐标作lg(V∞-Vt) — t图。由直线斜率计算分解反应的速率常数k/min-1。
6 注重事项
(1) 气体的体积受温度和压力影响较大,在实验中要保证所测得的Vt和V∞都是在相同的温度和压力下的数据。
(2 )要真正搞清楚动力学方程中Vt、V∞的含义,这样,在进行数据处理时就不会出现错误。
7思考题
反应速率常数与哪些因素有关?为什么在每次读取Vt或V∞时,一定要调整量气管两壁的水面相平?
第二篇:实验14 过氧化氢催化分解反应速率常数的测定
第 次课 4 学时







实验14 过氧化氢催化分解反应速率常数的测定
一、实验目的
1. 测定过氧化氢催化分解反应速率常数;
2. 掌握通过测量反应系统的体积跟踪反应系统浓度从而研究反应速率的方法。
二、实验原理
过氧化氢在没有催化剂存在时,分解反应进行的很慢。加入催化剂能够提高分解速率。过氧化氢分解反应的化学计量式如下:
H2O2(l) = H2O(l) + 1/2O2(g)
若以KI为催化剂,在KI作用下催化分解步骤为:
KI(l) + H2O2(l) = KIO + H2O(l) (慢)
KIO = KI(l) + 1/2O2(g)
由于第一步的速率比第二步慢得多,所以,第一步为反应的控制步骤。因而可以假定其反应的速率方程式为:
-dcA/dt =k’cKIcA
式中,cA为反应系统中反应到t时刻H2O2浓度,因KI在反应过程中浓度不变,故上式可简化为
- dIcA/dt = kIcA (14.1)
式中k=k’cKI, 将上式分离变量积分:
当 t=0 时, CA=C0 ;
t=t 时, CA=C t;
定积分式为:
 (14.2)
(14.2)
积分结果:
 (14.3)
(14.3)
式是 的直线方程。反应进行过程中,测定不同时刻 t 时反应系统中氧气的浓度ct,取得若干组ct、t 的数据后,以lnct对t 作图,得一直线,表明该反应为一级反应(准一级反应),直线斜率为-k。
的直线方程。反应进行过程中,测定不同时刻 t 时反应系统中氧气的浓度ct,取得若干组ct、t 的数据后,以lnct对t 作图,得一直线,表明该反应为一级反应(准一级反应),直线斜率为-k。
物理化学的研究方法是采用物理的方法测定反应系统某组分的浓度,所谓物理的方法是利用反应系统某组分或各组分的某些物理性质(如体积、压力、电动势、折光率、旋光度等)与其有确定的单值函数关系的特征,通过测量系统中该物理性质的变化,间接测量浓度变化。此种物理化学的实验方法最大的优点是可以跟踪系统某组分或各组分的物理性质的变化,从而,不需要终止反应,便可以随时测定某一时刻反应系统某组分或各组分的浓度。
在H2O2催化分解过程中t时刻H2O2的浓度可通过测量相应的时间内分解放出的氧气的体积得出。放出的氧气的体积与分解了的H2O2的量成正比,其比例系数为定值。令V∞表示H2O2全部分解放出的氧气的体积,V t表示H2O2在t时刻分解放出的氧气体积,则:
co ∝V∞, ct ∝ (V∞-Vt)
将上述关系代入(14.3)式,得:
ln(V∞-Vt)= - kt + ln V∞ (14.4)
如果以ln(V∞-Vt)对t 作图得一直线,即验证是一级反应;由直线斜率m可求出速率常数k,m = - k 。
(14.4)为ln(V∞-Vt)~ -t的直线方程,式中V∞为H2O2全部分解放出的氧气体积,反应温度及KI浓度一定时,它不随时间改变。实验过程中只需要测定反应进行的不同时刻t时H2O2分解放出的氧气体积t(若干个数据)和反应终了时H2O2全部分解放出的氧气体积V∞(一个数据),以ln(V∞-Vt)对t作图得一直线,直线斜率为-k,用作图法可求出反应速率常数k。
V∞也可以不测,由“数据处理”中介绍的方法计算得到。
因数据是等时间间隔记录,按拉格朗日中值定理可知,
 (14.5)
(14.5)
则有
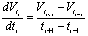 (14.6)
(14.6)
由此作出ln(dVt/dt)—t图,数据结果具有很强的线性规律,求出直线的斜率m即可得到其反应速率常数k/min-1=-m。
三、仪器和药品
实验装置一套(图14.1过氧化氢催化分解反应实验装置),2ml移液管1支,25ml移液管1支,1.0mol/dm3KI水溶液,3℅H2O2水溶液,表一块,反应器(锥形瓶)一只,备用针头一个,蒸馏水瓶一个。
四、实验步骤
1. 按图14.1安装好实验装置。

图14.1 过氧化氢催化分解装置图
1—量气管;2—玻璃旋塞;3—装有肥皂液的胶头;4—单向鼓气球;
5—磁力搅拌器;6—恒温水浴槽;7—反应器;8—温度计
2. 反应器7中放入搅拌子,加入蒸馏水50ml;并移取3ml3% H2O2溶液,同时放入反应器7中。
3. 取下医用注射器,注射器上按上备用针头,吸取多于3ml的KI溶液(1mol·dm-3)将医用注射器中的KI溶液在备用锥形瓶中推至3ml处;拔下备用针头,将医用注射器按装在注射针头上,塞紧胶塞。
4.润湿量气管1(皂沫流量计)。润湿时,一只手夹住另一边的皮管2,慢慢压气(不能着急),一直到量气管顶端。
5. 测量反应开始后反应系统中不同时刻氧气体积。
开动磁力搅拌器5,并将医用注射器中3mlKI溶液推入反应器(锥形瓶),与其中的H2O2溶液混合,同时开始读表计时。反应即在室温下开始进行。
每隔2分钟读取一次量气管收集的氧气体积数据,持续反应30分钟,读取16组时间t与体积Vt数据。
6.检验数据,作Vt-t的草图。
7.倒掉废液,清洗玻璃仪器和针头,整理实验台。
五、实验注意事项
1. 反应开始前,先开启搅拌器,再加入催化剂,注意顺序!加入催化剂要一次完成!
2. 搅拌速度要快速,不要有噪音,开始反应后,不能随意调节搅拌速度!
3. 检查漏气,以肥皂泡不向下移动为合格。
4. 找一个质量好的气泡(很关键)。
5. 从t=0,记录到t=30分钟,每隔2分钟记录一次数据。
6. 量气管50在下边,当0看待。记录累加数据。
7. 最后记录好数据后,求出相邻两数据的差值备查。
六、实验记录
实验温度:测量前T0= 25.1 ℃; 测量前Td= 24.9 ℃; 平均温度Tm= 25 ℃
大气压强:测量前P0=101.94 kPa; 测量后 Pd= 101.98 kPa; 平均大气压强:101.96 kPa
KI溶液原始浓度 c0= 1.0 mol/dm3; KI的反应液浓度cd= 0.0536 mol/dm3;
H2O2溶液原始浓度c0= 0.88 mol/dm3; H2O2的反应液浓度cd= 0.047 mol/dm3。
表14.1 实验数据记录表

七、实验数据处理
1. 实验数据的校正
由于反应体系有水存在,故计量的氧气体积中有水蒸气存在,因此需要校正,扣除水蒸气。校正公式为:

2.不测V∞求取速率常数(参见郭子成等,简单一级反应数据处理的一个新模型, 化学通报, 2000,63(4),47)的方法。
将(14.4)式变形为:
V∞ - Vt = V∞e-kt (14.5)
将上式对时间求导数得:
dVt/dt = kV∞e-kt (14.6)
再取对数得:
ln(dVt/dt)= ln(kV∞)-kt (14.7)
显然,以ln(dVt/dt)对t 作图得一直线,由直线的斜率即可求得k。具体作法是:将测得的Vt~t 数据作图并进行圆滑处理,在圆滑后的曲线上用镜面法求不同时刻t时的dVt/dt值,有了dVt/dt数据,即可按本法获取速率常数。dVt/dt值也可按等面积图解微分法在圆滑曲线上取值获得,具体方法见《物理化学》第四版,第212~215页例11.3.1(王正烈等编,高等教育出版社出版)。
表 14.2 不测V∞数据处理记录表1



直线的斜率m=-0.03,所以反应的速率常数k=-m=0.03min-1。
八 实验思考练习
⒈ 如何检查漏气?
答:观察几分钟,产生的肥皂泡不下降。
2. 若用加热法获得V∞,以ln(V∞-Vt)对t 作图,再求速率常数,其V∞、Vt 必须用公式 V校正 = V测量(1-P水/P大气)进行校正吗?
答:不需要校正。因为校正系数1-P水/P大气不变。
3.加入3%H2O2的量的多少对测定速率常数有否影响?KI的量呢?
答:H2O2的量的多少对测定速率常数无影响,催化剂KI的量有影响。
-
过氧化氢的催化分解实验报告
过氧化氢的催化分解一实验目的1用静态法测定H2O2分解反应的速度常数和半衰期2熟悉一级反应特点了解反应物浓度温度催化剂等因素对一级…
-
过氧化氢催化剂的研究 实验报告
过氧化氢催化剂的研究摘要过氧化氢是目前实验室制取氧气安全廉价的试剂由于过氧键的特殊性质有各种各样的催化剂可供选择本文就过氧化氢催化…
-
过氧化氢的催化分解实验
过氧化氢的催化分解一实验目的1熟悉一级反应特点了解反应浓度温度和催化剂等因素对一级反应速度的影响2用静态法测H2O2分解反应的反应…
-
过氧化氢的催化分解
过氧化氢分解氧气成员罗玉洁何瑾徐丽胡艳骆磊申林一实验目的1掌握实验室用双氧水制备氧气的原理装置和操作2了解影响双氧水制备氧气反应速…
-
实验十五 过氧化氢催化分解
23动力学部分实验十五过氧化氢催化分解1目的要求1测定过氧化氢分解的反应速度常数2了解用体积法研究动力学的基本原理3了解实验测定活…
-
过氧化氢的催化分解实验报告
过氧化氢的催化分解一实验目的1用静态法测定H2O2分解反应的速度常数和半衰期2熟悉一级反应特点了解反应物浓度温度催化剂等因素对一级…
-
实验14 过氧化氢催化分解反应速率常数的测定
河北科技大学教案用纸第次课4学时第1页河北科技大学教案用纸实验14过氧化氢催化分解反应速率常数的测定一实验目的1测定过氧化氢催化分…
-
过氧化氢催化剂的研究 实验报告
过氧化氢催化剂的研究摘要过氧化氢是目前实验室制取氧气安全廉价的试剂由于过氧键的特殊性质有各种各样的催化剂可供选择本文就过氧化氢催化…
-
过氧化氢催化分解反应速率常数的测定
过氧化氢催化分解反应速率常数的测定标签化学实验报告过氧化氢反应速率常数教育分类药学资料一实验目的1了解过氧化氢催化分解反应速率常数…
-
探究不同催化剂对过氧化氢分解反应速率的影响 教案
课题探究不同催化剂对过氧化氢分解反应速率的影响一教材依据教材版本苏教版普通高中课程标准实验教科书实验化学选修课题名称42催化剂对过…
-
实验报告探究不同条件下过氧化氢的分解
实验比较过氧化氢在不同条件下的分解目的要求通过比较过氧化氢在不同条件下分解的快慢了解过氧化氢酶的作用和意义实验材料新鲜的质量分数为…