化学实验技能操作大赛——自来水硬度的测定


实验室用自来水总硬度测定报告
参赛小组成员:郑玉波、李文
水的总硬度测定
——“实验技能操作大赛”实验室用自来水总硬度分析
20##年11月5日
化学工程与食品科学学院实验室(N3-305)
实验技能大赛第十组参赛小组

第二篇:自来水硬度的测定
自来水硬度的测定
姓名:刘磊 专业:应化 班级:093 学号:2009014045
实验日期:2012年 06 月11日 成绩:
摘要:本实验采用了络合滴定来测定自来水的总硬度的方法,以及相应Ca2+、Mg2+硬度的测定,在分析测定之后得到水样的总硬度为31.02 mg/L,Ca2+硬度为22.31 mg/L,Mg2+硬度为8.71mg/L,均比国标低满足城市居民饮用水要求。
关键词:水的硬度 EDTA 铬黑T
1引言
近年来,社会越来越关注“绿色水资源”的问题,科研工作者致力于探索新型的检测、净化水资源等的方法,着重优化现有水资源,提高居民用水质量。另一方面,开发新的检测方法及相关指示剂在水的硬度测定上也占据着重要的地位。
自从上世纪60年代日本水俣病的出现,震惊全球,使越来越多的人开始关注饮用水的质量。同时,水的硬度问题也开始备受关注。所以说,熟悉水的硬度测定方法以及其中Ca2+、Mg2+硬度的测定,具有很强的实际意义。
1.1 水的总硬度的测定
在pH=10的NH3-NH4Cl缓冲溶液中,以铬黑T为指示剂,用EDTA标准溶液滴定溶液中的Ca2+、Mg2+。铬黑T和EDTA都能和Ca2+、Mg2+形成配合物,其配合物稳定性顺序为:[CaY]2- > [MgY]2- > [MgIn]- > [CaIn]-
加入铬黑T后,部分Mg2+与铬黑T形成配合物使溶液呈酒红色。用EDTA滴定时,EDTA先与Ca2+和游离Mg2+反应形成无色的配合物,化学计量点时,EDTA夺取指示剂配合物中的Mg2+,是指示剂游离出来,溶液有酒红色变成纯蓝色即为终点。
滴定前: Mg2+ + HIn2-←→ [MgIn]- + H+
纯蓝色 酒红色
化学计量点前 : Ca2+ + H2Y2-←→[CaY]2- + 2H+
Mg2+ + H2Y2-←→[MgY]2- + 2H+
化学计量点时 : [MgIn]- + H2Y2- ←→ [MgY]2- + HIn- + H+
酒红色 纯蓝色
根据消耗的EDTA 标准溶液的体积 V1 计算水的总硬度。
1.2 钙、镁含量的测定
取与测定总硬度时相同体积的水样, 加入NaOH调节pH=12,Mg2+ 即形成 Mg(OH)2 沉淀。然后加人钙指示剂, Ca2+与钙指示剂形成红色配合物。用EDTA 滴定时,EDTA 先与游离Ca2+形成配合物, 再夺取已与指示剂配位的Ca2+ ,使指示剂游离出来, 溶液由红色变为纯蓝色。由消耗EDTA标准溶液的体积V2计算钙的含量。再由测总硬度时消耗的EDTA体积V1和V2的差值计算出镁的含量。
水中若含有Fe3+、A13+, 可加三乙醇胺掩蔽;若有Cu2+、Pb2+、Zn2+等 , 可用Na2S或KCN掩蔽。
2实验
2.1仪器和试剂
烧杯(大中小各一),移液管(50.00mL,25.00mL,10.00 mL各一支),滴定管(50 mL),铁架台,锥形瓶250 mL(4个),表面皿,胶头滴管,容量瓶250 mL(2个),PH试纸
ZnO (A.R) 氨水(A.R) NH4Cl(A.R)
HCl(A.R) 甲基红指示剂 铬黑T指示剂
EDTA二钠盐(A.R) 去离子水
2.2实验步骤
1、EDTA的标定
准确称取0.0746g已于800℃灼烧至恒重的基准ZnO于小烧杯中,先用少量蒸馏水润湿,加(1+1)HCl 10mL,盖上表面皿,使其溶解。待溶解完全后,吹洗表面皿,将溶液定量转移至100mL容量瓶中,用水稀释至刻度线。
用移液管移取10.00mLZn2+溶液于锥形瓶中,滴加甲基红指示剂1滴,用(1+2)氨水调节Zn2+溶液至微黄色。再加20mL水和10mLNH3-NH4Cl缓冲溶液,摇匀。加3滴铬黑T指示剂,用EDTA标准滴定溶液滴定至溶液由紫红色变为纯蓝色,即为终点。平行滴定3次。根据滴定用去的EDTA体积和ZnO质量,计算EDTA标准滴定溶液的准确浓度。
2、水的总硬度测定
用移液管移取水样 100.O0ml, 置于250ml锥形瓶中, 加 5ml三乙醇胺 ( 无Fe3+、 A13+时可不加), 摇匀。加 5ml pH=10的NH3·H20-NH4Cl缓冲溶液, 加铬黑T 指示剂约 0.1g ( 或溶液 5 滴 ), 用 EDTA 标准溶液滴定至溶液由酒红色变为纯蓝色, 记下EDTA 用量V1。平行测定3 次。计算水的总硬度。
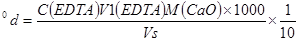
3、钙、镁含量的测定
用移液管移取水样 1000.OOml, 置于250ml锥形瓶 , 加5ml 三乙醇胺 (无Fe3+、 A13+ 时可不加), 摇匀。再加 2ml 10% NaOH, 摇匀后加钙指示剂少许( 约 0.1g), 用 EDTA 标准溶液滴定至溶液由红色变为纯蓝色, 记录 EDTA 用量 V2。平行测定 3 次。计算水中钙和镁的质量浓度。
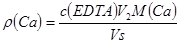
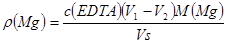
3结果与讨论
实验室条件下用0.0746gd的氧化锌标定EDTA的相关数据如下表3-1
室温下EDTA浓度标定表格
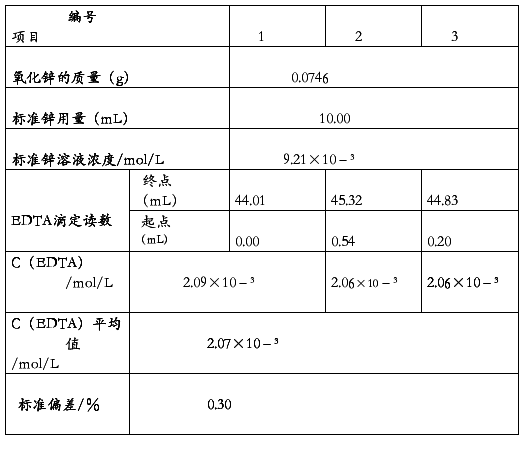
表3-1
由表3-1可知,EDTA浓度为 2.07×10﹣³mol/L,标准偏差为0.30,误差较小,满足实验要求,说明用该氧化锌标定的EDTA可以用于其他物质的标定基准物。
相应计算公式:
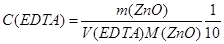
实验室条件下100.00mL水样用EDTA标定的相关数据如下表3-2
室温下自来水样硬度的测定表格
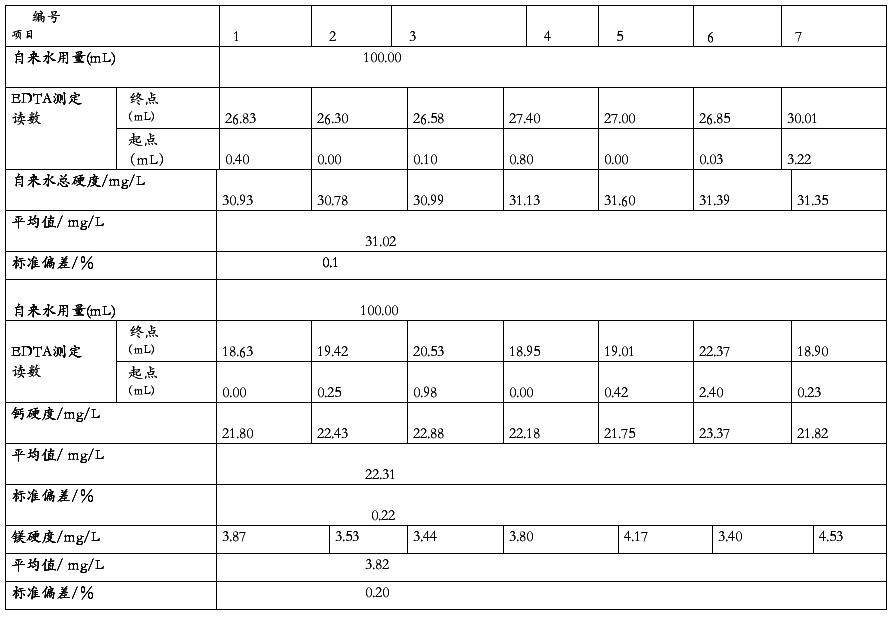
表3-2
由表3-2可知自来水样的总硬度为31.02 mg/L,钙硬度为22.31 mg/L,镁硬度为3.82 mg/L,均较国标值低,满足城市居民饮用水要求,故而该自来水样合格。
相应计算公式:
自来水总硬度: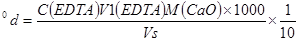
钙硬度: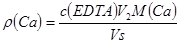
镁硬度: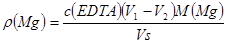
4结论
我国生活饮用水规定,总硬度以CaCO3计,不得超过450mg/L,本实验中测得自来水样中硬度折合为CaCO3,约为55.8 mg/L,硬度较小,合格。
5注意事项
1、铬黑 T 指示剂的用量不可太大,否则影响终点的判断。
2、贮存 EDTA 溶液应选用硬质玻璃瓶,最好是长期贮存 EDTA 溶液的瓶子,以免 EDTA 与玻璃中的金属离子作用。如用聚乙烯瓶贮存则更好。
3、加入氨试剂时要慢慢加入,仔细观察白色混浊的出现,不可加过量,否则 pH 值过大终点不明显。
4、本实验终点不够敏锐,特别是滴定钙。强调近终点要慢滴,每滴1滴后都要充分摇匀,直至纯蓝色为止。
5、用EDTA测定测定水的总硬度及钙镁含量时,要控制好pH,并注意好终点颜色变化,以防止滴过。
6参考文献
【1】 杨梅,主编,分析化学实验,华东理工大学出版社,2005.8
【2】 邹明珠,主编,分析化学教程,高等教育出版社,2008.10
【3】 宋天佑,主编,无机化学,高等教育出版社,2010.4
【4】 董元彦,主编,无机及分析化学,科学出版社,2001.1
- 实验6 自来水总硬度的测定
-
EDTA标准溶液的标定和水的硬度测定(实验报告)
EDTA标准溶液的标定和水的硬度测定四川农业大学生命科学与理学院625014应用化学092王雨20xx6824摘要本实验利用络合滴…
-
水硬度的测定实验报告
EDTA溶液的配制与标定和水中硬度的测定实验日期年月日处理对象实验内容EDTA溶液的配制与标定和水中硬度的测定实验原理1EDTA标…
-
化学实验技能操作大赛——自来水硬度的测定
实验室用自来水总硬度测定报告参赛小组成员郑玉波李文水的总硬度测定实验技能操作大赛实验室用自来水总硬度分析20xx年11月5日化学工…
-
实验报告格式-天然水总硬度的测定
实验报告格式实验日期实验地点指导教师实验名称天然水总硬度的测定一实验目的1掌握EDTA标准溶液的配置和标定方法2掌握EBT指示剂的…
-
实验报告格式-天然水总硬度的测定
实验报告格式实验日期实验地点指导教师实验名称天然水总硬度的测定一实验目的1掌握EDTA标准溶液的配置和标定方法2掌握EBT指示剂的…
-
水硬度的测定实验报告
EDTA溶液的配制与标定和水中硬度的测定实验日期年月日处理对象实验内容EDTA溶液的配制与标定和水中硬度的测定实验原理1EDTA标…
-
EDTA标准溶液的标定和水的硬度测定(实验报告)
EDTA标准溶液的标定和水的硬度测定四川农业大学生命科学与理学院625014应用化学092王雨20xx6824摘要本实验利用络合滴…
-
实验五 自来水总硬度的测定 (EDTA的标定)
实验五自来水总硬度的测定EDTA的标定4学时一实验目的1掌握EDTA标准溶液的配制和标定原理了解EDTA的性质和用途2了解水的硬度…
- 实验6 自来水总硬度的测定
-
浙江远程实验报告格式-天然水总硬度的测定
实验报告格式实验日期实验地点指导教师实验名称天然水总硬度的测定一实验目的1掌握EDTA标准溶液的配置和标定方法2掌握EBT指示剂的…