碱式碳酸铜的制备
碱式碳酸铜的制备
[摘要]
探究大学无机化学实验中有关碱式碳酸铜制备的实验方法,碱式碳酸铜制备实验的最佳反应条件,讨论反应的最佳配比,以及生成物颜色、状态、温度等因素对碱式碳酸铜的影响。
本实验目的在于通过碱式碳酸铜制备条件的探求和生成物颜色状态的分析,研究反应物的合理配料比,确定制备反应的合适温度条件,以培养独立设计实验的能力. [关键词]碱式碳酸铜;制备;反应条件;温度;配料比;产率; 【前言】
碱式碳酸铜化学式为CU2(OH)2CO3,分子量为221.12美观的绿色粉末状晶体. 相对密度为3.8525,加热至220℃时分解.不溶于水和乙醇,溶于酸形成相应的铜盐,溶于氰化物、氨水、铵盐和碱金属碳酸盐的水溶液中,形成铜的配合物.在水中煮沸或在强碱溶液中加热时则可生成褐色的氧化铜.可与硫化氢反应生成硫化铜.在自然界中以孔雀石的形式存在.
(1)碱式碳酸铜是一种具有广泛用途的化工产品。其主要用于制造油漆、颜料、烟火、杀虫剂、其他铜盐和固体荧光粉激活剂等,也用于种子处理及作杀菌剂等.
(2)碱式碳酸铜为天然孔雀石的主要成分,呈暗红色或淡蓝色,加热至200℃即分解。
(3)碱式碳酸铜属单斜晶系,易溶于酸和氨水,在水中溶解度很小,新制备的试样在沸水中很易分解。
(4)碱式碳酸铜最常用的生产方式有硫酸铜法,硝酸铜法和氨法。
制备碱式碳酸铜有如下的的几种方法:
①由Na2CO3·10H2O跟CuSO4·5H2O反应制备
②由Na2CO3溶液跟CuSO4溶液反应制备
③由NaHCO3跟CuSO4·5H2O反应制备
④由Cu(NO3)2跟Na2CO3反应制备
在此,我采用由Na2CO3溶液跟CuSO4溶液反应制备并计算其产率。 。
[正文]
1.实验原理:
碱式碳酸铜制备的原理: CuSO4·5H2O与Na2CO3在合适的配比及温度下反应:
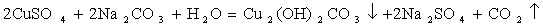
2.用品
(1)药品: CuSO4·5H2O, Na2CO3(s);蒸馏水
(2)仪器:台秤,容量瓶(250ml),胶头滴管,烧杯,带标号的试管(10支),玻璃棒,水浴锅,布氏漏斗及吸滤瓶,恒温水浴箱,循环水真空泵,移液管,洗耳球,
(3)材料:滤纸,纸条.
3.实验步骤
(1)溶液的配制
称取12.5g CuSO4固体和5.3g Na2CO3固体,分别溶解于两支烧杯中后转移至100ml容量瓶,定容,摇匀.
CuSO4·5H2O的质量:m=MCV=250×0.1×0.5g=12.5g
Na2CO3固体的质量:m=MCV=106×0.1×0.5g=5.3g
(2)反应合适条件的探究
①反应物合适配比的探究
在4支小试管中分别加入2.0ml 0.5mol/L的CuSO4(aq),再将1.6ml,2.0ml,2.4ml,2.8ml 0.5mol/L的Na2CO3(aq)分别加入到另外的4支小试管中.75℃水浴数分钟后依次将CuSO4(aq)倒入Na2CO3(aq)中,振荡,比较沉淀生成速度、状态、数量及颜色,选择合适配比.
②合适反应温度的探究
在5支小试管中分别加入2.0ml 0.5mol/L的CuSO4(aq),再将合适配比的Na2CO3(aq)置于另5支试管中,分为5组,分别于室温、40℃水浴、60℃水浴、80℃、100℃下静置片刻,后将CuSO4(aq)倒入Na2CO3(aq)中,振荡,比较沉淀生成速度、状态、数量及颜色,确定合适温度.
(3)碱式碳酸铜的制备
取30ml 0.5mol/L的CuSO4(aq)及36ml 0.5mol/L的Na2CO3(aq)在60℃下水浴,至溶液明显分层且上层液体无色澄清时沉淀完全,用清洗法洗涤沉淀数次至检测不出SO42-,抽滤,100℃烘干半小时,待干燥,称量计算产率.
4.实验数据的记录与处理
表4.1 CuSO4和NaCO3的合适配比 75℃水浴
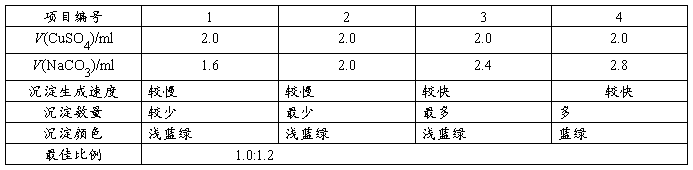
由表4.1沉淀数量得到CuSO4和NaCO3的最佳配比为1:1.2;
表4.2 CuSO4和NaCO3的反应温度

根据表4.2沉淀颜色得到最佳温度为 60℃;
表4.3 产品的制备

5.实验讨论
(1)根据沉淀的数量所得:实验中沉淀生成的速度很快,区分不同配比之间的速度快慢有一定困难;沉淀生成的颜色均为蓝色,且放置一段时间后,颜色均变为绿色,此项也不能作为配比依据.沉淀的数量开始无明显差别,但放置一段时间,合适配比中生成较多颗粒沉淀;
(2)根据沉淀生成的颜色知,当T<60℃,所得产品颜色偏蓝;当T>80℃时,产品的颜色偏绿,并会伴随沉淀;而60℃时数量和质量都比较好。实验中沉淀生成的速度与沉淀的数量相差不多,不能作为判断依据.沉淀的颜色无太大区别。
(3)所得的碱式碳酸铜为绿色粉末状。
(4)实验中出现问题:
①反应比例探求时沉淀生成速度差别不甚明显;
②反应温度探求时生成物性状差异不甚明显;
(5)误差分析:
①分析天平的灵敏度不高;
②滴定终点判断不准确.
(6)实验经验教训的总结:
①实验现象是错综复杂的,故实验条件的探究要多角度入手不能一概而论;
②沉淀的生成和烘干不易温度过高,否则会造成沉淀分解发黑;
(7)结论
①碱式碳酸铜溶液水解呈弱碱,当硫酸铜与碳酸钠比例为1:1.2,此时溶液的pH为8.5,此酸度与0.5mol/L碱式碳酸铜水溶液的pH相当,有利于碱式碳酸铜产品生成。
②温度在60℃,反应温度不宜超过80℃且要处于恒温中,温度过低反应不完全,温度过高则易形成cuo等杂质。
③在优化条件下,碱式碳酸铜产品回收率可达90.10%。
[参考文献]
[1]:北京师范大学无机化学研究室,无机化学实验 北京教育出版社 20##年2月
[2]:甘肃师范大学化学系,简明化学手册 甘肃人民出版社 1980年
[3]:北师大无机室,《无机化学实验》 高等教育出版社 20##年5月
[4]:北师大等校, 《分析化学实验》 高等教育出版社 20##年7月
[5]:周国镇等,《大学基础化学实验(I)》 化学工业出版社 20##年8月
第二篇:实验 碱式碳酸铜的制备
实验 碱式碳酸铜的制备
[实验目的]
1.通过碱式碳酸铜制备条件的探求和生成物颜色、状态的分析,研究反应物的合理配料比并确定制备反应适合的温度条件,以培养独立设计实验的能力。
2.碱式碳酸铜为天然孔雀石的主要成分,呈暗绿色或淡蓝绿色,加热至200oC即分解,在水中的溶解度度很小,新制备的试样在沸水中很易分解。
[实验原理]
2CuSO4 + 2Na2CO3 + H2O=Cu2(OH)2CO3↓ + CO2↑ + Na2SO4
碱式碳酸铜为天然孔雀石的主要成分,呈暗绿色或淡蓝绿色,加热至200℃即分解,在水中的溶解度度很小,新制备的试样在沸水中很易分解。
[实验用品]
仪器:试管、水浴锅、抽滤瓶、布氏漏斗、烧杯
药品:0.5 mol·L-1的CuSO4溶液、0.5 mol·L-1的Na2CO3溶液
材料:滤纸
[实验内容]
一、实验条件的探求
1.温度对碱式碳酸铜制备的影响
取8支试管分成两列,其中4支管内各放2 ml 0.5 mol·L-1的CuSO4溶液,另外4支管中各放2 ml 0.5 mol·L-1的Na2CO3溶液,分别成对置于40 ℃、55 ℃、70 ℃、85 ℃水浴中平衡一段时间,然后将CuSO4溶液倒入Na2CO3溶液的试管中,振荡,再放入各自水浴中,观察沉淀的生成及其转变的快慢、沉淀的颜色。由实验结果得出最佳实验条件。
2.CuSO4和Na2CO3配比的影响
取8支试管分成两列,其中4支试管内各加入2 ml 0.5 mol·L-1CuSO4溶液,另外4支分别加入1.6 ml、2.0 ml、2.4 ml、2.8 ml 0.5 mol·L-1Na2CO3溶液,分别成对置于你所选定温度的水浴中,平衡一段时间后,依次将CuSO4溶液分别倒入Na2CO3溶液的试管中,振荡,观察各试管生成沉淀的颜色、多少及转化的快慢,确定你的配比。
二、碱式碳酸铜的制备
取2只250 ml烧杯,分别加入100 ml、0.5 mol·L-1 CuSO4溶液及你所选择的配比加入0. 5 mol·L-1 Na2CO3溶液,置于你所选定的温度的水浴中平衡,然后将CuSO4溶液倒入Na2CO3溶液的烧杯中,等沉淀下沉后,用倾泌法洗涤沉淀数次,抽滤,用水洗至滤液中不含SO42-为止,将所得产品于50 ℃左右烘1小时,称量,计算产率。
[思考题]
1.除反应物的配比和反应的温度对本实验的结果有影响外,反应物的种类,反应进行的时间等因素是否对反应物的质量也会有影响?
2.自行设计一个实验,来测定产物中铜及碳酸根的含量,从而分析所制得的碱式碳酸铜的质量。
3. 哪些铜盐适合制取碱式碳酸铜?写出硫酸铜溶液和碳酸钠溶液反应的化学方程式。
-
实验二 碱式碳酸铜的制备
实验二碱式碳酸铜的制备组成分析背景知识碱式碳酸铜英文名Basiccupriccarbonate化学式Cu2OH2CO3物理性质分子…
-
无机化学实验二十一 碱式碳酸铜的制备
实验二十一碱式碳酸铜的制备实验目的通过碱式碳酸铜制备条件的探求和生成物颜色状态的分析研究反应物的合理配料比并确定制备反应适合的温度…
-
实验二十一 碱式碳酸铜的制备
实验二十一碱式碳酸铜的制备20xx04102049实验二十一碱式碳酸铜的制备实验目的通过碱式碳酸铜制备条件的探求和生成物颜色状态的…
-
碱式碳酸铜的制备
实验项目碱式碳酸铜的制备实验目的通过碱式碳酸铜制备条件的探求和生成物颜色状态的分析研究反应物的合理配料比并确定制备反应合适的温度条…
-
碱式碳酸铜的制备
碱式碳酸铜的制备碱式碳酸铜的制备教学目标1通过碱式碳酸铜制备条件的探求和生成物颜色状态的分析2研究反应物的配料比并确定制备反应的温…
-
无机化学实验二十一 碱式碳酸铜的制备
实验二十一碱式碳酸铜的制备实验目的通过碱式碳酸铜制备条件的探求和生成物颜色状态的分析研究反应物的合理配料比并确定制备反应适合的温度…
-
由废铜屑制备甲酸铜及组成测定实验报告
综合设计实验由废铜屑制备甲酸铜及其组成测定实验目的综合设计实验是锻炼学生综合运用所学基础知识和基本技能进行科学研究工作的重要途径通…
-
实验二 碱式碳酸铜的制备
实验二碱式碳酸铜的制备组成分析背景知识碱式碳酸铜英文名Basiccupriccarbonate化学式Cu2OH2CO3物理性质分子…
-
实验二十一 碱式碳酸铜的制备
实验二十一碱式碳酸铜的制备20xx04102049实验二十一碱式碳酸铜的制备实验目的通过碱式碳酸铜制备条件的探求和生成物颜色状态的…
-
碱式碳酸铜的制备
实验项目碱式碳酸铜的制备实验目的通过碱式碳酸铜制备条件的探求和生成物颜色状态的分析研究反应物的合理配料比并确定制备反应合适的温度条…