实验二十一 碱式碳酸铜的制备
实验二十一 碱式碳酸铜的制备
2009-04-10 20:49
实验二十一 碱式碳酸铜的制备
[实验目的]
通过碱式碳酸铜制备条件的探求和生成物颜色、状态的分析,研究反应物的合理配料比并确定制备反应适合的温度条件,以培养独立设计实验的能力。
碱式碳酸铜为天然孔雀石的主要成分,呈暗绿色或淡蓝绿色,加热至200oC即分解,在水中的溶解度度很小,新制备的试样在沸水中很易分解。 思考题:
1. 哪些铜盐适合制取碱式碳酸铜?写出硫酸铜溶液和碳酸钠溶液反应的化学方程式。
2. 估计反应的条件,如反应的温度、反应物浓度及反应物配料比对反应产物是否有影响。
[实验药品]
由学生自行列出所需仪器、药品、材料之清单,经指导老师的同意,即可进行实验。
[实验内容]
一、反应物溶液配制
配制0.5mol·L-1的CuSO4溶液和0.5mol·L-1的Na2CO3溶液各100mL。
二、制备反应条件的探求
1.CuSO4和Na2CO3溶液的合适配比
置于四支试管内均加入2.0 mL 0·5 mol.L-1 CuSO4溶液,再分别取0.5 mol·L-1 Na2CO3溶液1.6 mL、2.0 mL、2.4 mL及2.8 mL依次加入另外四支编号的试管中。将八支试管放在75oC水浴中。几分钟后,依次将CuSO4溶液分别倒入中,振荡试管,比较各试管中沉淀生成的速度、沉淀的数量及颜色,从中得出两种反应物溶液以何种比例混合为最佳。
思考题
1)各试管中沉淀的颜色为何会有差别?估计何种颜色产物的碱式碳酸含量最高?
2)若将Na2CO3溶液倒入CuSO4溶液,其结果是否会有所影响?
2.反应温度的探求
在三支试管中,各加入2.0mL0.5mol·ml-1CuSO4溶液,另取三支试管,各加入由上述实验得到的合适用量的0.5mol·L-1Na2CO3溶液。从这两列试管中各取一支,将它们分别置于室温,50oC,100oC的恒温水浴中,数分钟后将CuSO4溶液倒入Na2CO3溶液中,振荡并观察现象,由实验结果确定制备反应的合适温度。
思考题:
1)反应温度对本实验有何影响?
2)反应在何种温度下进行会出现褐色产物?这种褐色物质是什么?
三、碱式碳酸铜的准备
取60mL0.5moL·L-1CuSO4溶液,根据上面实验确定的反应物合适比例及适宜温度制取碱式碳酸铜。待沉淀完全后,用蒸馏水洗涤沉淀数次,直到沉淀中不含SO42-为止,吸干。
将所得产品在烘箱中于100oC烘干,待冷至室温后称量,并计算产物。
[实验习题]
制备碱式碳酸铜的几种方法
(1)由Na2CO3·10H2O跟CuSO4·5H2O反应制备
根据CuSO4跟Na2CO3反应的化学方程式
2CuSO4+2Na2CO3+H2O==Cu2(OH)2CO3↓+2Na2SO4+CO2↑进行计算,称取14gCuSO4·5H2O,16gNa2CO3·10H2O,用研钵分别研细后再混合研磨,此时即发生反应,有“磁磁”产生气泡的声音,而且混合物吸湿很厉害,很快成为“粘胶状”。将混合物迅速投入200mL沸水中,快速搅拌并撤离热源,有蓝绿色沉淀产生。抽滤,用水洗涤沉淀,至滤液中不含SO42-为止,取出沉淀,风干,得到蓝绿色晶体。该方法制得的晶体,它的主要成分是
Cu2(OH)2CO3,因反应产物与温度、溶液的酸碱性等有关,因而同时可能有蓝色的2CuCO3·Cu(OH)2、2CuCO3·3Cu(OH)2和2CuCO3·5Cu(OH)2等生成,使晶体带有蓝色。
如果把两种反应物分别研细后再混合(不研磨),采用同样的操作方法,也可得到蓝绿色晶体。
(2)由Na2CO3溶液跟CuSO4溶液反应制备
分别称取12.5gCuSO4·5H2O,14.3gNa2CO3·10H2O,各配成200mL溶液(溶液浓度为0.25mol·L-1)。在室温下,把Na2CO3溶液滴加到CuSO4溶液中,并搅拌,用红色石蕊试纸检验溶液至变蓝为止,得到蓝色沉淀。抽滤,用水洗沉淀,至滤液中不含SO42-为止,取出沉淀,风干,得到蓝色晶体。该晶体的主要成分为5CuO·2CO2。如果使沉淀与Na2CO3的饱和溶液接触数日,沉淀将转变为
Cu(OH)2。
如果先加热Na2CO3溶液至沸腾,滴加CuSO4溶液时会立即产生黑色沉淀。如果加热CuSO4溶液至沸腾时滴加Na2CO3溶液,产生蓝绿色沉淀,并一直滴加Na2CO3溶液直至用红色石蕊试纸检验变蓝为止,但条件若控制不好的话,沉淀颜色会逐渐加深,最后变成黑色。如果先不加热溶液,向CuSO4溶液中滴加Na2CO3溶液,并用红色石蕊试纸检验至变蓝为止,然后加热,沉淀颜色也易逐渐加深,最后变成黑色。出现黑色沉淀的原因可能是由于产物分解成CuO的缘故。因此,当加热含有沉淀的溶液时,一定要控制好加热时间。
(3)由NaHCO3跟CuSO4·5H2O反应制备
称取4.2gNaHCO3,6.2gCuSO4·5H2O,将固体混合(不研磨)后,投入100mL沸水中,搅拌,并撤离热源,有草绿色沉淀生成。抽滤、洗涤、风干,得到草绿色晶体。该晶体的主要成分为CuCO3·Cu(OH)2·H2O。
(4)由Cu(NO3)2跟Na2CO3反应制备
将冷的Cu(NO3)2饱和溶液倒入Na2CO3的冰冷溶液(等体积等物质的量浓度)中,即有碱式碳酸铜生成,经抽滤、洗涤、风干后,得到蓝色晶体,其成分为2CuCO3·Cu(OH)2。
由上述几种方法制得的晶体颜色各不相同。这是因为产物的组成与反应物组成、溶液酸碱度、温度等有关,从而使晶体颜色发生变化。从加热分解碱式碳酸铜实验的结果看,由第一种方法制得的晶体分解最完全,产生的气体量最大。
第二篇:实验二 碱式碳酸铜的制备
实验二 碱式碳酸铜的制备,组成分析
背景知识:
碱式碳酸铜
英文名:Basic cupric carbonate
化学式:Cu2 (OH) 2CO3
物理性质:
分子量:221.12
密度:3.85g/cm3
折光率:1.655、1.875、1.909
外观: 草绿色的单斜系结晶纤维状的团状物,或深绿色的粉状物
化学性质:
不溶于冷水和醇,溶于酸,氰化物,氨水和铵盐;受热易分解;
构成: CuCO3?Cu(OH)2,是一种草绿色的单斜系结晶纤维状的团状物,或深绿色的粉状物, 它不溶于水,溶于酸,热水中或加热到220℃时分解为氧化铜、水和二氧化碳( 碱式碳酸铜→加热 氧化铜+水+二氧化碳 ),溶于酸并生成相应的铜盐。也溶于氰化物、铵盐和碱金属碳酸盐水溶液而形成铜的络合物。
用途:
无机工业用于制造各种铜化合物。有机工业用作有机合成催化剂。电镀工业电镀铜锡合金作铜离子的添加剂。农业中用作黑穗病的防止剂,也可作种子的杀虫剂。畜牧业中作饲料中铜的添加剂。此外,还应用于烟火、颜料生产、医药等方面。
实验名称:碱式碳酸铜的制备,组成分析
实验目的:1、通过碱式碳酸铜制备条件的探求和生成物颜色、状态的分析,研究反应物的合理配料比并确定制备反应适合的温度条件;
2、了解碱式碳酸铜组成分析的各种方法;
3、掌握碱式碳酸铜制备及产物组成分析过程中的各种操作,并培养独立设计实验的能力。
实验原理:由Na2CO3?10H2O跟CuSO4?5H2O晶体混合反应后加入沸水中,得到蓝绿色沉淀,经过抽滤、洗涤、风干后可得到蓝绿色晶体。
相关反应方程式:
2CuSO4·5H2O +2Na2CO3·10H2O══Cu2(OH)2CO3+2Na2SO4+14H2O+CO2↑
碱式碳酸铜为天然孔雀石的主要成分,呈暗绿色或淡蓝绿色,加热至200oC即分解,在水中的溶解度度很小,新制备的试样在沸水中很易分解。
思考题:
1. 哪些铜盐适合制取碱式碳酸铜?写出硫酸铜溶液和碳酸钠溶液反应的化学方程式。2CuSO4+2Na2CO3+H2O==Cu2(OH)2CO3↓+2Na2SO4+CO2↑
2. 估计反应的条件,如反应的温度、反应物浓度及反应物配料比对反应产物是否有影响。 实验药品和试剂
CuSO4、Na2CO3 和NaHCO3固体 、 Na2S2O3标准溶液、已知浓度的KI溶液、淀粉液 1.2 实验仪器
恒温水浴箱、电子天平、烘箱、布式漏斗、抽滤瓶、量筒(10mL、100 mL)、胶头滴管、烧杯、试管、玻璃棒、研钵、电炉、滴定管、锥形瓶、铁架台。 [实验步骤] 一、反应物溶液配制
配制0.5mol·L-1的CuSO4溶液和0.5mol·L-1的Na2CO3溶液各100mL。 二、制备反应条件的探求
1.CuSO4和Na2CO3溶液的合适配比
置于四支试管内均加入2.0 mL 0.5 mol.L-1 CuSO4溶液,再分别取0.5 mol·L-1 Na2CO3溶液1.6 mL、2.0 mL、2.4 mL及2.8 mL依次加入另外四支编号的试管中。将八支试管放在75oC水浴中。几分钟后,依次将CuSO4溶液分别倒入Na2CO3溶液中,振荡试管,比较各试管中沉淀生成的速度、沉淀的数量及颜色,从中得出两种反应物溶液以何种比例混合为最佳。
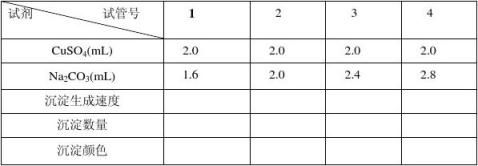
思考题
1)各试管中沉淀的颜色为何会有差别?估计何种颜色产物的碱式碳酸含量最高? 2)若将Na2CO3溶液倒入CuSO4溶液,其结果是否会有所影响? 2.反应温度的探究
在三支试管中,各加入2.0 mL 0.5mol·ml-1 CuSO4溶液,另取三支试管,各加入由上述实验得到的合适用量的0.5mol·L-1 Na2CO3溶液。从这两列试管中各取一支,将它们分别置于室温、50oC、100oC的恒温水浴中,数分钟后将CuSO4溶液倒入Na2CO3溶液中,振荡并观察现象,由实验结果确定制备反应的合适温度。
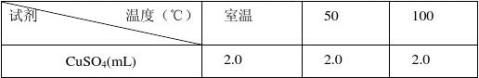
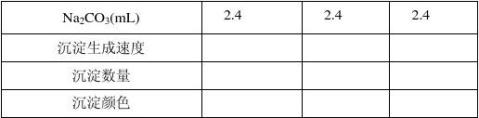
思考题: 1)反应温度对本实验有何影响?
2)反应在何种温度下进行会出现褐色产物?这种褐色物质是什么?
三、用最佳条件制取碱式碳酸铜
取60mL 0.5moL·L-1 CuSO4溶液,根据上面实验确定的反应物合适比例及适宜温度制取碱式碳酸铜。待沉淀完全后,快速撤离热源,静置,待沉淀下沉后用倾滗法洗涤沉淀数次,直到沉淀中不含SO42-为止(Ba离子检验),抽干。 2+
将所得产品在烘箱中于100oC烘干,待冷至室温后称量,并计算产率。
制备方法二:利用NaHCO3固体跟CuSO4固体制备
称取4.2gNaHCO3,6.2gCuSO4·5H2O,先将固体研细,然后混合,投入100mL沸水中,搅拌,防止暴沸,反应完全后撤离热源,看到有草绿色沉淀生成。洗涤至不含硫酸根离子,抽滤至干,得到草绿色晶体.该晶体的主要成分为CuCO3·Cu(OH)2·H2O.
注意:因反应产物与温度、溶液的酸碱性等有关,因而同时可能有蓝色的2CuCO3·Cu(OH)2、2CuCO3·3Cu(OH)2和2CuCO3·5Cu(OH)2等生成,使晶体带有蓝色。
四、碱式碳酸铜的质量鉴定
在实验中通常采用EDTA滴定法或碘量法对碱式碳酸铜进行质量鉴定,在这里我们主要讨论碘量法的具体操作过程。I-是中等强度的还原剂,可以用来测定的氧化态物质Cu2+的浓度,通过Cu2+的浓度可知样品中Cu的含量,进而得知样品的纯度,反应的方程式为: Cu2+ + 2I-=Cu+I2 I2 + 2 S2O32-= 2 I- + S4O62- 。
附:间接碘量法的反应条件和滴定条件:
①酸度的影响—— I2 与Na2S2O3应在中性、弱酸性溶液中进行反应。 (若在碱性溶液中:S2O32-+ 4I2 + 10 OH-= 2SO42-+ 8I- + 5H2O 、 3I2 + 6OH-=IO3-+ 5I- + 3H2O 若在酸性溶液中:S2O32-+ 2H+= 2SO2 + Sˉ+ H2O 、4I- + O2 (空气中) + 4H+= 2I2 + H2O )
②防止 I2 挥发:加入过量KI(比理论值大2~3倍)与 I2 生成I3-,减少 I2挥发; 室温下进行; 滴定时不要剧烈摇动。
③防止I- 被氧化: 避免光照——日光有催化作用; 析出 I2后不要放置过久(一般暗处5 ~ 7min ); 滴定速度适当快。
具体操作过程如下:
在室温条件下,称取0.5g碱式碳酸铜样品,溶于20mL纯水,然后转移到锥形瓶中,然后加入2滴淀粉液作为待测液,用已知浓度的KI溶液滴定该反应直至反应终点(应该是加入过量的已知浓度的KI溶液,盖盖子,在暗处反应5-7 min),然后(立即)用 Na2S2O3标准溶液滴定析出的碘。通过硫代硫酸根离子的浓度与铜离子浓度之间的关系,可以间接求出Cu的含量,进而算出纯的碱式碳酸铜的理论值,与实际值比较,可以判断出碱式碳酸铜的质量。
-
无机化学实验二十一 碱式碳酸铜的制备
实验二十一碱式碳酸铜的制备实验目的通过碱式碳酸铜制备条件的探求和生成物颜色状态的分析研究反应物的合理配料比并确定制备反应适合的温度…
-
实验二十一 碱式碳酸铜的制备
实验二十一碱式碳酸铜的制备20xx04102049实验二十一碱式碳酸铜的制备实验目的通过碱式碳酸铜制备条件的探求和生成物颜色状态的…
-
碱式碳酸铜的制备
实验项目碱式碳酸铜的制备实验目的通过碱式碳酸铜制备条件的探求和生成物颜色状态的分析研究反应物的合理配料比并确定制备反应合适的温度条…
-
碱式碳酸铜的制备
碱式碳酸铜的制备碱式碳酸铜的制备教学目标1通过碱式碳酸铜制备条件的探求和生成物颜色状态的分析2研究反应物的配料比并确定制备反应的温…
-
碱式碳酸铜的制备
碱式碳酸铜的制备摘要探究大学无机化学实验中有关碱式碳酸铜制备的实验方法碱式碳酸铜制备实验的最佳反应条件讨论反应的最佳配比以及生成物…
-
无机化学实验二十一 碱式碳酸铜的制备
实验二十一碱式碳酸铜的制备实验目的通过碱式碳酸铜制备条件的探求和生成物颜色状态的分析研究反应物的合理配料比并确定制备反应适合的温度…
-
由废铜屑制备甲酸铜及组成测定实验报告
综合设计实验由废铜屑制备甲酸铜及其组成测定实验目的综合设计实验是锻炼学生综合运用所学基础知识和基本技能进行科学研究工作的重要途径通…
-
实验二 碱式碳酸铜的制备
实验二碱式碳酸铜的制备组成分析背景知识碱式碳酸铜英文名Basiccupriccarbonate化学式Cu2OH2CO3物理性质分子…
-
碱式碳酸铜的制备
实验项目碱式碳酸铜的制备实验目的通过碱式碳酸铜制备条件的探求和生成物颜色状态的分析研究反应物的合理配料比并确定制备反应合适的温度条…
-
碱式碳酸铜的制备
碱式碳酸铜的制备碱式碳酸铜的制备教学目标1通过碱式碳酸铜制备条件的探求和生成物颜色状态的分析2研究反应物的配料比并确定制备反应的温…
-
Revise实验16:碱式碳酸铜的制备---设计实验
碱式碳酸铜的制备设计实验2人一组一实验目的与要求1通过碱式碳酸铜制备条件的探求和生成物颜色状态的分析研究反应物的合理配料比并确定制…