糖化酶固定化实验报告
糖化酶固定化实验报告
学 号: 080500130
姓 名: 黄兆峰
专 业: 微生物工程
其他组员:黄志成、李盟、苏温培
指导老师: 朱秋享
实验时间: 2008.11.5—2008.11.7
一、目的要求
本实验为酶工程综合实验,由学生自行设计实验方案,培养学生独立实验的能力;并掌握酶活测定方法,米氏常数测定,学习固定化酶的常用方法及固定化酶的表征。
二、基本原理
游离酶可通过各种固定化方法,增加其稳定性并且有利于连续化生产和重复使用。酶固定化后可用各种理化性质的变化来表征其效果。
酶活测定原理:糖化酶(即淀粉α-1,4-葡萄糖苷酶)有催化淀粉水解的作用,从淀粉分子非还原性末端开始,分解α-1,4-葡萄糖苷键生成葡萄糖,反应生成的葡萄糖用次碘酸钾法定量测定,以表示糖化性淀粉酶的活力。
本次固定化酶使用的方法是包埋法,将酶、细胞或原生质体包埋在各种多孔载体中,使其固定化的方法成为包埋法。包埋法制备固定化酶、固定化细胞或固定化原生质体时,根据载体材料和方法的不同,可分为凝胶包埋法和半透膜包埋法两大类。以各种多孔凝胶为载体,将酶、细胞或原生质体包埋在凝胶的微孔内的固定化方法为凝胶包埋法。本次实验中具体使用的方法为海藻酸钙凝胶包埋法。
三、实验仪器及材料
1、实验用乳化机WL500CY、注射用筒50mL6号针头、冰箱、其他实验常用玻璃仪器
2、糖化酶、海藻酸钠、明胶
四、试剂配方
1、2%可溶性淀粉
称取可溶性淀粉碎2g(预先100℃烘干约2h至恒重),用少量蒸馏水调匀,徐徐倾入已沸的蒸馏水中,煮沸至透明,冷却定容至100ml,此溶液需当天配制。
2、1mol/LpH4.5醋酸钠缓冲液
取无水醋酸钠8.024g,先在少量水中溶解,定容至1000ml。取分析纯冰醋酸5.78ml定容至1000ml。以上两种溶液按醋酸和醋酸钠的体积比为25:22混合即为所要求的缓冲液。
3、0.05 mol/L碘液:
称取25克碘化钾溶于少量水中,加入12.7克碘,溶解后定容至1000毫升贮存于棕色瓶中。
4、0.1 mol/L氢氧化钠溶液:
称取分析纯氢氧化钠4克溶解并定容至1000毫升。
5、1 mol/L硫酸 :
吸取分析纯浓硫酸(比重1.84)55.5毫升,缓缓如入944.5毫升水定容至1000毫升。
6、0.1 mol/L硫代硫酸钠:
称取26克硫代硫酸钠和0.4克碳酸钠,用煮沸冷却的蒸馏水溶解并定容至1000毫升,配制后放置三天再标定。
五、实验步骤
1、酶活测定
⑴ 操作步骤
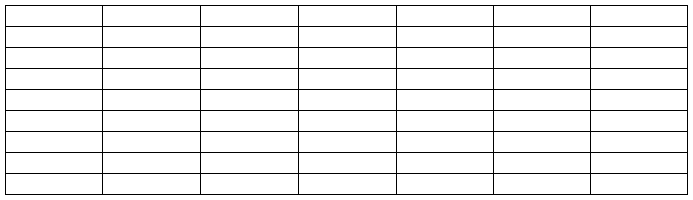
取2%可溶性淀粉溶液25毫升加pH4.5醋酸缓冲液5毫升混匀于比色管,在40℃恒温水浴中预热5-10分钟加入待测酶液2毫升(空白以蒸馏水代替酶液)准确计时1小时。取出加入4滴20%NaOH终止酶反应,冷却至室温。取上述反应液5毫升于定容瓶中,先加入0.05mol/L碘液10毫升,再加0.1 mol/LNaOH 10毫升,摇匀暗处静置15分钟。加入 2N硫酸 2毫升。用 0.1mol/L硫代硫酸钠滴定至无色。其与空白消耗硫代硫酸钠毫升数的差值应在4~6之间,否则要适当调整酶液的稀释倍数。
⑵ 计算
酶活(mg/ml)=(A-B)*N*90.05*V1/V2/V3 *2
A—空白所消耗的Na2S2O3的毫升数;
B—样品所消耗的Na2S2O3的毫升数;
90.05—1毫升1N的Na2S2O3相当的葡萄糖毫克数;
V1—反应液总体积(32.20毫升);
V2—吸取反应液样品体积(5毫升);
V3-吸取酶液毫升数(2毫升);
2—反应30min,换算成1h的酶活力系数所得的结果表示至整数;
N—Na2S2O3的当量浓度(0.1mol/L)。
2、米氏常数的测定
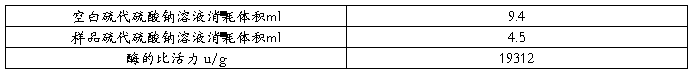
取1ml游离酶,分别以0.20%,0.30%,0.40%,0.50%,1.00%,2.00%浓度的可溶性溶液为底物,在40℃下反应10min,采用以上的方法测定游离酶活,做Line weaver-Burk双倒数曲线图,即以1/[S]为横作标,以1/v(反应初速度)为纵坐标。其斜率即为米氏常数。
3、糖化酶的固定化
将酶液15ml游离酶与3%的海藻酸钠150ml混合,然后加入3%的明胶溶液150ml混合乳化约10min,调pH为4,慢速搅拌并降温至5~10℃,通过6号注射针头将上述冷却液以5cm的高度注进1%氯化钙溶液中,立刻形成光滑的微球,然后保持温度为4℃,球在氯化钙溶液中被硬化30min,固定化酶被贮存在0~5℃冰箱。
4、固定化酶的酶活测定
⑴ 操作步骤
取2%可溶性淀粉溶液25毫升加pH4.5醋酸缓冲液5毫升混匀于比色管,在40℃恒温水浴中预热5-10分钟加入固定化酶5g(空白以蒸馏水代替固定化酶)准确计时1小时。取出过滤终止酶反应,冷却至室温。取上述反应液5毫升于定容瓶中,先加入0.05mol/L碘液10毫升,再加0.1 mol/LNaOH 10毫升,摇匀暗处静置15分钟。加入 2N硫酸 2毫升。用 0.1mol/L硫代硫酸钠滴定至无色。
⑵ 计算
酶活(mg/ml)=(A-B)*N*90.05*V1/V2
A—空白所消耗的Na2S2O3的毫升数;
B—样品所消耗的Na2S2O3的毫升数;
90.05—1毫升1N的Na2S2O3相当的葡萄糖毫克数;
V1—反应液总体积(32.20毫升);
V2—吸取反应液样品体积(5毫升);
N—Na2S2O3的当量浓度(0.1mol/L)。
5、固定化酶活力回收测定
固定化酶活力回收=固定化酶总活力/溶液酶总活力X100%
6、固定化酶半衰期测定
六、实验数据与数据处理
1、
表1 糖化酶酶活测定
2、
表2 糖化酶米氏常数测定HHHH
以1/[S]为横作标,以1/v(反应初速度)为纵坐标,做Line weaver-Burk双倒数曲线图,其斜率即为米氏常数。Km=0.0004/0.0015=0.267
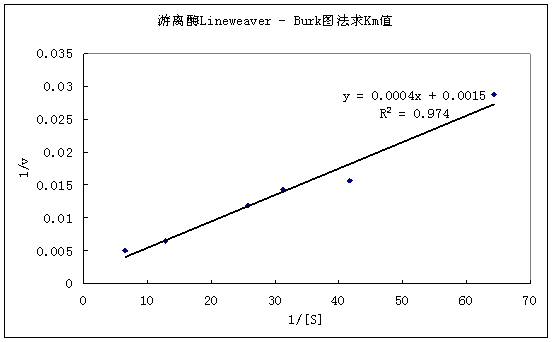
图1 Line weaver-Burk双倒数曲线图
3、
表3 固定化酶酶活测定

4、固定化酶回收率的计算:
100ml胶酶溶液相当的酶活力u=总的固定化酶质量×固定化酶比活力
=45.6×7.85 =357.96(u)
315ml胶酶溶液相当于15ml酶溶液活力u=
=357.96/100×315=1127.57u
15ml酶溶液的总活力u=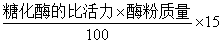
=19312/100*15=2896.8u
固定化酶的回收率ω%=
=1127.57/2896.8×100%=38.9%
5、固定化酶半衰期的测定
表4 固定化酶的半衰期测定表格

由下图得:t1/2=ln2/0.0068=110h(4天零14小时)
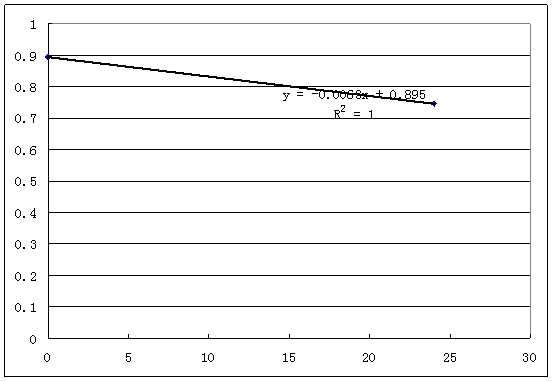
图2 固定化酶半衰期的测定
七.结果与讨论:
本实验采用包埋法对糖化酶进行固定化并对其Km,半衰期t2/1重要参数进行测定,随着人们对天然高分子载体的不断挖掘和探究,对其进行改性,或利用超临界技术、纳米技术、膜技术等来固定化酶,同时,开发新型、高效固定化酶反应器,进一步提高转化和生产能力是固定化酶技术发展的趋势。
以上实验得出实验数据如下:

误差分析:
(1)实验中要求采用的硫代硫酸钠溶液需放置三天才能使用,而我们没有做到这一点,这使结果发生偏差。
(2)由于在测固定化酶的活力过程中,固定化酶微球会浮在反应液表面,要使它们能与反应液均匀接触,要在反应过程中不断搅拌反应液,我们是隔一段时间去搅拌一次,而不是使它一直保持搅拌状态,所以测的结果有偏差。
(3)我们测定酶活的方法是采用滴定硫代硫酸钠法,由于我们操作的不够熟练,在滴定的过程中会多滴一两滴,这使我们的一些数据会偏大。
(4)测固定化酶活与固定化酶的回收率,没有在同一天做,固定化酶放置了一天,这使固定化酶的回收率测定出现偏差。
第二篇:糖化酶活力测定实验报告
华南农业大学
综合实验报告
实验项目名称:糖化酶活力测定
实验项目性质:综合实验
计划学时:2学时
所属课程名称:食品与发酵工业分析
班 级: 10级生物工程1班
姓 名:肖佩
学 号:201030620124
指导 老师:沈玉栋徐振林
一.实验原理
采用可溶性淀粉为底物,在一定的pH值与温度下,使之水解为葡萄糖 (还原糖),以直接滴定法测定。
二.试剂及仪器
(1) 碱性酒石酸铜甲溶液(使用时等体积混合甲、乙溶液): 甲液:称取15.693g硫酸铜(Cu2SO4·5H2O),0.05g次甲基蓝,用水溶解并稀释定容至1000mL; 乙液:称取50g酒石酸钠钾,54g氢氧化钠,4g亚铁氰化钾,用水溶解并稀释定容至1000mL
(2) 0.1%标准葡萄糖溶液:准确称取1g无水葡萄糖(预先在100-1050C烘干),用水溶解,加5mL浓盐酸,用水定容至1000mL。
(3) pH4.6乙酸-乙酸钠缓冲溶液:
0.2mol/L乙酸溶液:量取11.8mL冰乙酸,用水稀释至1000mL;
0.2mol/L 乙酸钠溶液:称取27.2g乙酸钠(CH3COONa·3H2O),用水定容至1000mL;
pH4.6乙酸-乙酸钠缓冲液:取0.2mol/L的乙酸溶液和0.2mol/L的乙酸钠溶液等体积混合。
(4) 0.1mol/L氢氧化钠溶液:称取4g氢氧化钠,用水溶解并定容至1000mL。
(5) 2%可溶性淀粉溶液:准确称取2g可溶性淀粉(预先于10-105 0C烘干),加少量水调匀,倾入80mL沸水中,继续煮沸至透明,冷却后用水定容至100mL。
(6) 固体曲
(7) 滴定管、电子天平、烧杯、恒温水浴锅、脱脂棉、容量瓶、移液管、三角瓶
三.测定步骤
(1) 5%固体曲浸出液制备:称取5.0g固体曲(以绝干曲计),置于250mL烧杯中,加90mL水和10mL pH4.6乙酸-乙酸钠缓冲溶液,搅匀,于30℃水浴中保温浸1小时,每隔15min搅拌一次。用脱脂棉过滤,滤液为5%固体曲浸出液。
(2)固体曲糖化液的制备:吸取25mL 2%可溶性淀粉溶液,置于50mL容量瓶中,于30℃水浴预热10min。准确加入5mL 5%固体曲浸出液,摇匀,立即记下时间。于30℃水浴准确保温糖化1小时。迅速加入15mL 0.1mol/L氢氧化钠溶液,终止酶解反应。冷却至室温,用水定容至刻度。
同时作一空白液:吸取25mL 2%可溶性淀粉溶液,置于50mL容量瓶中,先加入15mL 0.1mol/L氢氧化钠溶液,然后准确加入5mL 5%固体曲浸出液,用水定容至刻度。
(3)定糖
空白液测定:吸取碱性酒石酸铜甲、乙液各5mL,置于100-150mL三角瓶中,准确加入5mL空白液,并用滴定管预先加入适量的0.1%标准葡萄糖溶液,使滴定时消耗的0.1%标准葡萄糖溶液在1mL以内,摇匀。于电炉上加热至沸腾,立即用0.1%标准葡萄糖溶液滴定至蓝色消失,此滴定操作需在1min内完成。
糖化液测定:准确吸取5mL糖化液代替5mL空白液,其余操作同上。
四.计算
固体曲糖化酶活力定义:1g绝干固体曲,在30℃、pH4.6、1小时内水解可溶性淀粉为葡萄糖的毫克数。
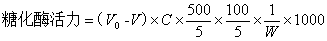
式中:V0——5mL空白液消耗0.1%标准葡萄糖溶液的体积(mL)
V——5mL糖化液消耗0.1%标准葡萄糖溶液的体积(mL)
C——标准葡萄糖溶液浓度(g/mL)
50/0.5——0.5mL糖化液换算成50mL糖化液中的糖量(g)
100/5——5mL浸出液换算成100mL浸出液中的糖量(g)
W——绝干曲称取量(5.0g)
1000——g换算成mg
五.数据处理与分析
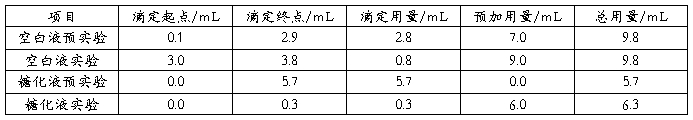
4.1.1数据处理
表1 糖化酶活力测定实验滴定所用滴定液体积
六.数据处理
空白液:Vo=9.80mL
样品液:V=6.30mL。
代入公式可得,糖化酶活力=1400mg
七.结果讨论
实验结果表明试样糖化酶活力为1400mg,根据查找的资料可知本实验所测酶活力偏低。原因如下:
1.实验人员的在吸取、滴定等操作存在误差,导致实验结果有所偏差。
2.制备5%固体曲浸出液时,糖化酶没有完全浸出,造成分解淀粉量减少,滴定所用标准葡萄糖溶液增多,计算所得酶活力减少。
3.进行滴定时,在糖化液滴定过程中,起初由于糖化液浓度较大,滴定时间过短无法统计,后作10倍稀释测定,可能影响实验结果的测定。
-
生化实验报告:Folin-Wu法定量测定血糖的含量
实验FolinWu法定量测定血糖的含量一实验原理Cu2CuSO4葡萄糖CuCu2OCu2O酸性钼酸试剂蓝色钼化合物OD420比色无…
-
血糖仪与实验室检测血糖比对分析报告
血糖仪与实验室检测血糖比对分析报告血糖仪与实验室检测血糖比对分析报告根据卫生部办公厅关于印发医疗机构便携式血糖检测仪管理和临床操作…
- 实验三血糖的测定
-
实验八血糖的测定
实验血糖的测定葡萄糖氧化酶法目的1了解葡萄糖氧化酶法测定血糖的原理能进行血糖测定的操作2掌握血糖测定的临床意义原理葡萄糖氧化酶GO…
-
血糖仪与实验室检测血糖比对分析报告1
血糖仪与实验室检测血糖比对分析报告根据卫生部办公厅关于印发医疗机构便携式血糖检测仪管理和临床操作规范试行的通知按医务科的要求和部署…
-
保险内勤20xx年工作总结
进入12月份,20xx年即将结束,新的一年将要来到。人们总是习惯在年末总结自己一年的成果,保险行业也不例外。面对日益加重的竞争压力…
-
个人实习总结(美术系)
阶段性工作总结美术系都说教师是天底下最光辉的职业,是辛勤的园丁,当我还是一名在校的学生时没能真正的理解这句话的真正含义。自从来到十…
-
八字哨镇卫生院计划生育工作总结
今年以来,我们按照上级计生部门的要求,制定并认真落实《开展计划生育优质服务工作的实施方案》,在医院院委的组织领导下,积极参加有关计…
-
我的全员培训学习总结
高邑县教育局教研室耿换霞今年暑假我参加了20xx年河北省中小学幼儿园全员培训,本次培训集中学习时间共是19周,教学进度安排表中为省…
-
美术专业实习总结
初中美术实习报告实习是我们师范生即将踏上漫漫人生征途的标志,是人生的另一个起点,对我们的生涯规划有着重要的意义。但这次顶岗实习对我…