大学化学实验——盐酸浓度的标定
盐酸浓度的标定
一 实验目的
1. 了解基准物质无水碳酸钠(Na2CO3)的性质及其应用
2. 掌握HCl标准溶液的配置及标定,进一步熟练滴定分析基本操作
二 实验原理
反应 2HCl+ Na2CO3 = 2NaCl+CO2+H2O
混合指示剂:一种是由两种或两种以上的指示剂混合而成;另一种是由某种指示剂和一种惰性染料组成. 利用颜色之间的互补作用,使变色更加敏锐. 甲基橙
三 主要仪器和试剂
酸式滴定管 锥形瓶 移液管 分析天平
Na2CO固体(基准)3 HCl 溴甲酚绿-二甲基黄混合指示剂
四 实验步骤
1.0.1mol·L-1盐酸溶液的配置
2. 盐酸溶液浓度的标定
(1)差减法称取0.13-0.15g无水Na2CO3三粉,称准至0.0001g
(2)加水50mL.搅拌,使Na2CO3完全溶解.
(3)加入9滴溴甲酚绿-二甲基黄混合指示剂 绿色变亮黄
(滴定管的准备)
五 实验记录
盐酸标准溶液的标定
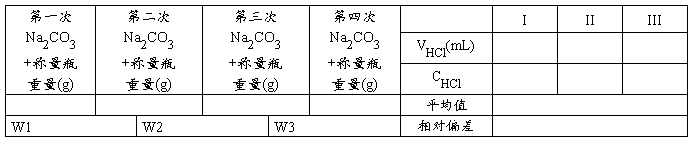
由碳酸钠的重量及实际消耗的盐酸的体积计算溶液的物质的量浓度
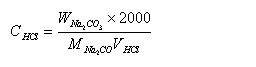
式中W Na2CO3—碳酸钠的质量(g),M Na2CO3—碳酸钠的物质的量(106.0 g/mol),V HCl —盐酸溶液的体积(ml)。
六 思考题
1.氢氧化钠和盐酸能否作为工作基准试剂?能否直接在容量瓶中配置0.1000 mol·L-1的氢氧化钠溶液?
不能
2. 以碳酸钠标定盐酸浓度时为什么用甲基橙作指示剂(溴甲酚绿-二甲基黄混合指示剂)?能否用酚酞作指示剂?
酚酞变色点8.0-9.6, HCl首先和CO32-生成HCO3- 达到第一化学计量点 第一次突跃pH值为8.31 第二化学计量点产物H2CO3 pH 3.9
3 草酸钠能否用来标定盐酸溶液?
不能 标定高锰酸钾
4.标定盐酸浓度时称量无水碳酸钠要不要十分准确,溶解时加水量要不要十分准确,为什么?
看计算公式
第二篇:大学化学实验 盐酸配制和标定
实验二 0.1 mol/L 盐酸溶液的配制和标定
1.主要试剂及器皿:
浓HCl 甲基橙 : 0.2%水溶液 Na2CO3 固体(基准) 烧杯…
2.实验步骤
1. 0.1 mol/L 盐酸溶液浓度的配制
在通风橱中量取浓盐酸3.2ml左右,倒入事先盛放一定量水的烧杯中,加水稀释到400ml.
2 0.1 mol/L 盐酸溶液浓度的标定的标定
用差减法准确称取无水碳酸钠三份,每份约为0.15~0.2 克,分别放在250ml锥形瓶内,加水30毫升溶解,小心搅拌均匀, 加甲基橙指示剂1~2滴,然后用盐酸溶液滴定至溶液由黄色变为橙色,即为终点,由碳酸钠的重量及实际消耗的盐酸的体积计算溶液的物质的量浓度

式中W Na2CO3—碳酸钠的质量(g),M Na2CO3—碳酸钠的物质的量(106.0 g/mol),V HCl —盐酸溶液的体积(ml)。
以上述同样方法滴定第二份碳酸钠。二次结果的相对偏差不超过0.2%。
3.、实验报告
盐酸标准溶液的标定

4.、讨论:Na2CO3 基准在称量时应注意什么?P88
-
化学实验报告——盐酸溶液的标定
化学实验报告无机及分析化学题目盐酸溶液的标定学院班级姓名学号指导老师年月日制时间盐酸浓度的标定一实验目的1练习酸碱标准溶液的标定方…
-
实验报告式样标定盐酸电子(2)
YANGZHOUUNIVERSITYCHEMICALEXPERMENTPAPER实验名称23HCl标准溶液的配制和标定时间地点班级…
-
盐酸和氢氧化钠标准溶液浓度的标定实验报告
盐酸和氢氧化钠标准溶液浓度的标定实验报告一实验目的1掌握NaOH标准溶液的标定方法2了解基准物质邻苯二甲酸氢钾的性质及应用3进一步…
- 化学实验报告——盐酸溶液的标定
-
盐酸标定实验记录表
盐酸溶液的标定实验数据记录计算表完成近似浓度01molL盐酸溶液的标定记录实验中相关数据并计算盐酸溶液的标准浓度要求写出计算过程计…
-
医院后勤人员个人总结
医院后勤个人总结我在温州市某医院工作的两年时间里,主要从事金工、电工、院内房屋管理及修缮管理方面的工作,在平日的工作生活中,我能做…
-
20xx年能源计量工作总结
能源计量工作总结20xx年以来,为了提高能源计量工作水平,根据《计量法》、《节约能源法》和市局文件通知要求,我局以节能减排为核心,…
-
药学部工作总结
20xx年已经过去了。在过去的一年里,在院长和主管院长的正确领导下,以临床药师制和创建“三级甲等医院”为主要工作目标,以三甲医院评…
-
20xx年康乐小学校本教研工作总结
团溪镇康乐小学20xx—20xx学年第一学期校本教研工作总结本学期在上级领导的正确领导下,在全体教师的共同努力下。圆满地完成了本学…
-
浏阳市职业中专20xx年消防安全教育总结
消防安全工作是学校创建“平安校园”的重要内容之一,关系到国家财产安全和师生生命安全。对此,我校自始至终保持着清醒的认识。近年来,我…