对甲苯磺酸的制备
对甲苯磺酸的设计实验指导书
一、 实验目的:学习芳香族的磺化反应制备芳磺酸;巩固分水器的使用、回流以及重结晶操作
二、 反应原理:
主反应:

副反应:

三、 原料与产物的物理常数

四、 装置图
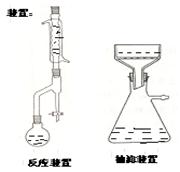
五、 实验步骤
回流反应:50mL圆底烧瓶内放入25 mL甲苯,一边摇动烧瓶,一边缓慢地加入5.5 mL浓硫酸,投入几粒沸石在石棉网上用小火加热回流2h或至分水器中积存2 mL水为止 。
六、 注意事项
1)滴加浓硫酸时一定要在振摇下用滴管慢慢加入。
2)控制加热强度。
3)析晶时要慢慢搅拌 。
七、问题:
1)利用什么性质除去对甲苯磺酸中的邻位衍生物?
2)在本实验条件下,会不会生成相当量的甲苯二磺酸?为什么?
八、设计要求:
1 从实验原理出发设计原料配比。
2 从实验反应条件出发设计实验装置
3 从原料的物理常数等条件设计实验步骤和反应温度、催化剂、溶剂、反应终点的确定。
4 设计出产物的纯化方法和纯度测定方法
5 设计出产物的结构测定方法,写出红外光谱分析此化合物的意义
6 完成一份设计实验报告后经教师认可才能完成实验。
第二篇:对甲苯磺酸钠的制备
对甲苯磺酸钠的制备
一、思考题
1. 在对甲苯磺酸钠的制备实验中,中和酸时,为什么用NaHCO3而不用Na2CO3? 答:因为用NaHCO3中和生成具有酸性的NaHSO4,其水溶性较大;而用Na2CO3中和,易将硫酸完全中和,生成中性的Na2SO4,且水溶性较小,从而易使产品中夹杂有硫酸钠,影响产品质量。
2. 在对甲苯磺酸钠的制备实验中,NaCl起什么作用?用量过多或过少,对实验结果有什么影响?
答:NaCl的作用是: (1)第一次是使对甲苯磺酸转化成钠盐。 (2)第二次是起盐析作用,使对甲苯磺酸钠晶体析出。NaCl 用量过多,产品中将混有NaCl杂质,降低产品纯度。NaCl用量少,不能使对甲苯磺酸钠结晶完全析出,降低产率。
3. 用浓硫酸作磺化剂制备对甲苯磺酸钠的优缺点是什么?
答:用浓硫酸作磺化剂的优点是:(1) 原料易得,价格便宜。(2)可以避免使用氯磺酸、发烟硫酸等磺化剂带来的麻烦,减少环境污染。(3)操作简单,反应温度适宜。 用浓硫酸作磺化剂的缺点是:(1) 与氯磺酸、发烟硫酸等磺化剂比较,浓硫酸的磺化能力相对较弱,因此反应速度较慢,反应温度相对较高,产率较低。 (2)因使用过量的浓硫酸,使对甲苯磺酸钠的分离相对困难些。
4. 在对甲苯磺酸钠的合成中搅拌的目的是什么?
答:因为甲苯与浓硫酸互不相溶,通过搅拌可使两者充分接触,达到缩短反应时间,减少碳化,提高产率的目的。
5. 在对甲苯磺酸钠的合成中,怎样才能保证产品是对甲苯磺酸钠?
答:(1)严格控制反应温度在100-120℃,因为在此温度下主要得到邻位产物。温度过高,将得到苯二磺酸和二甲苯砜等副产物。(2)反应中一定要保持微沸状态,使上升蒸气环不超过球形冷凝管的1/3。
6. 在对甲苯磺酸钠的合成中,在安全方面应注意什么?如不小心发生甲苯起火或浓硫酸溅到皮肤上应怎样处理?
答:再安全方面应注意:防止发生火灾和被浓硫酸灼伤。如不慎发生起火,应立即切断电源,移开周围其它易燃物品,迅速用石棉布覆盖火源,使甲苯与空气隔绝而灭火。 如不慎将浓硫酸溅到皮肤上,应立即用大量水冲洗,再用3~5%碳酸氢钠溶液洗涤,最后再用大量水冲洗。严重时应消毒、拭干后涂上药用凡士林或烫伤油膏,将伤口包扎好后送医院治疗。
7. 在对甲苯磺酸钠的制备实验中,NaCl起什么作用?用量过多或过少,对实验结果有什么影响?
答:NaCl的作用是: (1)第一次是使对甲苯磺酸转化成钠盐。 (2)第二次是起盐析作用,使对甲苯磺酸钠晶体析出。NaCl 用量过多,产品中将混有NaCl杂质,降低产品纯度。NaCl用量过少,不能使对甲苯磺酸钠结晶完全析出,降低产率。
二、制备装置
画出对甲苯磺酸合成的反应装置图。答:(插图)
-
对硝基苯甲酸的还原实验设计报告2
实验设计报告一实验目的1通过对硝基苯甲酸的还原了解有机合成的基本过程2掌握还原反应的原理及基本操作3由对硝基苯甲酸制备对氨基苯甲酸…
-
有机实验设计—对甲苯磺酸的制备
实验对甲苯磺酸的制备前言对甲苯磺酸是贾沃思基Jaworsky于1865年用硫酸磺化甲苯首先制得1869年恩格尔哈特Engellia…
-
对甲苯磺酸钠的制备
对甲苯磺酸钠的制备一思考题1在对甲苯磺酸钠的制备实验中中和酸时为什么用NaHCO3而不用Na2CO3答因为用NaHCO3中和生成具…
-
有机设计实验报告富马酸二甲酯的制备
富马酸二甲酯的制备华南师范大学化学与环境学院摘要顺丁烯二酸酐马来酸酐与甲醇在混合催化剂的作用下一步合成了富马酸二甲酯本文从催化剂种…