化学实验报告 实验__缓冲溶液的配制及pH测定
实 验 报 告
姓名: 班级: 同组人: 自评成绩:
项目: 缓冲溶液的配制及pH测定 课程: 学号:
一、实验目的
1. 学会标准缓冲溶液的配制方法,并验证其性质。
2. 掌握酸度计测定溶液pH的方法。
二、实验原理
1.缓冲原理
缓冲溶液具有抵抗外来少量酸、碱或稀释的干扰,而保持其本身pH基本不变的能力。缓冲溶液由共轭酸碱对组成,其中共轭酸是抗碱成分,共轭碱是抗酸成分,缓冲溶液的pH可通过亨德森-哈塞尔巴赫方程计算。 pH = pKa + lg
pH = pKa + lg 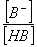
在配制缓冲溶液时,若使用相同浓度的共轭酸和共轭碱,则它们的缓冲比等于体积比。 pH = pKa + lg 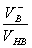
配制一定pH的缓冲溶液的原则:选择合适的缓冲系,使缓冲系共轭酸的pKa尽可能与所配缓冲溶液的pH相等或接近,以保证缓冲系在总浓度一定时,具有较大的缓冲能力;配制缓冲溶液要有适当的总浓度,一般情况下,缓冲溶液的总浓度宜选在0.05~0.2mo1/L之间;按上面简化公式计算出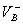 和
和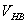 的体积并进行配制。
的体积并进行配制。
三、仪器和药品
仪器: 精密pH试纸,pHs-3C型酸度计,玻璃电极或pH复合电极,塑料烧杯,温度计。
试剂:0.10mol/L的HAc、NaAc、NaOH、HCl溶液,0.20mol/L的Na2HPO4、KH2PO4溶液,1%HCl溶液,1%NaOH溶液待测pH溶液,饱和氯化钾溶液。
pH=4.01的标准缓冲溶液:称取在110℃烘干的分析纯邻苯二甲酸氢钾10.21g,溶于蒸馏水中,再定容至1000mL。
pH=6.86的标准缓冲溶液:称取在110℃烘干的分析纯磷酸二氢钾3.39g和磷酸二氢钠3.53g,溶于蒸馏水中,再定容至1000mL。
pH=9.18的标准缓冲溶液:称取分析纯硼砂3.81g,用蒸馏水溶解后定容至1000mL。四、内容及步骤
1. 缓冲溶液的配制
(1)计算配制100mL pH=5.00的缓冲溶液需要0.1mol/L HAc溶液和0.1moI/L NaAc溶液体积(已知HAc的pKa=4.75)。根据计算出的用量,用吸量管吸取两种溶液置于100mL烧杯中,混匀,用酸度计测定其pH。若pH不等于5.00,可用几滴0.01moI/LNaOH或0.lmol/L NaAc溶液调节使溶液的pH为5.00后,备用待测。
(2)计算配制pH=8.00的缓冲溶液100mL需要的0.2mol/L Na2HPO4和0.2mol/L KH2PO4溶液的体积(H3PO4的pKa2=7.21)。根据计算用量,用碱式滴定管放取Na2HPO4溶液,用吸量管吸取KH2PO4溶液置于100mL烧杯中,混匀,用酸度计测定其pH。若pH不等于8.00,用几滴0.01mol/L NaOH或2mol/L KH2PO4溶液调节至8.00后,备用待测。
2. 缓冲溶液的性质
(1)缓冲溶液的抗酸作用:取三支试管,分别加入3mL上述配制的pH为5.00、8.00的缓冲溶液和蒸馏水,各加入2滴0.10mol/L HCl溶液,用酸度计或精密pH试纸测定其pH,并解释实验现象。
(2)缓冲溶液的抗碱作用:取三支试管,分别加入3mL上述配制的pH为5.00、8.00的缓冲溶液和蒸馏水,各加入2滴0.10mol/L NaOH溶液,用酸度计或精密pH试纸测定其pH,并解释实验现象。
(3)缓冲溶液的抗稀释作用:取四支试管,分别加入0.5mL上述配制的pH为5.00、8.00的缓冲溶液、0.10mol/L的NaOH、HCl溶液,各加入5mL蒸馏水,振荡试管,用酸度计或精密pH试纸测定其pH,并解释实验现象。
五、实验结果记录与计算
1.缓冲溶液的性质

2. pH计的使用
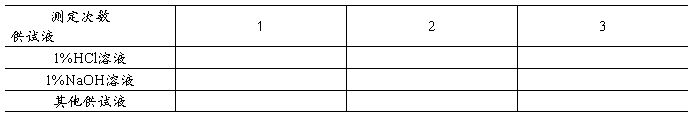
六、思考题:
1. 使用pH计应注意哪些事项?
2. 标定后,在什么情况下必须应重新标定?
教师评语: 年 月 日
第二篇:化学实验-缓冲溶液
实验:缓冲溶液
一、实验目的
1、加深对缓冲作用原理及性质的理解;
2、掌握缓冲溶液的配制方法及吸量管的使用方法;
3、学会使用pH试纸测定溶液pH值的方法。
二、实验原理
缓冲溶液的配制,主要是根据缓冲溶液pH值的计算公式: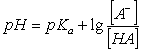 (1)
(1)
由于 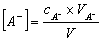
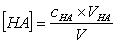
代入(1)式,得 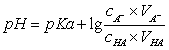 (2)
(2)
当cA-=cHA时,则得 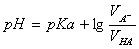 (3)
(3)
利用(2)或(3)式可配制具有一定pH值的缓冲溶液,也可以计算一定浓度和体积的共轭酸及其共轭碱溶液配制成的缓冲溶液的pH值。
由(1)式可知,缓冲溶液的pH值由[A-]/[HA](即缓冲比)决定,因此稀释时几乎不影响缓冲溶液的pH值,但稀释也是有一定限度的,过度稀释也会使缓冲溶液的pH值升高。
由于缓冲溶液中有抗酸成分和抗碱成分,故加入少量强酸或强碱,其pH值几乎不变。但所有缓冲溶液的缓冲能力都有一定限度,即各具有一定的缓冲容量,如果加入强酸或强碱的量超过了缓冲溶液的缓冲能力时,则将引起溶液pH值的急剧改变,失去了缓冲作用。
三、实验方法和实验注意事项
1、缓冲溶液的配制
取洁净大试管三支,标上号数,放在试管架上,然后用10ml刻度吸量管按下表中所示的数量,吸取0.06mol·L-1Na2HPO4及0.06mol·L-1KH2PO4加入试管中。

计算所配制缓冲溶液的pH值,记入实验报告中。同时,用洁净的玻璃棒分别蘸取上面配好的三种缓冲溶液与精密pH试纸接触,把显有一定颜色的pH试纸与标准色列比较,粗测三种缓冲溶液的pH值(注意与汁算结果是否相同)。
2、缓冲溶液的稀释
按下表中所列之顺序,做实验。把所观察到的现象记入实验报告中,并解释产生各种现象的原因。

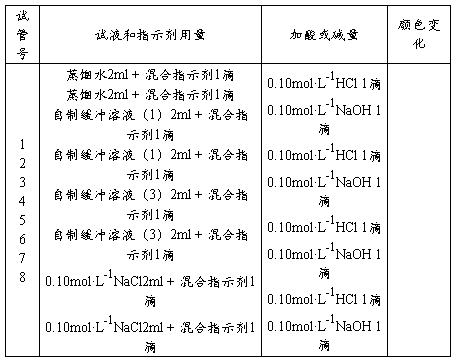
3、缓冲溶液的抗酸、抗碱作用
按下表中所列的顺序做实验。把所观察到的现象记入实验报告中,并解释产生各种现象的原因。
4、注意事项:
(1)选用吸量管的规格应适合所量溶液的体积。
(2)所测溶液的pH值应在精密pH试纸测定范围内。并在试纸蘸取溶液后30秒内完成测定。
-
EDTA标准溶液的配制与标定实验报告
EDTA标准溶液的配制与标定EDTA标准溶液的配制与标定一实验目的1掌握EDTA标准溶液的配制与标定方法2掌握铬黑T指示剂的应用条…
-
缓冲溶液配制实验
第1页共2页实验报告二缓冲溶液的配制和PH的测定区县学号姓名成绩实验内容1HAcNaAc缓冲溶液的配制注意百里酚蓝指示剂的变色范围…
-
分析化学实验-常用缓冲溶液的配制及原理-北理工
分析化学实验缓冲溶液配制原理amp常用缓冲溶液的配制一缓冲溶液与缓冲作用原理一缓冲作用与缓冲溶液纯水在25时PH值为70但只要与空…
-
实验七:缓冲溶液的配制与性能
实验七缓冲溶液的配制与性能一实验目的1学习缓冲溶液的配制方法加深对缓冲溶液性质的理解2了解缓冲容量与缓冲剂浓度和缓冲组分的比值关系…
-
生物化学实验常用试剂、缓冲溶液的配制
生物化学实验常用试剂缓冲溶液的配制方法httpvokbiocomnewsviewaspid9105molL氢氧化钠溶液组份浓度05…
-
氯化钠溶液的配置实验报告
实验4配制100mL100molL的NaCl溶液班级姓名实验目的1练习配制一定物质的量浓度的溶液2加深对物质的量浓度概念的理解3练…