食品卫生微生物学检验大肠菌群检查操作程序
大肠菌群检验标准操作程序
1 大肠菌群
1.1 试剂:月桂基硫酸盐胰蛋白胨(LST)肉汤、煌绿乳糖胆盐(BGLB)肉汤、结晶紫中性红胆盐琼脂(VRBA)、磷酸盐缓冲液、无菌生理盐水、无菌1mol/L NaOH、无菌1mol/LHCL
1.2 仪器:冰箱、恒温培养箱、恒温水浴锅、显微镜、均质器或灭菌乳钵、架盘药物
天平、灭菌吸管1ml、10ml、灭菌锥形瓶、灭菌玻璃珠、灭菌培养皿、灭菌试管、灭菌刀、剪子、镊子
1.3 大肠菌群MPN计数的检验程序


36±1℃ 48±2h

36±1℃ 48h±2h
2 操作:
2.1 样品的稀释
2.1.1 固体和半固体样品:以称取25g样品,放入盛有225ml生理盐水或磷酸盐缓冲液的无菌均质杯内, 8000r/min-10000r/min的均质1-2min,或放入盛有225ml生理盐水或磷酸盐缓冲液的无菌均质袋中,用拍击式均质器拍打1-2分钟,做成1:10的均匀稀释液。
2.1.2 液体样品:以无菌吸管吸取25ml样品置盛有225ml生理盐水或磷酸盐缓冲液的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成1:10的样品匀液。
2.1.3 样品匀液的PH值应不6.5-7.5之间,必要时分别用1mol/L NaOH或1mol/LHCL调节。
2.1.4 用1ml灭菌吸管或微量移液管理吸取1:10样品匀液1ml,沿管壁缓缓注入注入9ml生理盐水或磷酸盐缓冲液的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用一支1ml无菌吸管反复吹打,使其混合均匀,制成1:100的样品匀液。
2.1.5 根据对样品污染情况的估计,按上述操作,依次制成十倍递增系列稀释样品匀淮。每递增稀释1次,换用一支1ml无菌吸管或吸头。从制备样品匀液至样品接种完毕,全过程不得超过15分钟。
2.2 初发酵试验
2.2.1 每个样品,选择三个适宜的连续稀释度的样品匀液(液体样品可以选择原液),每个稀释度接种3管月桂基硫酸盐蛋白胨(LST)肉汤,每管接种1ml(如接种量超过1ml,则用双料LST肉汤),36℃±1℃培养24h±2h,观察倒管内是否有气泡产生,24h±2h产气者进行复发酵试验,如未产气则继续培养至48h±2h,产气者进行复发酵试验。未产气都为大肠杆菌阴性。
2.3 复发酵试验
2.3.1 用接种环从产气的LST肉汤管中分别取培养物1环,移种于煌绿乳糖胆盐肉汤
(BGLB)管中,36℃±1℃培养48h±2h,观察产气情况。产气者,计为大肠菌群阳
性管。
2.4 大肠菌群最可能数(MPN)的报告
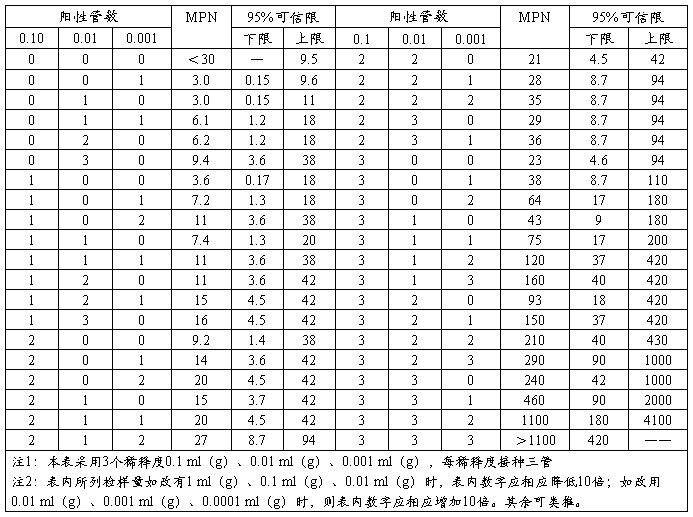
2.4.1 按确证的大肠菌群LST阳性管数,检萦MPN表,报告每g(ml)样品中大肠菌群的MPN值。(见下表)
大肠菌群最可能数(MPN)检索表
第二篇:食品卫生微生物学检验菌落总数检查操作程序
菌落总数检查操作程序
1 实验前准备
1.1 稀释水、刻度吸管、平皿
稀释水:瓶装PH值7.0无菌生理盐水,塞上胶塞,按高压蒸气灭菌操作程序,121℃湿热灭菌30分钟。取0.2ml、1ml、5ml、10ml刻度吸管、平皿置于金属容器中,140℃干热灭菌2小时。
1.1.1 培养基准备:
平板计数琼脂培养基
以上实验所需干粉培养基均由中检所提供,分别按说明加适量水加热溶解后,塞上胶塞,湿热灭菌30分钟备用。
1.1.2 无菌衣
将无菌衣、头罩、口罩、乳胶手套叠好,置于无菌衣袋中,湿热灭菌30分钟。
1.2 无菌室及操作台的准备
用0.1%的新洁尔灭溶液或75%乙醇溶液将操作台,天花板,墙壁,地面擦洗一遍,同时将操作台用0.1%新洁尔灭溶液或75%乙醇溶液擦洗一遍。将实验所需物品通过传递窗移入无菌室,打开空气净化系统,打开紫外灯,杀菌0.5-1个小时。
2 实验操作
2.1 进入无菌室更衣间,用0.1%新洁尔灭溶液或75%乙醇溶液消毒手及腕部至少一分钟,戴上头罩、口罩,穿好无菌衣及无菌手套后,进入无菌室,开始实验操作。
菌落总数操作程序
选择2-3个适宜稀释度的样品匀液,各取1ml分别放入无菌皿内




2.2 供试液的稀释及操作
2.2. 1 固体:取供试品25g,加无菌生理盐水225ml,溶解混匀,作为1:10的供试液。
2.2.2 液体:取供试品25 ml,加无菌生理盐水225ml,溶解混匀,作为1:10的供试液。
2.2.3 用1ml无菌吸管或微量移液器吸取1:10样品匀液1 ml,沿管壁缓慢注于盛有9 ml稀释液的无菌试管中,振摇试管或换用1支无菌吸管反复吹打使其混合均匀,制成1:100的样品匀液。
2.2.4 按以上操作程序,制备10倍系列稀释样品匀液。每递增稀释一次,换用1次1 ml无菌吸管或吸头。
2.2.5 根据对样品污染状况的估计,选择2-3个适宜稀释度的样品匀液(液体样品可包括原液),在进行10倍递增稀释时,吸取1 ml样品匀液于无菌平皿内,每个稀释度做两个平皿。同时,分别吸取1 ml空白稀释液加入两个无菌平皿内作空白对照。
2.2.6 及时交15-20 ml冷却至46的平析计数琼脂培养基倾注平皿,并转动平皿使其混合均匀。
2.2.7 待琼脂凝固后,将平板翻转,36℃±1℃培养48±2小时。如果样品中可能含有在琼脂培养表面弥漫生长的菌落时,可在凝固后的琼脂覆盖一薄层琼脂培养基,凝固后翻转平板培养。
2.3 菌落计数
2.3.1 做平板菌落计数时,可用肉眼观察。必要时用放大镜或菌落计数器,记录稀释倍数和相应的菌落数量。
2.4 菌落计数的报告
2.4.1 平板菌落数的选择
选取菌落数在30-300CFU之间、无蔓延菌落生长的平板计数菌落总数。低于30CFU的平板记录具体菌落数,大于300CFU的可记录为多不可计。每个稀释度的菌落数应采用两个平板的平均数;其中一个平板有较大片状菌落生长时,则不宜采用,而应以无片
状菌落生长的平板作为该稀释度的菌落数;若片状菌落不到平板的一半,而其余一半中菌落分布又很均匀,即可计算半个平板后乘2,代表一个平板菌落数。平板内出现菌落间无明显界线的链状生长时,则应将每条单链作为一个菌落计数。
2.4.2 菌落总数的计算方法
2.4.2.1 若只有一个稀释度平板上的菌落数在适宜计数范围内,计算两个平板菌落数的平均值,再将平均值乘以相应稀释度,作为每g(ml)样品中菌落总数结果。
2.4.2.2 若有两个连续稀释度的平均菌落数在适宜计数范围内时,按以下公式计算:
ΣC
 N =
N =
(n1+0.1n2)d
式中:
N——样品中菌落数;
ΣC——平板(含适宜范围菌落数的平板)菌落数之和;
n1——第一稀释度(低稀释度)平板个数;
n2——第二稀释度(高稀释度)平板个数;
d——稀释因子(第一稀释度)
2.4.2.3若所有稀释度的平板上菌落数均大于300CFU,则对稀释度最高的平板进行计数,其他平板可记录为多不可计,结果按平均菌落数乘以最高稀释倍数计算。
2.4.2.4 若所有稀释度的平板菌落数均小于30CFU,则应按稀释度最低的平均菌落数乘以稀释倍数计算。
2.4.2.5 若所有稀释度(包括液体样品原液)平板均无菌落生长,则以小于1乘以最低稀释倍数计算。
2.4.2.6若所有稀释度的平板菌落数均不在30-300CFU之间,其中一部分小于30CFU或大于300CFU,则以最接近30CFU或300CFU的平均菌落数乘以稀释倍数计算。
2.4.3 菌落数的报告
菌落数小于100CFU时,按“四舍五入”原则修约,以整数报告;菌落数大于或等于100时,第3位数字采用“四舍五入”原则修约后,取前2位数字,后面用0代替位
数;也可用10的指数形式来表示,按“四舍五入”原则修约后,采用两位有效数字;若所有平板上为蔓延菌落而无法计数,则报告菌落蔓延;若空白对照上有菌落生长,则此次检测结果无效。称重取样以CFU/g为单位报告,体积取样以CFU/ml为单位报告。
-
大学生检讨书范文
检讨书尊敬的学校领导首先请允许我发自肺腑地说一声对不起此时我怀着万分愧疚和懊悔的心来写这份检讨书真的很惭愧我不仅把我自己的一生搭进…
-
大学生考试作弊检讨书范文
大学生考试作弊检讨书范文尊敬的老师你们大家好我在考试中自带答案造成作弊行为今天我怀着愧疚和懊悔写下这份检讨书我知道这种行为是不对的…
-
大学生检讨书
大学检讨书10月23日学生被告知由于而需要进行自我检讨之后我认真反思深刻自剖为自己的行为感到了深深地愧疚和不安在此我谨向各位领导以…
-
20xx大学生违纪检讨书范文
20xx大学生违纪检讨书范文检讨书是一种常用的日常应用文是犯了错误的个人或领导向当事人或组织写出的检讨错误并保证绝不再犯的书信以下…
-
大学生考试作弊检讨书范文
大学生考试作弊检讨书范文尊敬的老师你们大家好我在考试中自带答案造成作弊行为今天我怀着愧疚和懊悔写下这份检讨书我知道这种行为是不对的…
-
微生物实验报告:水中细菌总数和大肠菌群的检测
实验六水中细菌总数和大肠菌群的检测摘要本实验以测定公园河流水的细菌总数和大肠菌群的数量来测定特定地点的水质情况初步介绍了一种通用的…
-
大肠菌群_菌落总数检验报告原始记录
微生物实验原始记录粤珍小厨餐饮管理有限公司主检审核检验日期年月日邹平县产品质量监督检验所检验原始记录主检校核检验日期年月日邹平县产…
-
菌落总数大肠菌群检验范例
饼干中菌落总数与大肠菌群的测定GBT478924食品卫生微生物学检验糖果糕点蜜饯检验一检测对象散装饼干小包装饼干二仪器用具1仪器高…
-
大肠菌群 菌落总数20xx年检验报告原始记录
邹平县产品质量监督检验所检验原始记录主检校核检验日期年月日邹平县产品质量监督检验所检验原始记录主检校核检验日期年月日邹平县产品质量…
- 大肠菌群检验原始记录