a-淀粉酶的固定化及淀粉水解作用实验教案--
实验三 α-淀粉酶的固定化及淀粉水解作用的检测
一、实验目的
1.制备固定化的淀粉酶。
2.进行淀粉水解的测定。
二、实验原理
用吸附法将a-淀粉酶固定在石英砂上,一定浓度的淀粉溶液经过固定化酶柱后,可使淀粉水解成糊精,用淀粉指示剂溶液测试,流出物呈红色表明水解产物糊精生成。
这里使用的是枯草杆菌的a-淀粉酶,其作用的最适pH范围为5.5-7.5,最是温度为50-75℃。
1、酶的固定化
酶:生物体内活细胞产生的具有催化作用的有机物。
固定化酶:将水溶性酶用物理或化学的方法固定在某种介质上,使之成为不溶于水而又有酶活性的制剂。

一般酶的固定化方法:吸附法、共价偶联法、交联法、包埋法。
吸附法:
P32利用各种吸附剂将酶或含酶菌体吸附在其表面上而使酶固定的方法。通常有物理吸附法和离子吸附法。
常用吸附剂有活性炭、氧化铝、硅藻土、多孔陶瓷、多孔玻璃等。
采用吸附法固定酶,其操作简便、条件温和,不会引起酶变性或失活,且载体廉价易得,可反复使用。
2.石英砂的吸附作用
石英砂吸附酶的物理吸附也称范德华吸附,它是由吸附质和吸附剂分子间作用力所引起,此力也称作范德华力。由于它是分子间的吸力所引起的吸附,所以结合力较弱,吸附热较小,吸附和解吸速度也都较快。被吸附物质也较容易解吸出来,所以物理吸附在一定程度上是可逆的。
3.淀粉酶催化反应
淀粉酶:淀粉酶是指一类能催化分解淀粉(包括糖原、糊精等)的糖苷键的酶之总称。
淀粉酶包括α—淀粉酶、β—淀粉酶、葡萄糖淀粉酶、脱支酶、麦芽寡糖生成酶等水解酶类和葡萄糖苷转移酶、环状糊精葡萄糖苷转移酶等。
α—淀粉酶是一种内切酶,它随机地从分子内部切开α—1.4糖苷键(水解中间的α—1.4键比分子末端的α—1.4键概率大),遇到分支点的α—1.6键不能切,但能跨越分支点而切开内部的α—1.4糖苷键,由于产物的还原性末端葡萄糖残基上的C1碳原子呈α—构型(光学),故称这种酶为α—淀粉酶。
α—淀粉酶的水解反应:淀粉在α—淀粉酶的作用下很快被切割成分子较小的糊精、低聚糖、麦芽糖、葡萄糖等,引起粘度下降,对碘呈色反应为篮-紫-红-无色,又叫液化酶。
糊精:分子式为(C6H10O5)n?H2O,为白色或类白色的无定形粉末;无臭,味微甜。在沸水中易溶,在乙醇或乙醚中不溶。
4.淀粉的水解
α-淀粉酶 β淀粉酶 糖化淀粉酶


 淀粉 糊精 麦芽糖 葡萄糖
淀粉 糊精 麦芽糖 葡萄糖
遇碘显蓝色 遇碘显红色
淀粉遇碘显色原理:淀粉、糊精等与碘结合为淀粉/糊精-碘包合物显色。分子结构不同,结合方式不同,颜色不同。
三、实验对象
高中生。(本实验来自浙版高中生物选修一)
四、实验材料和器械
材料:a-淀粉酶、石英砂、淀粉/KI-I2溶液、蒸馏水。
器械: 层析柱、滤布、烧杯、指形管、量筒、胶头滴管、玻璃棒、电子天平。
五、实验步骤
1、配制可溶性淀粉溶液。用电子天平称取25mg可溶性淀粉溶于50ml沸水(可溶性淀粉先用冷水调成糊状,再加入沸水中至50ml)。将配制好的淀粉溶液放置在60℃的水浴锅中备用。(注意:此数据为一组实验的用量,若配全班用量乘以实验小组数即可,可由授课教师配制全班用量以节省时间。)【方案改进:淀粉溶液在70℃水浴锅中保温,且在水浴锅中已为学生准备好用100ml烧杯装的配制好的淀粉溶液,注意嘱咐学生要在用层析柱反应时才拿出来,勿提前拿;而之前检测石英砂固定a-淀粉酶的上清液所用淀粉于水浴锅中大烧杯中取,避免小烧杯中淀粉溶液取出来之后温度降低致使反应结果不佳。】
2、α—淀粉酶的固定化。在50ml烧杯中将电子天平称取的5mg a-淀粉酶溶于4ml蒸馏水中,由于酶不纯,可能有些不溶物,再加入电子天平称取的5g石英砂,不时搅拌,固定化15分钟。(注意:搅拌时用力不可太猛及搅拌时间不易过长,以免石英砂被磨细穿过滤布带入到流出液中,搅拌的速度应是缓慢的,搅拌时间过长也不易酶的固定,这里授课老师可以做示范动作让学生来体会。)【方案改进:由于实验时间不足的问题,前两个步骤由教师准备。】
3、检测未吸附的游离淀粉酶是否洗涤干净。小心倒掉上清液后,(每次)用10-15ml的蒸馏水小心清洗石英砂2-3次,每次取其上清液0.5ml于试管中,同时滴加淀粉溶液充分混匀。再加入1-2滴KI-I2 溶液,若溶液变为蓝色,说明中已无游离a-淀粉酶,如果溶液为红色,继续用蒸馏水清洗,直至淀粉溶液变为蓝色为止。
4、先把滤布放入固定化酶装柱中,再装入固定有a-淀粉酶的石英砂约4ml,装柱过程中可在装有石英砂的烧杯中加入少量蒸馏水,便于石英砂流入层析柱,同时适当打开层析柱的调节装置,使多余的液体可以流出。(加入少量蒸馏水的目的是让固定好a-淀粉酶的石英砂尽量全部装进柱中,装柱时应尽量使石英砂的表面平整,这样可以使淀粉溶液充分与酶反应。流出的液体主要是加入的蒸馏水)
5、将灌注了固定化酶的层析柱放在支架上,用滴管加淀粉溶液后,调节层析柱的调节装置使淀粉溶液约以0.3ml/min(6滴/min)的流速过柱,在流出1-2ml反应液后(让塑料管中的水流出),转动关闭层析柱的调节装置,放置5min(让淀粉液与酶充分反应)。
6、打开调节装置,0.3ml/min(6滴/min)的流速过柱,在流出1-2ml反应液后(1-2ml液为:装柱下面塑料管中未充分反应的淀粉液),用两支试管分别接收约0.5ml流出液(10滴,20滴为1ml),按以下表格在试管中加入相应试剂,观察结果。
六、实验结果与分析
流出液+碘液:1.变红,有糊精生成。若为浅红,则说明糊精含量少,淀粉中支链淀粉含量少。支链淀粉被α—淀粉酶催化生成糊精。
2.变蓝,①流速过快,淀粉流出。②保温效果差,反应时淀粉温度降低过多。
3.浅黄,碘液的颜色,没有糊精生成,也没有淀粉流出。由于淀粉反应后的产物不止一种,而且支链淀粉含量少,故生成糊精量少,反应后用碘液检测时红色不明显,或者由于酶不纯,不仅有α—淀粉酶,还有β淀粉酶,糊精又被β淀粉酶反应成麦芽糖,麦芽糖遇碘不显色。
4.紫色:有糊精生成,也有淀粉未反应而流出。①温度降低过快,酶活力低。②流速过快,淀粉为反应充分而流出。
七、注意事项
1、α—淀粉酶的固定化过程中,用力不易过猛,搅拌时间不易过长。
2、加固定好酶的石英砂入层析柱时,勿先加液体,应直接用玻璃棒将石英砂弄入层析柱,动作轻柔,将石英砂填平、填实。
3、在层析柱中加入溶液不要过快,防止石英砂表面不平整。
4.要在用层析柱反应时才将淀粉溶液从水浴锅中拿出来,勿提前拿,否则在室温下温度降低过快;而之前检测石英砂固定α-淀粉酶的上清液所用淀粉于水浴锅中大烧杯中取,避免小烧杯中淀粉溶液取出来之后温度降低致使反应结果不佳。
5.滴速不能过快,使其充分反应。
八、具体实验讲解
同学们,开始上课,我们今天要做的实验,是α—淀粉酶的固定化及淀粉水解作用的检测。那什么是固定化酶呢?请大家把书翻到书P30,看到原理第二段,我请一位同学起来读一下:固定化酶就是将水溶性的酶用物理或化学的方法固定在某种介质上,使之成为不溶于水而又有酶活性的制剂。
好,我们了解了固定化酶的概念,那固定化酶有哪些优点呢?大家来看一下资料。
我们要做的实验是α—淀粉酶的固定化,那……为什么要选用α—淀粉酶呢?
①水溶性酶②它的反应物和产物都容易被检测③便宜易寻
今天我们要用的固定方法是吸附法,什么是吸附法呢?
请大家往后翻一页,翻到P32,看到资料搜索1,我请一位同学来读一下第一段:利用吸附剂将酶或含酶菌体吸附在其表面而使酶固定的方法,通常有物理吸附和离子吸附。
好,吸附法通常有物理吸附和离子吸附,简单地说,物理吸附就是利用范德华力进行吸附,而离子吸附则是利用的离子正负电荷相吸的原理。当然,方法不止一种,具体的请大家自己课后查一下。
刚才同学们说到,固定化酶就是将水溶性的酶用某种方法固定在某种介质上,那用什么介质来固定?好,石英砂在这里就闪亮登场了,为什么采用石英砂呢?它的吸附原理是怎样的?首先,大家来看一下原理,它是通过分子间的范德华力,与α—淀粉酶很好的结合吸附,石英砂在这儿采用的就是物理吸附。同时它具有良好的惰性,不与底物、产物发生反应。
好,α—淀粉酶、石英砂有了,具体怎么固定呢?我们就开始做实验了。
首先,在50ml烧杯中将5mg α—淀粉酶溶于4ml蒸馏水中,如果有不溶物,大家不要担心,这是由于酶不纯所引起的,属于正常现象。接下来,再加入5g石英砂,不时地轻轻搅拌,固定化15分钟。注意,搅拌时用力不可太猛,时间不能过长,以免石英砂被磨细影响后续实验,由于固定需要15分钟,时间过长,所以这一步骤我们已为大家准备好。
固定好之后就可以装柱了,大家看这个层析柱,下面有一个小孔,我们可不可以直接将石英砂倒进去啊?石英砂会漏下去对不对?那我们就将一块滤布塞入柱中,用玻璃棒沾一点杯子中的水,把滤纸润湿,让滤纸贴在层析柱中,接下来就可以将石英砂转移进柱中,用蒸馏水辅助,将杯子中剩下的石英砂尽量全部转移进层析柱中,同时要打开层析柱下方的调节装置,使多余的液体流出。这里同学们要注意了,装柱时应尽量使石英砂的表面平整,填实一些,这样可以使淀粉溶液充分与酶反应。
好了,装完柱之后我想问大家一个问题,是不是所有的a-淀粉酶都被固定在石英砂上了呢?那游离的α—淀粉酶应该怎么处理呢?洗到什么程度,又如何检测呢?请大家结合淀粉水解原理讨论一下。
α-淀粉酶 β淀粉酶 糖化淀粉酶


 淀粉 糊精 麦芽糖 葡萄糖
淀粉 糊精 麦芽糖 葡萄糖
遇碘显蓝色 遇碘显红色
我们小心倒掉上清液后,(每次)用10-15ml的蒸馏水小心清洗石英砂2-3次,每次取其上清液0.5ml于试管中,同时滴加淀粉溶液充分混匀。再加入1-2滴KI-I2 溶液,若溶液变为蓝色,说明中已无游离α—淀粉酶,如果溶液为红色,继续用蒸馏水清洗,直至淀粉溶液变为蓝色为止。在这儿呢,我们已经为大家配好了0.5mg/ml的淀粉溶液,在70℃水浴锅中恒温保存,一会儿大家洗涤游离酶的时候可以直接去取。
我们排除了游离酶的干扰,但是,我们能确定石英砂上真正有固定了的α-淀粉酶吗?我们肉眼看不到,那这是我们应该怎么办?可以利用淀粉水解原理来检测。
将灌注了固定化酶的层析柱放在支架上,用滴管加淀粉溶液后,调节层析柱的调节装置使淀粉溶液约以0.3ml/min(10s一滴)的流速过柱,在流出1-2ml反应液后(让塑料管中的水流出),转动关闭层析柱的调节装置,放置5min(让淀粉液充分与酶反应)。
打开调节装置,0.3ml/min(10s一滴)的流速过柱,在流出1-2ml反应液后(1-2ml液为:装柱下面塑料管中未充分反应的淀粉液),用两支试管分别接收约0.5ml流出液(10滴,20滴为1ml),按以下表格在试管中加入相应试剂,观察其颜色变化。
我再为大家理一下实验步骤,淀粉溶液我们已经为大家配好,固定15分钟也已准备好,同学们要做的就是将游离酶洗去,然后装柱,最后用淀粉溶液进行检测。大家还有没有什么疑问?
好,那就开始做实验吧!
附:板书
……
第二篇:糖化酶固定化实验报告
糖化酶固定化实验报告
学 号: 080500130
姓 名: 黄兆峰
专 业: 微生物工程
其他组员:黄志成、李盟、苏温培
指导老师: 朱秋享
实验时间: 2008.11.5—2008.11.7
一、目的要求
本实验为酶工程综合实验,由学生自行设计实验方案,培养学生独立实验的能力;并掌握酶活测定方法,米氏常数测定,学习固定化酶的常用方法及固定化酶的表征。
二、基本原理
游离酶可通过各种固定化方法,增加其稳定性并且有利于连续化生产和重复使用。酶固定化后可用各种理化性质的变化来表征其效果。
酶活测定原理:糖化酶(即淀粉α-1,4-葡萄糖苷酶)有催化淀粉水解的作用,从淀粉分子非还原性末端开始,分解α-1,4-葡萄糖苷键生成葡萄糖,反应生成的葡萄糖用次碘酸钾法定量测定,以表示糖化性淀粉酶的活力。
本次固定化酶使用的方法是包埋法,将酶、细胞或原生质体包埋在各种多孔载体中,使其固定化的方法成为包埋法。包埋法制备固定化酶、固定化细胞或固定化原生质体时,根据载体材料和方法的不同,可分为凝胶包埋法和半透膜包埋法两大类。以各种多孔凝胶为载体,将酶、细胞或原生质体包埋在凝胶的微孔内的固定化方法为凝胶包埋法。本次实验中具体使用的方法为海藻酸钙凝胶包埋法。
三、实验仪器及材料
1、实验用乳化机WL500CY、注射用筒50mL6号针头、冰箱、其他实验常用玻璃仪器
2、糖化酶、海藻酸钠、明胶
四、试剂配方
1、2%可溶性淀粉
称取可溶性淀粉碎2g(预先100℃烘干约2h至恒重),用少量蒸馏水调匀,徐徐倾入已沸的蒸馏水中,煮沸至透明,冷却定容至100ml,此溶液需当天配制。
2、1mol/LpH4.5醋酸钠缓冲液
取无水醋酸钠8.024g,先在少量水中溶解,定容至1000ml。取分析纯冰醋酸5.78ml定容至1000ml。以上两种溶液按醋酸和醋酸钠的体积比为25:22混合即为所要求的缓冲液。
3、0.05 mol/L碘液:
称取25克碘化钾溶于少量水中,加入12.7克碘,溶解后定容至1000毫升贮存于棕色瓶中。
4、0.1 mol/L氢氧化钠溶液:
称取分析纯氢氧化钠4克溶解并定容至1000毫升。
5、1 mol/L硫酸 :
吸取分析纯浓硫酸(比重1.84)55.5毫升,缓缓如入944.5毫升水定容至1000毫升。
6、0.1 mol/L硫代硫酸钠:
称取26克硫代硫酸钠和0.4克碳酸钠,用煮沸冷却的蒸馏水溶解并定容至1000毫升,配制后放置三天再标定。
五、实验步骤
1、酶活测定
⑴ 操作步骤
取2%可溶性淀粉溶液25毫升加pH4.5醋酸缓冲液5毫升混匀于比色管,在40℃恒温水浴中预热5-10分钟加入待测酶液2毫升(空白以蒸馏水代替酶液)准确计时1小时。取出加入4滴20%NaOH终止酶反应,冷却至室温。取上述反应液5毫升于定容瓶中,先加入0.05mol/L碘液10毫升,再加0.1 mol/LNaOH 10毫升,摇匀暗处静置15分钟。加入 2N硫酸 2毫升。用 0.1mol/L硫代硫酸钠滴定至无色。其与空白消耗硫代硫酸钠毫升数的差值应在4~6之间,否则要适当调整酶液的稀释倍数。
⑵ 计算
酶活(mg/ml)=(A-B)*N*90.05*V1/V2/V3 *2
A—空白所消耗的Na2S2O3的毫升数;
B—样品所消耗的Na2S2O3的毫升数;
90.05—1毫升1N的Na2S2O3相当的葡萄糖毫克数;
V1—反应液总体积(32.20毫升);
V2—吸取反应液样品体积(5毫升);
V3-吸取酶液毫升数(2毫升);
2—反应30min,换算成1h的酶活力系数所得的结果表示至整数;
N—Na2S2O3的当量浓度(0.1mol/L)。
2、米氏常数的测定
取1ml游离酶,分别以0.20%,0.30%,0.40%,0.50%,1.00%,2.00%浓度的可溶性溶液为底物,在40℃下反应10min,采用以上的方法测定游离酶活,做Line weaver-Burk双倒数曲线图,即以1/[S]为横作标,以1/v(反应初速度)为纵坐标。其斜率即为米氏常数。
3、糖化酶的固定化
将酶液15ml游离酶与3%的海藻酸钠150ml混合,然后加入3%的明胶溶液150ml混合乳化约10min,调pH为4,慢速搅拌并降温至5~10℃,通过6号注射针头将上述冷却液以5cm的高度注进1%氯化钙溶液中,立刻形成光滑的微球,然后保持温度为4℃,球在氯化钙溶液中被硬化30min,固定化酶被贮存在0~5℃冰箱。
4、固定化酶的酶活测定
⑴ 操作步骤
取2%可溶性淀粉溶液25毫升加pH4.5醋酸缓冲液5毫升混匀于比色管,在40℃恒温水浴中预热5-10分钟加入固定化酶5g(空白以蒸馏水代替固定化酶)准确计时1小时。取出过滤终止酶反应,冷却至室温。取上述反应液5毫升于定容瓶中,先加入0.05mol/L碘液10毫升,再加0.1 mol/LNaOH 10毫升,摇匀暗处静置15分钟。加入 2N硫酸 2毫升。用 0.1mol/L硫代硫酸钠滴定至无色。
⑵ 计算
酶活(mg/ml)=(A-B)*N*90.05*V1/V2
A—空白所消耗的Na2S2O3的毫升数;
B—样品所消耗的Na2S2O3的毫升数;
90.05—1毫升1N的Na2S2O3相当的葡萄糖毫克数;
V1—反应液总体积(32.20毫升);
V2—吸取反应液样品体积(5毫升);
N—Na2S2O3的当量浓度(0.1mol/L)。
5、固定化酶活力回收测定
固定化酶活力回收=固定化酶总活力/溶液酶总活力X100%
6、固定化酶半衰期测定
六、实验数据与数据处理
1、
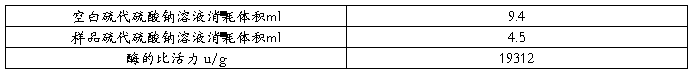
表1 糖化酶酶活测定
2、
表2 糖化酶米氏常数测定HHHH
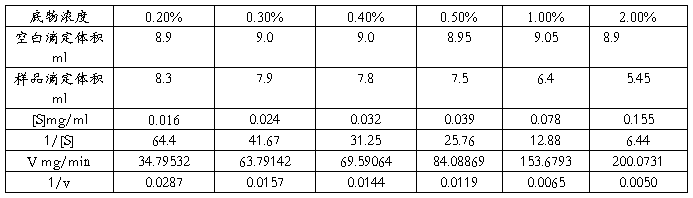
以1/[S]为横作标,以1/v(反应初速度)为纵坐标,做Line weaver-Burk双倒数曲线图,其斜率即为米氏常数。Km=0.0004/0.0015=0.267
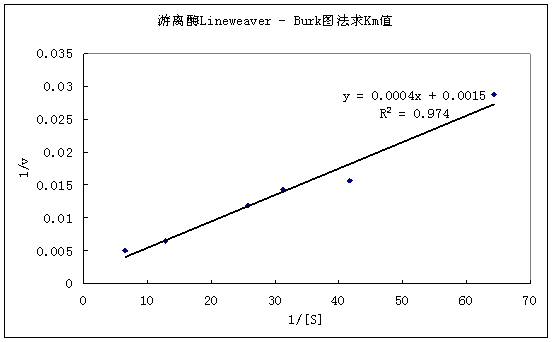
图1 Line weaver-Burk双倒数曲线图
3、
表3 固定化酶酶活测定

4、固定化酶回收率的计算:
100ml胶酶溶液相当的酶活力u=总的固定化酶质量×固定化酶比活力
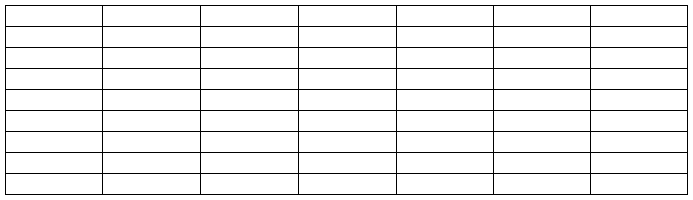
=45.6×7.85 =357.96(u)
315ml胶酶溶液相当于15ml酶溶液活力u=
=357.96/100×315=1127.57u
15ml酶溶液的总活力u=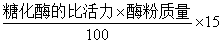
=19312/100*15=2896.8u
固定化酶的回收率ω%=
=1127.57/2896.8×100%=38.9%
5、固定化酶半衰期的测定
表4 固定化酶的半衰期测定表格

由下图得:t1/2=ln2/0.0068=110h(4天零14小时)
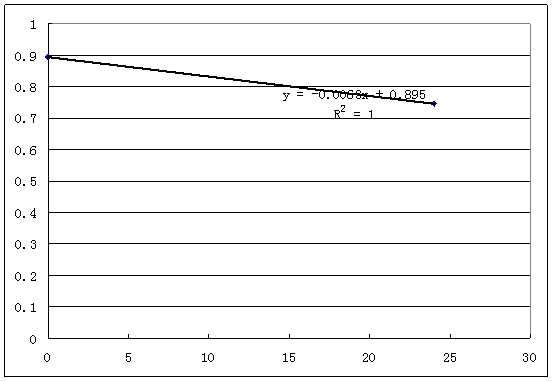
图2 固定化酶半衰期的测定
七.结果与讨论:
本实验采用包埋法对糖化酶进行固定化并对其Km,半衰期t2/1重要参数进行测定,随着人们对天然高分子载体的不断挖掘和探究,对其进行改性,或利用超临界技术、纳米技术、膜技术等来固定化酶,同时,开发新型、高效固定化酶反应器,进一步提高转化和生产能力是固定化酶技术发展的趋势。
以上实验得出实验数据如下:

误差分析:
(1)实验中要求采用的硫代硫酸钠溶液需放置三天才能使用,而我们没有做到这一点,这使结果发生偏差。
(2)由于在测固定化酶的活力过程中,固定化酶微球会浮在反应液表面,要使它们能与反应液均匀接触,要在反应过程中不断搅拌反应液,我们是隔一段时间去搅拌一次,而不是使它一直保持搅拌状态,所以测的结果有偏差。
(3)我们测定酶活的方法是采用滴定硫代硫酸钠法,由于我们操作的不够熟练,在滴定的过程中会多滴一两滴,这使我们的一些数据会偏大。
(4)测固定化酶活与固定化酶的回收率,没有在同一天做,固定化酶放置了一天,这使固定化酶的回收率测定出现偏差。