置换法测定摩尔气体体积
实验一 摩尔气体常数的测定
一、实验目的
1. 掌握理想气体状态方程式和分压定律的应用。
2. 掌握测定摩尔气体常数的一种方法。
二、实验原理
用锌与过量的稀盐酸反应生成H2,在一定温度和压力下,测出生成H2的体积VH2,代入 ,求
,求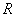 。反应
。反应
Zn(s)+2HCl(aq)=ZnCl2(aq)+H2(g)↑
在一定的温度和压力下,测出放出气体的体积(V)
由于收集中的H2中含有水蒸气,则需查此实验温度下水的饱和蒸气压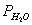 。根据分压定律
。根据分压定律  ,则
,则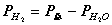
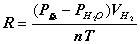
三、仪器、药品和材料
电子天平,气压计,量气管(或50 mL碱式滴定管),水平管,带支管的反应管,夹子,砂纸;纯锌片,HCl(6 mol·L-1)。
四、实验步骤
1. 用电子天平准确称出锌片的质量,每份重约0.07~0.09 g左右为宜。
2. 将反应装置连接好,先不接反应管,从水平管加水使水的体积在总体积的1/3~2/3,使量气管、胶管充满水,量气管水位略低于“0”刻度,最好不要高于10 mL。
3. 在小试管中用滴管加入3 mL 6 mol·L-1的HCl溶液,注意不要使盐酸沾湿小试管液面以上内壁,将锌片挂在塑料钩上(不和HCl反应),将试管固定,塞紧橡皮塞。
4. 检查系统的气密性:将水平管向上或向下移动一段距离后停下,若开始时水平管水面有变化而后维持不变,说明系统不漏气。如果漏斗内的水面一直在变化,说明与外界相通,系统漏气,应检查接口是否严密,直至不漏气为止。
5. 移动量气管使水平管中液面和量气管液面在同一水平面位置,然后准确读出量气管内水的弯月面最低点的读数V1。松开铁夹,使锌片落入酸中。右手拿着水平管随同量气管水面下降,保持量气管中水面与漏斗中水面在同一水平面位置,量气管受的压力和外界大气压相同。反应结束后,保持水平管液面和量气管液面处在同一水平面上。过一段时间记下量气管液面高度,过l~2 min再读一次,如果两次读数相同,表明管内温度与室温相同,记下反应后量气管内水面的精确读数V2。
6. 记下室温和大气压数据。
7. 从附表中查出室温时水的饱和蒸气压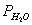 。
。
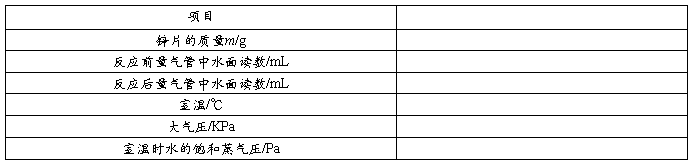
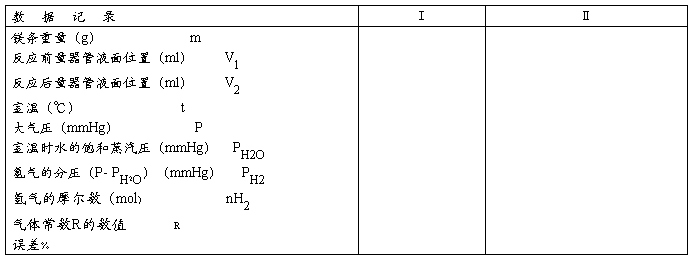
五、数据记录
六、实验数据处理
提示:(根据上面记录的数据书写计算气体常数R的过程及相对误差的计算)
七、结果分析
提示:(主要书写误差分析,测量值R和理论值相比较)
八、思考题
1. 实验中需要测量哪些数据?
2. 为什么必须检查装置是否漏气?如果装置漏气,将造成怎样的误差?
3. 读取液面位置时,为何要使量筒和漏斗中的水面保持同一水平面?
第二篇:置换法测定气体常数
 气体常数R的测定
气体常数R的测定
一、 基本原理
理想气体状态方程PV=nRT表示一定量理想气体的体积与压强的乘积与气体的物质的量和它的绝对温度的积之比R是一个常数,即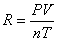 。因此对一定量的气体,若在一定温度、压力条件下测出其体积就可求出R,本实验是测定铝与稀盐酸反应产生的氢气的体积。
。因此对一定量的气体,若在一定温度、压力条件下测出其体积就可求出R,本实验是测定铝与稀盐酸反应产生的氢气的体积。
Mg+H2SO4=MgSO4+H2↑
即将一定重量(w)的镁条与过量的稀硫酸作用,在一定的温度与压力条件下,测出被置换的湿氢气的体积V,而氢气的物质的量可由镁条的重量算出,由于氢气是在水面上收集的,故混有水蒸气,若查出实验温度下所得饱和蒸汽压,就可由分压定律,算出氢气的分压:
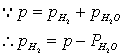
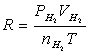
由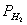 、
、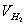 、
、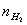 、T等就可利用公式求出R。
、T等就可利用公式求出R。
二、 实验内容
 1. 用砂纸擦去镁条表面氧化膜,取两片35-45mg镁条分别在电子分析天平上准确称量;
1. 用砂纸擦去镁条表面氧化膜,取两片35-45mg镁条分别在电子分析天平上准确称量;
2. 按图右图把仪器装好,打开试管2的塞子由漏斗3往量气管1内装水至略低于刻度“0”装置,上下移动漏斗以赶净胶管和量气管气壁的气泡,然后将试管的塞子塞紧。
3. 检查装置是否漏气;
4. 取下试管,调整漏斗高度,装入3mol/L稀硫酸,将镁条用水浸湿,贴在试管壁上;再检查装置是否漏气。如不漏气,调整漏斗位置,使量气管内水面与漏斗内水面在同一水平面,记下量气管内液面的位置V1;
5. 轻轻振荡试管,使镁条落入稀硫酸中,镁条与稀硫酸反应放出H2,大量的氢气进入量气管中,将管内的水压到漏斗中,为了避免图量气法测定装置管中压力过大而造成漏气,在量气管内水平面下降的同时,慢慢下移漏斗,使两者的水面基本保持相同水平,反应停止后,待试管冷却至室温,移动漏斗,使其水面与量气管水面相平,读出反应后量气管内水面的精确读数V2,1-2分钟,再记录一次液面位置,如二者相差太大,需重复操作,至两次记录数据相差不超过0.01ml。
6. 记录实验时的室温t与大气压P,并从附录中查出室温时水的饱和蒸汽压PH2O
7. 用另一镁条重复上述操作。
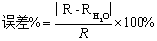 6、怎样除去镁条表面的氧化物与脏物,如何判断已除净?如未除净对实验结果有何影响?
6、怎样除去镁条表面的氧化物与脏物,如何判断已除净?如未除净对实验结果有何影响?
答:将砂纸对折夹住镁条,向一个方向拉,可砂去氧化物与脏物。注意用力要均匀,不要将镁条折断。有时镁条表面不平,凹处脏物难以除去,可将镁条放在木块上,集中擦凹处。
将砂过的镁条对光观察,如表面均呈金属光泽,无黑点,则表示氧化物与脏物已除去。此时用干净的纸夹住镁条,向一个方向拉,除去遗留的脏物。
答:用直接称量法称镁条质量 :
⑴直接在天平盘上放入长镁条50-70mg,称出其质量,记录。
⑵二等分镁条,分别称出小镁条质量,用小称量纸包好,写上镁条质量。将它们放在干燥的50mL小烧杯中备用。
如何安装量气装置?
答:安装的顺序是:先下后上、自左至右,要求各连接部分既紧密吻合,又无张力。整套装置要平正、整齐、正确美观。拆卸仪器的顺序则与安装时正好相反,即先右后左、从上而下,安装次序如下:
⑴.先安装十字夹、自由夹,再安装滴定管夹;
⑵.用橡皮管连接量气管末端(50mL刻度处)、乳胶管连接量气管零分度处(乳胶管、橡皮管需安装到量气管的收缩部分),将量气管夹在滴定管夹的左侧;
⑶.连接橡皮管与筒形漏斗,将筒形漏斗放入自由夹钳口,左手抓住钳口,右手轻缓旋转螺丝使漏斗沿口正好能挂在自由夹钳上。
测定装置的哪些部位易漏气?如装置漏气如何查原因?
⑴漏气部位 :乳胶管,乳胶管分别与量气管、支管(试管)的连接处,试管的管口与塞子塞紧处
⑵逐项检查 :1.乳胶管 将其拉长后对光观察,如有小孔或老化现象则会漏气
②乳胶管与量气管、支管连接处是否紧密。
③试管的平头塞是否塞紧。
16如何调节量气管内的液面略低于“0”刻度,为什么要调节液面?
答:小心将试管夹在滴定管夹的右侧,支管连接乳胶管。左手提漏斗上移,待液面上升至略低于零刻度时,右手拿磨口塞塞进试管口,放漏斗在自由夹内后塞紧塞子,此时量气管的液面符合要求。
20为什么要待试管冷至室温后,才能记录液面位置?如何判断已冷至室温?
答:反应放热,使试管、气体的温度提高,但计算 R 时,气体的温度为室温,所以要冷至室温。
用手摸有液体部分的试管,不感到热时,可读数、记录液面的位置(记住两液面要同一水平),稍等1~2min再读取、记录液面的位置,如两次读数相等或<0.05mL,则可认为已与室温一致。
2 第一份镁条用于测试后,为什么试管中的酸不能用于第二份的测定?
答:用第一份镁条测试时,倾斜试管,酸与镁条接触开始反应,此时试管壁上已有酸。如不倒掉后洗净,则第二份镁条一碰到管壁就会与酸反应,所以试管内的酸不再利用,要倒掉,并用自来水冲洗至无酸
18 在反应前为什么要将漏斗降低,反应时随管内液面下降,漏斗相应移动?
答:避免管内压力过大。若漏斗未下移,漏斗内液面位置高于量气管内液面,管内气体受到的压力大于大气压力。若管内压力过大,H2易泄漏。
计算式 :
R=p(H2)×V(H2)×Ar(Mg) / m(Mg)
6、怎样除去镁条表面的氧化物与脏物,如何判断已除净?如未除净对实验结果有何影响?
答:将砂纸对折夹住镁条,向一个方向拉,可砂去氧化物与脏物。注意用力要均匀,不要将镁条折断。有时镁条表面不平,凹处脏物难以除去,可将镁条放在木块上,集中擦凹处。
将砂过的镁条对光观察,如表面均呈金属光泽,无黑点,则表示氧化物与脏物已除去。此时用干净的纸夹住镁条,向一个方向拉,除去遗留的脏物。
-
桥梁施工技术总结
一、空心板连续段施工:1、主要技术难点或要点:(1)临时支座安装(2)模板安装(3)负弯矩区结构施工(4)体系转化2、详细阐述:(…
-
20xx年隧道施工管理总结
20xx**高速公路**施工段**隧道施工现场管理工作总结至20xx年x月以来,在各级领导的关心和关怀下,在总公司、分公司的正确指…
-
工程识图实训总结
工程识图实训是建筑工程技术专业教学计划中重要的实践教学环节,是学生在校学习期间理论联系实际、增长实践知识的重要手段和方法之一。为了…
-
小学总务主任工作总结
个人工作总结本学期,在校领导的正确领导下,在全体教师的帮助、支持下,我以“服从领导、团结同志、认真学习、扎实工作”为准则,以“科学…
-
20xx年xx县社保局依法行政工作总结
20xx年,我局在县委、县政府的领导下,坚持以邓小平理论、“三个代表”重要思想和十七大精神为指导,以“有法可依、有法必依、执法必严…