篇一 :实验二 置换法测定摩尔气体常数
置换法测定摩尔气体常数R
一、 目的要求:
1、掌握理想气体的状态方程和气体分压定律的应用
2、练习测量气体体积的操作和气压计的使用
3、测定摩尔气体常数R
二、 基本原理:
1、活泼金属镁与稀硫酸反应,置换出氢气
Mg+H2SO4=MgSO4+H2↑
2、准确称取一定质量(mMg)的金属镁,使其与过量的稀硫酸作用,在一定温度和压力下测定被置换出来的氢气的体积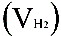 ,有理想气体状态方程式即可算出摩尔气体常数 R. R=
,有理想气体状态方程式即可算出摩尔气体常数 R. R=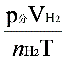 (
(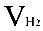 为氢气的分体积,
为氢气的分体积,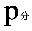 为氢气的分压强,
为氢气的分压强, 为氢气的摩尔质量,T为温度)
为氢气的摩尔质量,T为温度)
三、 数据记录及处理:
室 温 t = 23.5 ℃
大气压力 p = 101720 Pa
室温时水的饱和蒸汽压 p水= 2843 Pa
表1
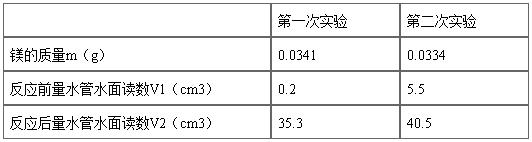
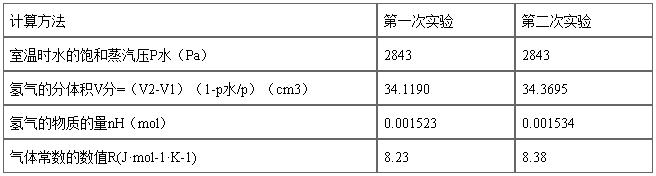
表2
百分误差= 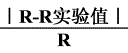
四、 结果与讨论
1、R的测量值与实际值的差距在误差允许范围内。
2、实验中测定气体体积的时候,不够精确,会有误差。
…… …… 余下全文
篇二 :无机化学实验第四版置换法测定镁的摩尔质量实验报告
实验名称:置换法测定镁的摩尔质量
实验日期: 温度: 气压:
一、实验目的
1.了解置换法测定镁的相对原子质量的原理和方法
2.掌握气态方程和分压定律的有关的计算
3.练习使用量气管和气压计
二、实验原理
1.在一定的温度T和压力P下,一定质量m的镁与足量的稀硫酸反应,可置换出一定体积y的氢气(含水蒸汽) Mg+H2SO4===MgSO4+H2
常压下的氢气可近似看作理想气体,根据气体状态方程和化学方程式,则有:
PH2V=nH2RT=(m/M)RT R为常数 R=8.314 R的单位Pa*m3/mol*K T=(t+273)K
根据分压定律:PH2=P-PH2O,(我们所需的是氢气的压力,但是我们不能直接得到,所以我们通过大气的压力减去水蒸汽的压力便是我们想得到的氢气压力)
整理后可得:M=mRT/[(P-PH2O)]V
三、实验内容
1.用砂纸将镁条打光,清除掉表面氧化物膜,截取一段,在电子天平上准确称其质量。
2.装配好仪器,由漏斗注水至近于量气管刻度“0”的位置,上下移动漏斗以驱赶量气管与橡皮管内的气泡。
3.检查装置是否漏气,将各连接处的橡皮塞塞紧,把漏斗下移适当的距离固定,如果连气管内的液面只在开始时稍有下降,以后维持恒定,经3至5分钟不变,可判断装置不漏气。
…… …… 余下全文
篇三 :摩尔气体常数的测定
实验十六 摩尔气体常数的测定
一、 实验目的
1、了解分析天平的结构、计量性能,学习并掌握直接称量法;
2、学习测量气体体积的操作 :装置的安装、检漏、量气管液面的观察与读数;
3、学习气体分压的概念;
4、学习误差的表示、数据的取舍、有效数字及其应用规划
5、学习用洗液洗涤特殊仪器。
二、 预习内容
电子天平的使用及称量方法
⑴使用步骤
端坐在天平前,放置干燥器、烧杯等物的搪瓷盘放在天平的左边,实验报告本等放在天平的右边。
查看天平水平仪,气泡是否在黑圈内,如不在黑圈内表示天平不水平,要通过水平调节脚调至水平。
接通电源,预热60分钟后方可开启显示器进行操作使用。
称量前要用标准砝码校正天平。
轻按ON显示器键,等出现0.0000g称量模式后方可称量。
将称量物轻放在称盘上,关严天平门,这时显示器上数字不断变化,待数字稳定并出现质量单位g后,即可读数,并记录称量结果。
…… …… 余下全文
篇四 :摩尔气体常数的测定
实验十六 摩尔气体常数的测定
一、 实验目的
1、了解分析天平的结构、计量性能,学习并掌握直接称量法;
2、学习测量气体体积的操作 :装置的安装、检漏、量气管液面的观察与读数;
3、学习气体分压的概念;
4、学习误差的表示、数据的取舍、有效数字及其应用规划
5、学习用洗液洗涤特殊仪器。
二、 预习内容
电子天平的使用及称量方法
⑴使用步骤
端坐在天平前,放置干燥器、烧杯等物的搪瓷盘放在天平的左边,实验报告本等放在天平的右边。
查看天平水平仪,气泡是否在黑圈内,如不在黑圈内表示天平不水平,要通过水平调节脚调至水平。
接通电源,预热60分钟后方可开启显示器进行操作使用。
称量前要用标准砝码校正天平。
轻按ON显示器键,等出现0.0000g称量模式后方可称量。
将称量物轻放在称盘上,关严天平门,这时显示器上数字不断变化,待数字稳定并出现质量单位g后,即可读数,并记录称量结果。
…… …… 余下全文
篇五 :摩尔气体常数的测定
摩尔气体常数的测定
一、实验目的
1.了解一种测定摩尔气体常数的方法。
2.熟悉分压定律与气体状态方程的应用。
3.练习分析天平的使用与测量气体体积的操作。
二、实验原理
气体状态方程式的表达式为:pV = nRT = 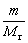 RT (1)
RT (1)
…… …… 余下全文
篇六 :置换法测定摩尔气体体积
实验一 摩尔气体常数的测定
一、实验目的
1. 掌握理想气体状态方程式和分压定律的应用。
2. 掌握测定摩尔气体常数的一种方法。
二、实验原理
用锌与过量的稀盐酸反应生成H2,在一定温度和压力下,测出生成H2的体积VH2,代入 ,求
,求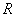 。反应
。反应
Zn(s)+2HCl(aq)=ZnCl2(aq)+H2(g)↑
在一定的温度和压力下,测出放出气体的体积(V)
由于收集中的H2中含有水蒸气,则需查此实验温度下水的饱和蒸气压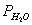 。根据分压定律
。根据分压定律  ,则
,则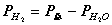
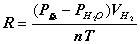
三、仪器、药品和材料
电子天平,气压计,量气管(或50 mL碱式滴定管),水平管,带支管的反应管,夹子,砂纸;纯锌片,HCl(6 mol·L-1)。
…… …… 余下全文
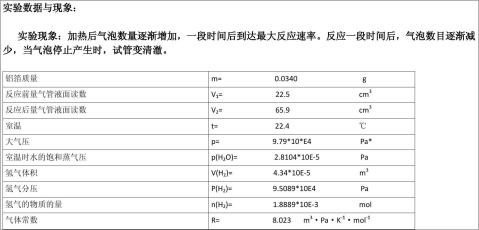
篇七 :置换法测定气体常数
 气体常数R的测定
气体常数R的测定
一、 基本原理
理想气体状态方程PV=nRT表示一定量理想气体的体积与压强的乘积与气体的物质的量和它的绝对温度的积之比R是一个常数,即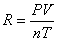 。因此对一定量的气体,若在一定温度、压力条件下测出其体积就可求出R,本实验是测定铝与稀盐酸反应产生的氢气的体积。
。因此对一定量的气体,若在一定温度、压力条件下测出其体积就可求出R,本实验是测定铝与稀盐酸反应产生的氢气的体积。
Mg+H2SO4=MgSO4+H2↑
即将一定重量(w)的镁条与过量的稀硫酸作用,在一定的温度与压力条件下,测出被置换的湿氢气的体积V,而氢气的物质的量可由镁条的重量算出,由于氢气是在水面上收集的,故混有水蒸气,若查出实验温度下所得饱和蒸汽压,就可由分压定律,算出氢气的分压:
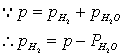
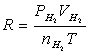
由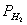 、
、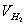 、
、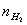 、T等就可利用公式求出R。
、T等就可利用公式求出R。
二、 实验内容
 1. 用砂纸擦去镁条表面氧化膜,取两片35-45mg镁条分别在电子分析天平上准确称量;
1. 用砂纸擦去镁条表面氧化膜,取两片35-45mg镁条分别在电子分析天平上准确称量;
2. 按图右图把仪器装好,打开试管2的塞子由漏斗3往量气管1内装水至略低于刻度“0”装置,上下移动漏斗以赶净胶管和量气管气壁的气泡,然后将试管的塞子塞紧。
3. 检查装置是否漏气;
4. 取下试管,调整漏斗高度,装入3mol/L稀硫酸,将镁条用水浸湿,贴在试管壁上;再检查装置是否漏气。如不漏气,调整漏斗位置,使量气管内水面与漏斗内水面在同一水平面,记下量气管内液面的位置V1;
…… …… 余下全文