置换法测定气体常数
 气体常数R的测定
气体常数R的测定
一、 基本原理
理想气体状态方程PV=nRT表示一定量理想气体的体积与压强的乘积与气体的物质的量和它的绝对温度的积之比R是一个常数,即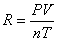 。因此对一定量的气体,若在一定温度、压力条件下测出其体积就可求出R,本实验是测定铝与稀盐酸反应产生的氢气的体积。
。因此对一定量的气体,若在一定温度、压力条件下测出其体积就可求出R,本实验是测定铝与稀盐酸反应产生的氢气的体积。
Mg+H2SO4=MgSO4+H2↑
即将一定重量(w)的镁条与过量的稀硫酸作用,在一定的温度与压力条件下,测出被置换的湿氢气的体积V,而氢气的物质的量可由镁条的重量算出,由于氢气是在水面上收集的,故混有水蒸气,若查出实验温度下所得饱和蒸汽压,就可由分压定律,算出氢气的分压:
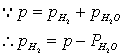
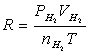
由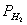 、
、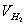 、
、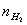 、T等就可利用公式求出R。
、T等就可利用公式求出R。
二、 实验内容
 1. 用砂纸擦去镁条表面氧化膜,取两片35-45mg镁条分别在电子分析天平上准确称量;
1. 用砂纸擦去镁条表面氧化膜,取两片35-45mg镁条分别在电子分析天平上准确称量;
2. 按图右图把仪器装好,打开试管2的塞子由漏斗3往量气管1内装水至略低于刻度“0”装置,上下移动漏斗以赶净胶管和量气管气壁的气泡,然后将试管的塞子塞紧。
3. 检查装置是否漏气;
4. 取下试管,调整漏斗高度,装入3mol/L稀硫酸,将镁条用水浸湿,贴在试管壁上;再检查装置是否漏气。如不漏气,调整漏斗位置,使量气管内水面与漏斗内水面在同一水平面,记下量气管内液面的位置V1;
5. 轻轻振荡试管,使镁条落入稀硫酸中,镁条与稀硫酸反应放出H2,大量的氢气进入量气管中,将管内的水压到漏斗中,为了避免图量气法测定装置管中压力过大而造成漏气,在量气管内水平面下降的同时,慢慢下移漏斗,使两者的水面基本保持相同水平,反应停止后,待试管冷却至室温,移动漏斗,使其水面与量气管水面相平,读出反应后量气管内水面的精确读数V2,1-2分钟,再记录一次液面位置,如二者相差太大,需重复操作,至两次记录数据相差不超过0.01ml。
6. 记录实验时的室温t与大气压P,并从附录中查出室温时水的饱和蒸汽压PH2O
7. 用另一镁条重复上述操作。
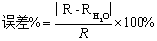 6、怎样除去镁条表面的氧化物与脏物,如何判断已除净?如未除净对实验结果有何影响?
6、怎样除去镁条表面的氧化物与脏物,如何判断已除净?如未除净对实验结果有何影响?
答:将砂纸对折夹住镁条,向一个方向拉,可砂去氧化物与脏物。注意用力要均匀,不要将镁条折断。有时镁条表面不平,凹处脏物难以除去,可将镁条放在木块上,集中擦凹处。
将砂过的镁条对光观察,如表面均呈金属光泽,无黑点,则表示氧化物与脏物已除去。此时用干净的纸夹住镁条,向一个方向拉,除去遗留的脏物。
答:用直接称量法称镁条质量 :
⑴直接在天平盘上放入长镁条50-70mg,称出其质量,记录。
⑵二等分镁条,分别称出小镁条质量,用小称量纸包好,写上镁条质量。将它们放在干燥的50mL小烧杯中备用。
如何安装量气装置?
答:安装的顺序是:先下后上、自左至右,要求各连接部分既紧密吻合,又无张力。整套装置要平正、整齐、正确美观。拆卸仪器的顺序则与安装时正好相反,即先右后左、从上而下,安装次序如下:
⑴.先安装十字夹、自由夹,再安装滴定管夹;
⑵.用橡皮管连接量气管末端(50mL刻度处)、乳胶管连接量气管零分度处(乳胶管、橡皮管需安装到量气管的收缩部分),将量气管夹在滴定管夹的左侧;
⑶.连接橡皮管与筒形漏斗,将筒形漏斗放入自由夹钳口,左手抓住钳口,右手轻缓旋转螺丝使漏斗沿口正好能挂在自由夹钳上。
测定装置的哪些部位易漏气?如装置漏气如何查原因?
⑴漏气部位 :乳胶管,乳胶管分别与量气管、支管(试管)的连接处,试管的管口与塞子塞紧处
⑵逐项检查 :1.乳胶管 将其拉长后对光观察,如有小孔或老化现象则会漏气
②乳胶管与量气管、支管连接处是否紧密。
③试管的平头塞是否塞紧。
16如何调节量气管内的液面略低于“0”刻度,为什么要调节液面?
答:小心将试管夹在滴定管夹的右侧,支管连接乳胶管。左手提漏斗上移,待液面上升至略低于零刻度时,右手拿磨口塞塞进试管口,放漏斗在自由夹内后塞紧塞子,此时量气管的液面符合要求。
20为什么要待试管冷至室温后,才能记录液面位置?如何判断已冷至室温?
答:反应放热,使试管、气体的温度提高,但计算 R 时,气体的温度为室温,所以要冷至室温。
用手摸有液体部分的试管,不感到热时,可读数、记录液面的位置(记住两液面要同一水平),稍等1~2min再读取、记录液面的位置,如两次读数相等或<0.05mL,则可认为已与室温一致。
2 第一份镁条用于测试后,为什么试管中的酸不能用于第二份的测定?
答:用第一份镁条测试时,倾斜试管,酸与镁条接触开始反应,此时试管壁上已有酸。如不倒掉后洗净,则第二份镁条一碰到管壁就会与酸反应,所以试管内的酸不再利用,要倒掉,并用自来水冲洗至无酸
18 在反应前为什么要将漏斗降低,反应时随管内液面下降,漏斗相应移动?
答:避免管内压力过大。若漏斗未下移,漏斗内液面位置高于量气管内液面,管内气体受到的压力大于大气压力。若管内压力过大,H2易泄漏。
计算式 :
R=p(H2)×V(H2)×Ar(Mg) / m(Mg)
6、怎样除去镁条表面的氧化物与脏物,如何判断已除净?如未除净对实验结果有何影响?
答:将砂纸对折夹住镁条,向一个方向拉,可砂去氧化物与脏物。注意用力要均匀,不要将镁条折断。有时镁条表面不平,凹处脏物难以除去,可将镁条放在木块上,集中擦凹处。
将砂过的镁条对光观察,如表面均呈金属光泽,无黑点,则表示氧化物与脏物已除去。此时用干净的纸夹住镁条,向一个方向拉,除去遗留的脏物。
第二篇:测定阿佛加德罗常数和气体常数的其他方法
请查阅文献,找出其它测定阿佛加德罗常数和气体常数的方法,并与本方法进行比较,指出利弊。
完成日期:20##-10-17
作者:李雨书 田雨濛
药学院
一、摘要
测定阿佛加德罗常数的方法有气体运动论法、布朗运动法、电子电荷法、黑体辐射法、α粒子计数法、平差法、单分子膜层法、早期X射线晶体密度法、现代X射线晶体密度法和电解法,最为人熟知的是单分子膜层法(即中学所用的油膜法)、电解法和X射线晶体密度法。本文的前半部分主要介绍单分子膜层法和X射线晶体密度法,比就其主要特点与电解法进行比较。
测定气体常数的方法有置换法和电解法,本文的后半部分将介绍置换法的具体内容,并就其特点与电解法进行对比讨论,得出结论。
二、前言
此次实验中,我们测量了两个在化学计算中使用普遍的两个常量。事实上,这种测定物理、化学常量实验的目的不仅仅是使我们更充分的理解、掌握含有这些常量的公式,它同时让我们体会到这些常量的现实意义。在电解法测量阿佛加德罗常数和气体常数的实验中,使用通过导线的离子数串联起两个常数,在下文中介绍的油膜法、X射线晶体密度法和置换法并没有使用中介,而是独立的测定两个常数,这几种方法与电解法的差别及其存在的意义是这次讨论的主题。
三、内容
1.测定阿佛加德罗常数
1.1气体运动论法
科学家Loschmidt根据气体分子运动论来确定阿伏加德罗常数,由分子本身的体积和分子平均自由程推算出阿伏加德罗常数NA=4.1 ×1022mol-1。从实验结果可以看出,此实验方法精度太低。
1.2布朗运动法
布朗运动表明了液体分子的运动,根据分子的布朗运动,Perrin测定的阿伏加德罗常数为NA=7.05×1023 mol-1。此实验的误差仍旧很大。
1.3电子电荷法
测量电子电荷,可以通过法拉第常数F计算出阿伏加德罗常数为NA= F/e =6.064×1023 mol-1。这个实验方法比较优良。
1.4黑体辐射法
通过黑体辐射可确定波尔兹曼常数k,从波尔兹曼常数k和气体通用常数 R,可获得阿伏加德罗常数为NA=R/k=6.175×1023 mol-1。
1.5α粒子计数法
Rutherford和Geiger对镭源放射α粒子进行计数 ,他们测量出镭元素放射α粒子数的剂量为3.4×1010个/(g·s),对单个原子进行逐个计数提供了确定阿伏加德罗常数的方法,由此导出阿伏加德罗常数为NA=6.1×1023mol-1。
1.6平差法
平差是调查了解物理理论自洽性最好的方法,Birge对不同方法得出的阿伏加德罗常数实验结果进行平差,优化得到阿伏加德罗常数NA=6.054×1023 mol-1。
1.7单分子膜层法(油膜法)
实验原理:
硬脂酸能在水面上扩散而形成单分子层,由滴入硬脂酸刚好形成单分子膜的质量m及单分子膜面积s,每个硬脂酸的截面积A,求出每个硬脂酸分子质量m分子,再由硬脂酸分子的摩尔质量M,即可求得阿伏加德罗常数NA。
实验步骤:
测定从胶头滴管滴出的每滴硬脂酸的苯溶液的体积

取一尖嘴拉得较细的胶头滴管,吸入硬脂酸的苯溶液,往小量筒中滴入 1mL,然后记下它的滴数,并计算出1滴硬脂酸苯溶液的体积V1

测定水槽中水的表面积
用直尺从三个不同方位准确量出水槽的内径,取其平均值

硬脂酸单分子膜的形成
用胶头滴管(如滴管外有溶液,用滤纸擦去)吸取硬脂酸的苯溶液在距水面约5cm处,垂直往水面上滴一滴,待苯全部挥发,硬脂酸全部扩散至看不到油珠时,再滴第二滴。如此逐滴滴下,直到滴下一滴后,硬脂酸溶液不再扩散,而呈透镜状时为止。记下所滴硬脂酸溶液的滴数d
把水槽中水倒掉,用清水将水槽洗刷干净后,注入半槽水,重复以上操作二次。重复操作时,先将滴管内剩余的溶液挤净,吸取新鲜溶液,以免由于滴管口的苯挥发引起溶液浓度的变化,取三次结果的平均值

计算
(1)如称取硬脂酸的质量为m,配成硬脂酸的苯溶液的体积为V,那么每毫升硬脂酸的苯溶液中含硬脂酸的质量为m/V。
(2)测得每滴硬脂酸的苯溶液的体积为V1,形成单分子膜滴入硬脂酸溶液的滴数为(d—1)(注:当最后一滴硬脂酸溶液滴下后,这滴溶液在水面呈透镜状,说这滴溶液没有扩散,即没有参与单分子膜的形成。这时单分子膜已经形成完毕,应停止滴入溶液,所以,在计算形成单分子膜所需硬脂酸溶液的滴数时,应将最后一滴减掉,即滴数计为d—1),那么形成单分子膜需用硬脂酸的质量为:
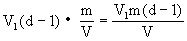
(3)根据水槽直径,计算出水槽中水的表面积S。已知每个硬脂酸分子的截面积A=2.2×10-15cm2,在水面形成的硬脂酸的分子个数为:S/A。
(4)根据(2)和(3)的结果,可计算出每个硬脂酸分子的质量为:
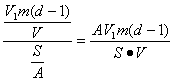
(5)1mol硬脂酸的质量等于284g(即M=284g/mol),所以 1mol硬脂酸中含有硬脂酸的分子个数,即阿伏加德罗常数N为:
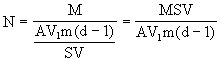
此试验方法的误差较大,与电解法相比,得到的结果精度也较低,为一位或两位精度,而电解法所得结果为三位精度,此种方法操作虽然简单,但结果的准确度太低。
1.8早期X射线晶体密度法
早期用X射线晶体密度法测定阿伏加德罗常数时,是采用静压法测量密度,X射线衍射测量晶格常数。X射线波长是提高准确度的限制因素,之后,材料密度和摩尔质量成为提高测量准确度的限制因素。Bearden先使用方解石做材料,但后来发现方解石密度有很大变化,因此使用Ge和Si等其它材料。当要求测量准确度达到10×10- 6时,材料的化学纯度就成为主要问题。Bearden 测定的阿伏加德罗常数为N A=6.019 ×1023 mol-1。
20世纪70 年代前用 X射线晶体密度法确定的阿伏加德罗常数准确度大约为70×10- 6,这一结果足以显示由密立根导出的电子电荷的误差达0.2 %。X射线晶体密度法测定取得的突破之一是在1974年由R.D.Deslattes采用X射线光学组合干涉仪(COXI )方法取得的。
实验原理:
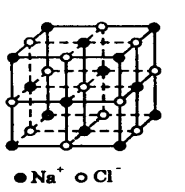 在离子晶体中,阴、阳离子按一定的规律在空间排列。氯化钠晶体就是一种很有规律排列的离子晶体。其中,每个钠离子被6个氯离子包围着,而每个氯离子也被6个钠离子所包围,钠离子和氯离子的个数比例为1∶1。以钠离子为例(或以氯离子为例),其晶格排列如图所示。在单元晶胞中有14 个钠离子,位于立方体顶角的8个钠离子各分属于8个晶胞所共有,每个钠离子对单元晶胞的贡献为18,所以,顶角的8个钠离子相当于8×18=1个“氯化钠分子”;位于立方体面上的6个钠离子各分属于两个晶胞共有,对单元晶胞贡献为12,相当于6×12=3个“氯化钠分子”。单元晶胞可看成是由有1+3=4个“氯化钠分子”组成。由X射线衍射测定氯化钠晶胞边长为5164×10-8cm,则晶胞体积为(5164×10-8cm)3, 氯化钠的摩尔质量为58.45g/mol,密度为 2.165g/cm3,1mol氯化钠的体积为 58.45/2.165cm3。可知阿佛伽德罗常数为:
在离子晶体中,阴、阳离子按一定的规律在空间排列。氯化钠晶体就是一种很有规律排列的离子晶体。其中,每个钠离子被6个氯离子包围着,而每个氯离子也被6个钠离子所包围,钠离子和氯离子的个数比例为1∶1。以钠离子为例(或以氯离子为例),其晶格排列如图所示。在单元晶胞中有14 个钠离子,位于立方体顶角的8个钠离子各分属于8个晶胞所共有,每个钠离子对单元晶胞的贡献为18,所以,顶角的8个钠离子相当于8×18=1个“氯化钠分子”;位于立方体面上的6个钠离子各分属于两个晶胞共有,对单元晶胞贡献为12,相当于6×12=3个“氯化钠分子”。单元晶胞可看成是由有1+3=4个“氯化钠分子”组成。由X射线衍射测定氯化钠晶胞边长为5164×10-8cm,则晶胞体积为(5164×10-8cm)3, 氯化钠的摩尔质量为58.45g/mol,密度为 2.165g/cm3,1mol氯化钠的体积为 58.45/2.165cm3。可知阿佛伽德罗常数为:
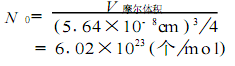
实验步骤:
将固体氯化钠研细、干燥

用分析天平称取5~18g氯化钠,分别装入25ml容量瓶中

用滴定管向容量瓶中滴加苯(用氯化钙除去其中的水份),并不断振荡

使苯与氯化钠晶体充分混匀, 加至刻度,静置1min

计算氯化钠所占体积,套用公式计算N0
单分子膜层法须准确配制溶液,操作较复杂,影响准确度的因素较多,实验结果很不理想。而电解法中需要恒电流装置, 且电解水时产生的气体体积与温度、压力水的饱和蒸气压等有关,数据处理复杂,实验结果也不太理想。X射线晶体密度法测定阿伏伽德罗常数操作方便,所用药品价廉易得,不需特殊仪器,中间步骤大大减少,出错机率降低,实验结果比较精确。
1.9现代X射线晶体密度法(XRCD)
现代X射线晶体密度法主要是指采用完整单晶硅球直接测量硅球的体积,采用COXI方法测量硅的晶格常数,校准气体质谱法准确测定硅原子量,从而确定阿佛加德罗常数NA的方法。测量原理为:测量单晶硅球的摩尔体积Vm与单个硅原子体积Va之比,即

其中:n为单胞中的原子个数;M为单晶硅的摩尔质量;ρ为单晶硅的密度;V为单胞体积。
理论上,只要能准确测量单晶硅的原子量(在数值上等于单晶硅的摩尔质量)、单晶硅球的密度(单晶硅球的体积和质量)和单胞的体积(晶格常数),就能求出阿佛加德罗常数。从技术上来说,采用X射线晶体密度法测定阿佛加德罗常数,首先需要制备完整的单晶硅,并加工成尽可能圆的单晶硅球。然后,对硅球的直径及外表面的氧化层和污染物进行准确测量以确定硅球的体积和密度。准确测定单晶硅的原子量和晶格常数,还必须测定单晶硅的缺陷杂质浓度,并将样品的晶格常数和硅球密度测量结果外推到无杂质、无缺陷的理想单晶硅和22.5℃、0Pa标准条件下的结果。在进行不确定度评定时要考虑单晶硅材料的不均匀性引起的不确定度。
这种高科技的方法显然由于前几种实验方法(包括电解法),即便如此,这种方法仍有缺陷:硅单晶材料的组成成分的比例和结构缺陷对阿佛加德罗常数测量结果有影响。
2.测定气体常数
2.1置换法
实验原理:
在理想气体状态方程式中 pV = nRT
R =pV/(nT) (1)
本实验通过金属镁和稀硫酸反应置换出氢的体积来测定气体常数R的数值。
Mg + H2SO4 === MgSO4 + H2↑
如果准确称取一定质量的镁条m,使之与过量的稀硫酸作用,在一定温度和压力下测出氢气的体积。氢气的分压为实验时大气压减去该温度下水的饱和蒸气压:
p(H2)=p-p(H2O)
氢的物质的量n可由镁条质量求得。
将以上各项数据代入(1)式中,可求得气体常数R的数值:
R=p(H2)V/[m(H2)T]
实验步骤:
镁条处理
取两条重约0.03~0.04g镁条,用砂纸擦掉表面氧化膜,用水漂洗干净,再用乙醇漂洗,晾干

称量镁条
用分析天平或电子天平准确称出两份已经擦掉表面氧化膜的镁条,每份重约0.03g左右为宜

检查系统
按图将反应装置连接好,先不接反应管,从漏斗加水,使量气管、胶管充满水,量气管水位略低于“0”刻度。上下移动漏斗,以赶尽附在量气管和胶管内壁的汽泡。然后,接上反应管检查系统的气密性:将漏斗向上或向下移动一段距离后停下,若开始时漏斗水面有变化而后维持不变,说明系统不漏气。如果漏斗内的水面一直在变化,说明与外界相通,系统漏气,应检查接口是否严密,直至不漏气为止
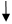
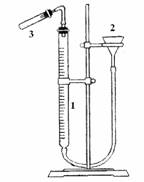
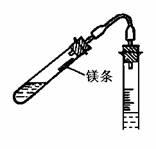
测量氢气体积
从装置取下试管,调整漏斗的高度,使量气管中水面略低于“0”刻度。用量筒取3mol/L的H2SO4约3mL,倒入试管中。将镁条沾少量水后贴在没沾酸的试管内壁的上部,将试管安装好。塞紧塞子后再检查一次系统,确保不漏气
移动漏斗使漏斗中液面和量气管液面在同一水平面位置,记录液面位置。左手将试管底部略微抬高,使镁条进入酸中。右手拿着漏斗随同量气管水面下降,保持量气管中水面与漏斗中水面在同一水平面位置,量气管受的压力和外界大气压相同

反应结束,保持漏斗液面和量气管液面处在同一水平面上。过一段时间记下量气管液面高度,过一段时间再读一次,如果两次读数相同,表明管内温度与室温相同。记下室温和大气压数据
此种方法与电解法运用的核心公式是一样的,只不过电解法使用的是电解池产生O2,而此试验使用置换反应产生H2,实验步骤也相对较少,能够产生误差的步骤也较少,但是,在这个实验中装有Mg片的试管内在实验前就已经含有一定量的空气,此处对H2产生会造成较大误差,究竟那种实验得出的结果准确度更高呢?经讨论,我们认为,电解法和置换法操作均规范,其使用仪器精度无差别时,电解法的准确度更高,考虑到仪器精度有差别时,电解法仍优于置换法。
四、结论
从以前测量阿伏加德罗常数活动可以看出 ,准确测量阿伏加德罗常数利用了原子分子的多种特性和当时测量的最新技术,测量过程增进了人们对物质世界的理解,加快了新测量技术的发展。比较同一个基本物理常数的不同实验方法,还可以了解考察基础理论的自洽性。通过阿伏加德罗常数可以直接将宏观物理量和微观物理量联系起来。
在三种测量阿佛加德罗常数的实验室主流方法:单分子膜层法、电解法和X射线晶体密度法中,X射线晶体密度法是得到结果准确度最高的方法,其使用了高科技仪器,实验步骤少,避免很多可能产生误差的步骤,准确度排在第二位的是电解法,因实验步骤较多,容易出错,但是其系统精度较高,即使用仪器相对精密,而准确度最低的单分子膜层法虽然步骤少,但是其使用的仪器精度低,限制了实验结果的准确度,因此排在最末。
比较置换法与电解法测气体常数,电解法更优,除了实验仪器比置换法精密外,其测量气体体积的准确度较置换法高,置换法的实验体系内固有的空气会给VH2造成很大干扰,这是无法通过更换仪器而改变的,是实验设计本身的缺陷,而电解法并名有这种致命的缺陷,相较而言,电解法所得数据更准确。
五、参考文献
阿伏加德罗常数测定的新进展,易洪,计量学报[J].Vol. 28.No.4,394-399,October, 2007
气体常数的测定(实验报告一份),佚名
阿伏伽德罗常数的测定,张八合,中学化学教学参考[J].1998年第7期,36
阿伏加德罗常数的测定与原理,佚名
六、小组分工表

-
幼儿园教育教学总结(20xx.6)
幼儿园教育教学总结(20xx.6月)这学期我园教研工作主要从每位教师的实际出发,坚持以教育科研和教学改革实验为主要形式、渠道、方法…
-
行政文员工作总结
20xx年工作总结时光荏苒,20xx年即将过去,回首过去的一年,内心不禁感慨万千……时间如梭,转眼间又将跨过一个年度之坎。回首望,…
-
关于撰写20xx年度述职报告和个人总结的通知
公司各部门:20xx年是西安公司快速发展、规范发展的一年。为认真总结20xx年各项工作取得的成绩,查找存在的问题和不足,明确20x…
-
20xx年个人工作总结
计财朱宁处个人总结我自20xx年x月第三轮竞聘担任计财处会计科科长,并由学院领导指定为部门联络负责人至今已有一年的时间。这此期间,…
-
幼儿园中班主任工作总结
幼儿园小班班主任工作总结在忙忙碌碌中我们的学期也接近尾声,回顾这一学期自己的工作,真是又喜又忧.。幼儿教师的职业是琐碎的,细小的,…