萃取实验报告
北 方 民 族 大 学
学生实验报告
院(部): 化学与化学工程
姓 名: 郭俊雄 学 号: 20082995 专 业: 化学工程与工艺 班 级: 081 同组人员: 林艺明、 胡鹏、 秦开勉 课程名称: 化工原理实验 实验名称: 萃取实验 实验日期: 2010.11.11 批阅日期: 成 绩: 教师签名:
北方民族大学教务处制
实验名称:萃取实验
一、实验目的
1.了解转盘萃取塔的结构和特点;
2.掌握液—液萃取塔的操作;
3.掌握传质单元高度的测定方法,并分析外加能量对液液萃取塔传质单元高度和通量
的影响。
二、基本原理
萃取是利用原料液中各组分在两个液相中的溶解度不同而使原料液混合物得以分离。将一定量萃取剂加入原料液中,然后加以搅拌使原料液与萃取剂充分混合,溶质通过相界面由原料液向萃取剂中扩散,所以萃取操作与精馏、吸收等过程一样,也属于两相间的传质过程。
与精馏,吸收过程类似,由于过程的复杂性,萃取过程也被分解为理论级和级效率;或传质单元数和传质单元高度,对于转盘塔,振动塔这类微分接触的萃取塔,一般采用传质单元数和传质单元高度来处理。传质单元数表示过程分离难易的程度。
对于稀溶液,传质单元数可近似用下式表示:
NOR??x1dxx?x*x2 (1)
式中: NOR——萃余相为基准的总传质单元数;
X——萃余相中的溶质的浓度,以摩尔分率表示;
x*——与相应萃取浓度成平衡的萃余相中溶质的浓度,以摩尔分率表示。
x1、x2——分别表示两相进塔和出塔的萃余相浓度
传质单元高度表示设备传质性能的好坏,可由下式表示:
HOR?HNOR
L
HOR? (2) Kxa? (3)
式中: HOR——以萃余相为基准的传质单元高度,m;
H—— 萃取塔的有效接触高度,m;
Kxa——萃余相为基准的总传质系数,kg/(m3?h?△x);
L——萃余相的质量流量,kg/h;
2?——塔的截面积,m;
已知塔高度H和传质单元数NOR可由上式取得HOR的数值。HOR反映萃取设备传质性能的好坏,HOR越大,设备效率越低。影响萃取设备传质性能HOR的因素很多,主要有设备结构因素,两相物质性因素,操作因素以及外加能量的形式和大小。
三、实验内容
以水萃取煤油中的苯甲酸为萃取物系
1.以煤油为分散相,水为连续相,进行萃取过程的操作;
2.测定不同流量下的萃取效率(传质单元高度);
3. 测定不同转速下的萃取效率(传质单元高度)
四、装置说明与操作
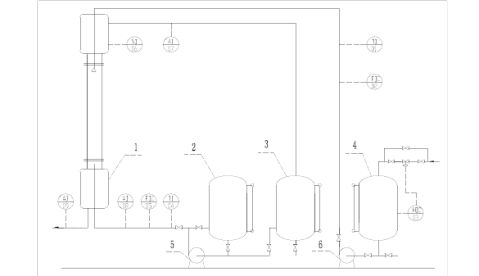
1、萃取塔 2、轻相料液罐 3、轻相采出罐 4、水相贮罐 5、轻相泵 6、水泵
转盘萃取塔流程
1、流程说明:
本实验以水为萃取剂,从煤油中萃取苯甲酸。煤油相为分散相,从塔底进,向上流动从塔顶出。水为连续相从塔顶入向下流动至塔底经液位调节罐出。水相和油相中的苯甲酸的浓度由滴定的方法确定。由于水与煤油是完全不互溶的,而且苯甲酸在两相中的浓度都非常低,可以近似认为萃取过程中两相的体积流量保持恒定。
2、要设备技术参数:
(1)塔径:50mm 塔高:750mm 有效高度:600mm,
转盘数:16 转盘间距:35mm 转盘直径:34 mm,
固定环内径:36mm
(2)水泵、油泵
(3)转子流量计
(4)转盘调速器
3、操作步骤:
(1) 在水原料罐中注入适量的水,在油相原料罐中放入配好浓度(如0.002 kg苯甲酸/kg煤油)的煤油溶液。
(2) 全开水转子流量计,将连续相水送入塔内,当塔内液面升至重相入口和轻相出口中点附近时,将水流量调至某一指定值(如4 L/h),并缓慢调节液面调节罐使液面保持稳定。
(3)将转盘速度旋钮调至零位,然后缓慢调节转速至设定值。
(4)将油相流量调至设定值(如6 L/h)送入塔内,注意并及时调整罐使液面保持稳定的保持在相入口和轻相出口中点附近。
(5)操作稳定半小时后,用锥形瓶收集油相进出口样品各40 mL左右,水相出口样品50 mL左右分析浓度。用移液管分别取煤油溶液10 mL, 水溶液 25 mL,以酚酞为指示剂,
用0.01 mol/L的NaOH标准溶液滴定样品中苯甲酸的含量。滴定时,需加入数滴非离子表面活性剂的稀溶液并激烈摇动至滴定终点。
(6)取样后,可改变两相流量或转盘转速,进行下一个实验点的测定。
注意事项:
(1) 在操作过程中,要绝对避免塔顶的两相界面在轻相出口以上。因为这样会导致水相混入油相储槽。
(2) 由于分散相和连续相在塔顶、底滞留很大,改变操作条件后,稳定时间一定要足够长,大约要用半小时,否则误差极大。
(3) 煤油的实际体积流量并不等于流量计的读数。需用煤油的实际流量数值时,必须用流量修正公式对流量计的读数进行修正后方可使用。
五、数据处理
原始数据记录如下:
萃取过程相关数据记录表
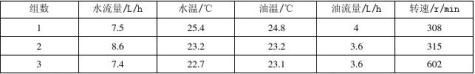
滴定过程相关数据记录表

以第一组数据进行相关计算如下: 由 nC6H5COOH?nNaOH?M
NaOH
?VNaOH 得:
?3
进口煤油 n2?0.01?13.70?10出口煤油n1?0.01?9.50?10
?3
mol?13.7?10
?5
?5
mol
mol?9.5?10mol
?3?5
出口水ne?0.01?6.30?10mol?6.3?10mol
X2?
n1?M
A
A
?油V2?n1?M
-3
?
13.7?10
800?10?10
?3
?5
?122
?5
?13.7?10?122
=2.09×10kg苯甲酸/kg煤油 X1?
9.5?10
800?10?10
-3
?5
?122
?5
?3
?9.5?10?122
=1.45×10kg苯甲酸/kg煤油 Xe?
ne?M
A
A
?水V2?ne?M
-4
?
6.3?10
1000?25?10
?3
?5
?122
?5
?6.3?10?122
=3.08×10kg苯甲酸/kg水 ?Xm?
(X2?Xe)?(X1?Xe)
代入数据可得?Xm=1.44×10-3
X?Xeln(2)
X1?Xe
已知水流量L?7.5L/h?7.5kg/h
填料体积:Vp=3.14×0.052×0.6/4=1.18×10-3 m3
?23.142?32
?0.05?1.9625?10m 萃取塔横截面积:??d?
4
4
GA=L(x2-x1)=7.5×(2.09×10-1.45×10)=4.82×10由Kxa?
GAVP??Xm
-3-3-3
可得:
?3
4.82?10
=2.84×103 Kxa?
?3?3
1.18?10?1.44?10
传质单元高度HOR=
LKXa?
=
4
2.84?10?1.96?10
3
?3
=0.72m
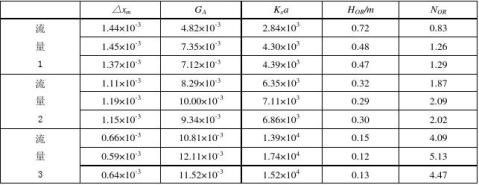
相关计算结果如下列表格:
相关计算结果表1

六、实验结论及误差分析
实验结果分析:
由计算结果表2可看出,增加水流量、降低煤油流量或者增大转速这一条件后,塔顶轻相的苯甲酸浓度明显减小,塔底重相的苯甲酸浓度明显增大,传质单元数NOR明显增加,则在相等的萃取段有效高度内,其传质单元高度HOR减低,体积总传质速率Kxa明显增大。
因此,在填料萃取塔的萃取过程中,其他条件不变的情况下,增加水流量、降低煤油流量或者增大转速可显著提高它的分离萃取能力。
误差分析:
本实验误差较大,主要原因如下:
1. 滴定过程中,操作时或多或少有一定误差,读数时随意性造成的误差。 2. 移去试液数据的不稳定性造成的误差。 3. 实验仪器等本身具有的系统误差。
七、思考题
1、萃取的目的是什么?原理是什么?
答:利用化合物在两种互不相溶的溶剂中溶解度或分配系数的不同,使化合物容一种溶剂中转移到另一种溶剂中。经过多次反复萃取,将绝大多数化合物提取出来。
2、萃取溶剂的必要条件是什么?
答:与物料中的B组分不完全互溶;对A组分具有选择性的溶解度
3、萃取设备按两相的接触方式分类可分成哪几类?各有何特点?转盘萃取塔属于哪一类?
答:萃取设备的分类属两相接触方式,可分为逐级接触式和微分接触式两类;转盘萃取塔属于微分接触式。
第二篇:碘水中碘的萃取实验报告
碘水中碘的萃取
一、实验目的:
① 体验从碘水中提取碘单质,树立实验环保意识。
② 认识各种仪器,熟悉和掌握分液漏斗的操作。
③ 验证萃取的原理。
二、实验原理:
利用溶解度的不同,用一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来。
三、仪器及用品:
量筒、烧杯、分液漏斗、铁架台(带铁圈)。
试剂:碘的饱和溶液,四氯化碳(或煤油)
四、操作步骤:
1、检漏
关闭分液漏斗的活塞,打开上口的玻璃塞,往分液漏斗中注入适量水,盖紧上口玻璃塞。把分液漏斗垂直放置,观察活塞周围是否漏水。再用右手压住分液漏斗上口玻璃塞部分,左手握住活塞部分,把分液漏斗倒转,观察上口玻璃塞是否漏水,用左手转动活塞,看是否灵活。
2、装液
用量筒量取5 mL碘的饱和水溶液,倒入分液漏斗,然后再注入2 mL四氯化碳(CCl4),盖好玻璃塞。
3、振荡
用右手压住分液漏斗口部,左手握住活塞部分,把分液漏斗倒转过来振荡,使两种液体充分接触; 振荡后打开活塞,使漏斗内气体放出。
4、静置分层
将分液漏斗放在铁架台上,静置待液体分层。
5、分液(取下层溶液)
将分液漏斗颈上的玻璃塞打开(或使塞上的凹槽对准漏斗上的小孔),再将分液漏斗下面的活塞拧开,使下层液体慢慢延烧杯壁流下。
6、分液(取上层溶液)
待下层液体全部流尽时,迅速关闭活塞。烧杯中的碘的四氯化碳溶液回收到指定容器中,分液漏斗内上层液体由分液漏斗上口倒出。
7、回收
将碘的四氯化碳溶液倒入2到指定的容器中。
8、清洗仪器,整理实验桌。
五、现象和结论:
现象:
1、碘的饱和水溶液倒入分液漏斗中再注入四氯化碳可以观察到:溶液分层,上层黄色,下层无色透明、油状。
2、振荡时有少量气泡。
静置分层溶液分层,上层无色(或黄色变浅),下层紫红色。 结论:四氯化碳(CCl4)能萃取碘水中的碘。
-
萃取实验报告
实验名称萃取实验一实验目的了解转盘萃取塔的结构和特点掌握液液萃取塔的操作掌握传质单元高度的测定方法并分析外加能量对液液萃取塔传质单…
-
萃取和分液实验报告
萃取和分液实验报告一实验目的1了解萃取分液的基本原理2熟练掌握分液漏斗的选择及各项操作二实验原理利用某溶质在互不相溶的溶剂中的溶解…
- 液液萃取实验报告
-
萃取实验报告
实验名称萃取实验一实验目的了解转盘萃取塔的结构和特点掌握液液萃取塔的操作掌握传质单元高度的测定方法并分析外加能量对液液萃取塔传质单…
-
蒸馏、萃取实验报告单
实验报告单姓名班级一实验室制取蒸馏水1蒸馏是利用物质的不同加热使液体混合物中的液体变为气体挥发出来再冷凝为液体除去难挥发或不挥发杂…
-
脉冲塔萃取实验报告
专业姓名实验报告学号日期地点课程名称过程工程原理实验指导老师成绩实验名称脉冲塔萃取实验实验类型同组学生姓名一实验目的和要求必填三主…
-
转盘塔萃取操作及体积传质系数测定实验报告
课程名称:过程工程原理实验指导老师:成绩:_________________实验名称:转盘塔萃取实验实验类型同组学生姓名:_一、实…
-
实验报告:脉冲塔萃取
实验报告课程名称过程工程控制甲实验同组实验者指导老师成绩实验名称脉冲塔萃取操作及体积传质系数测定一实验目的和要求1了解脉冲萃取实验…
-
脉冲塔萃取实验报告
课程名称:过程工程原理实验指导老师:成绩:_______________实验名称:脉冲塔萃取实验实验类型同组学生姓名:一、实验目的…