水溶液中的离子平衡测试题及答案
第三章 水溶液中的离子平衡 测试题
一、选择题
1.将纯水加热至较高温度,下列叙述正确的是( )
A.水的离子积变大、pH变小、呈酸性 B.水的离了积不变、pH不变、呈中性
C.水的离子积变小、pH变大、呈碱性 D.水的离子积变大、pH变小、呈中性
2.下列有关“电离平衡”的叙述中正确的是( )
A.电解质在溶液里达到电离平衡时,分子的浓度和离子的浓度相等
B.电离平衡时,由于分子和离子的浓度不断发生变化,所以说电离平衡是动态平衡
C.电离平衡是相对的、暂时的,外界条件改变时,平衡就会发生移动
D.电解质达到电离平衡后,各种离子的浓度相等
3.下列关系一定正确的是( )
A.当溶液中c(H+)>10-7 mol«L-1时,其pH<7,溶液呈现酸性
B.当溶液中c(H+)>10-7 mol«L-1时,其pH>7,溶液呈现碱性
C.当溶液中c(H+)=c(OH-)>10-7 mol«L-1时,其pH<7,溶液呈现中性
D.当溶液中c(H+)=c(OH-)>10-7 mol«L-1时,其pH<7,溶液呈现酸性
4.从植物花朵中提取到一种色素,它实际上是一种有机弱酸,可用HR表示,HR在盐酸溶液中呈现红色,HR在NaOH溶液中呈现蓝色,将HR加入浓硝酸中呈现红色,微热后溶液的红色褪去,根据以上现象,可推测( )
A.HR应为红色 B.HR应为蓝色 C.R-应为无色 D.R- 应为红色
5.在稀氨水溶液中存在如下平衡体系:NH3·H2O NH4++OH-,当增大溶液的pH时,c(NH4+)会( )
NH4++OH-,当增大溶液的pH时,c(NH4+)会( )
A.可能增大也可能减小 B.增大 C.减小 D.无变化
6.将pH=1的盐酸平均分为2份,1份加适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高1,则加入的水与NaOH溶液的体积比为( )
A.9 B.10 C.11 D.12
7.有一种含氨和氯化铵物质的量相等的混合溶液,其pH为9.3,下列说法中错误的是( )
A.氨水的电离作用大于氯化铵的水解作用 B.氯化铵的水解作用大于氨水的电离作用
C.氨水的存在抑制了氯化铵的水解 D.氯化铵的存在抑制了氨水的电离
8.将0.lmol?L-1醋酸溶液加水稀释,下列说法正确的是( )
A.溶液中c(H+)和c(OH-)都减小 B.溶液中c(H+)增大
C.醋酸电离平衡向左移动 D.溶液的pH增大
9.室温下,某溶液中由水电离出的c(OH-)=10-5 mol·L-1,则其溶质可能是( )
A.CH3COOH B.H2SO4 C.NaOH D.Na2CO3
10.pH=3的醋酸溶液加水冲稀到原溶液体积的3倍,则稀释后的pH为( )
A.3.2 B.3.5 C.3.7 D.4
11.已知,往0.1mol?L-1的氨水中滴入酚酞试液时,溶液将呈现粉红色。现采取下列措施,滴有酚酞的氨水溶液颜色不会变浅的是( )
A.往溶液中滴入稀硫酸 B.往溶液中加入NH4Cl
C.把溶液加热至沸腾 D.往溶液中加入NaOH
12.用蒸馏水湿润过的pH试纸测得某氨基酸溶液的pH等于8,则该氨基酸溶液的pH可能是( )
A.9 B.8 C.7 D.6
13.下列关于电解质溶液的叙述正确的是( )
A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为
c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液为pH大
14.室温时,将xmL,pH=a的稀NaOH溶液与ymL pH=b的稀盐酸充分反应。下列关于反应溶液pH的判断,正确的是( )
A.若x=y,且a+b=14,则pH>7 B.若10x=y,且a+b=13,则pH=7
C.若ax=by,且a+b=13,则pH=7 D.若x=10y,且a+b=14,则pH>7
15.若溶液中由水电离产生的c(OH-)=1×10-14 mol?L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
A.Al3+、Na+、NO3-、Cl- B.K+、Na+、Cl-、NO3-
C.K+、Na+、Cl-、AlO2- D.K+、NH4+、SO42-、NO3-
16.某酸HX稀溶液和某碱YOH稀溶液的物质的量浓度相等,两溶液混合后,溶液的pH大于7。下表中判断合理的是( )

A.①③ B.②③ C.①④ D.②④
17.某一元弱酸HA的相对分子质量为M。在t℃时,将ag HA完全溶解于水,得V mL饱和溶液,测得该溶液的密度为ρg/cm3,其中n(A-)为b mol。下列叙述中,错误的是( )
A.溶液中c(H+)=[1000b+c(OH-)V]/V mol?L-1
B.物质的量浓度c(HA)=1000a/MV mol?L-1
C.t℃时,HA的溶解度S=100a/ρV g
D.HA的质量分数ω(HA)=(a/ρV)×100%
18.pH=2的A、B两种酸溶液各1mL,分别加水稀释到1L(其pH与溶液体积V的关系如右图)。下列说法正确的是( )
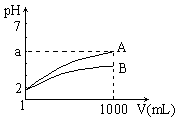 ①a=5时,A是强酸,B是弱酸 ②若A、B都是弱酸,则5>a>2 ③稀释后,A酸溶液的酸性比B酸溶液的酸性强 ④A、B两种酸溶液的物质的量浓度一定相等
①a=5时,A是强酸,B是弱酸 ②若A、B都是弱酸,则5>a>2 ③稀释后,A酸溶液的酸性比B酸溶液的酸性强 ④A、B两种酸溶液的物质的量浓度一定相等
A.①② B.③④
C.①③ D.②④
二、填空题
1.某兴趣小组作图示实验探究分子的运动,请回答实验中的有关问题:
(1)实验Ⅰ:在盛有少量蒸馏水的烧杯中滴入2-3滴酚酞试液,再滴加浓氨水,由实验得出的结论是什么?
(2)实验Ⅱ(如图所示),写出烧杯B中所发生的现象。产生这一现象的原因是什么?
如图所示: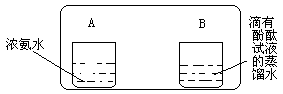
2.只从下列试剂中选择实验所需的试剂和仪器,鉴别0.1mol?L-1的H2SO4和0.2mol?L-1H2SO4溶液。简述其操作过程。
试剂:紫色石蕊试液、酚酞试液、甲基橙试液、蒸馏水、BaCl2溶液、pH试纸、0.1mol?L-1 Na2S2O3溶液
仪器:玻璃棒、表面皿、试管、量筒、胶头滴管
3.双氧水(H2O2)和水都是极弱的电解质。
(1)若把H2O2看成是二元弱酸,请写出它在水中的电离方程式 。
(2)鉴于H2O2显弱酸性,它能同强碱作用形成正盐,在一定条件下也可形成酸式盐,请写出H2O2与Ba(OH)2作用形成正盐的化学方程式: 。
(3)水电离生成H3O+和OH-叫做水的自偶电离。双氧水同水一样,也有极微弱的自偶电离,其自偶电离的方程式为 。
(4)除了过氧化氢跟碱的反应外,请你再写出一个可表明双氧水是弱酸的反应的化学方程式 。
4.(1)已知高碘酸钠(NaIO4)溶液呈碱性,0.01mol?L-1的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=12的NaOH溶液等体积混合,所得混合液显中性。高碘酸和硫酸锰(MnSO4)在溶液中反应生成高锰酸、碘酸和硫酸,此反应的氧化剂是 ,反应的离子方程式_________________________________________________。
(2)常温下,设某H2SO4中由水电离出的c(H+)=1.0×10-a mol?L-1,与该H2SO4的pH相同的Al2(SO4)3中由水电离出的c(H+)=1.0×10-bmol?L-1(a、b都是小于14的正数),那么a和b之间满足的数量关系是(用一个等式和一个不等式表示) , 。
5.有pH=12的NaOH溶液100mL。如果将其pH降为11,那么:
(1)若用蒸馏水应加入______________mL
(2)若用pH=10的NaOH溶液应加入_____________mL
(3)若用pH=2的盐酸溶液应加入_____________mL
(4)若用0.01mol?L-1的醋酸应加入的范围是________________。
6.酸HX和碱AOH恰好完全中和时溶液的pH等于7,酸HY和碱BOH恰好完全中和时溶液的pH也等于7,酸HX和碱BOH恰好完全中和时溶液的pH小于7,请推断
(1)以上酸碱中必为弱电解质的是
(2)比较两种酸HX和HY的酸性强弱 > 。
7.某学生欲用已知物质的量浓度的盐酸测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的氢氧化钠溶液时,左手把握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视 。直到因加入一滴盐酸,溶液的颜色由 色变为 ,半分钟不褪色,立即停止滴定。
(2)下列操作中可能使所测氢氧化钠溶液的浓度数值偏低的是 (填序号)。
A.酸式滴定管未用标准盐酸溶液润洗就直接注入标准盐酸
B.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
E.滴定过程中,锥形瓶的振荡过于激烈,使少量溶液溅出
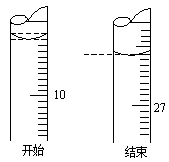
(3)若滴定开始和结束时,酸式滴定管中的液面如上图所示:则起始读数为 mL,终点读数为 mL。
8.用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.2 g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在 (填编号字母)上称量
(A)小烧杯 (B)洁净纸片 (C)直接放在托盘上
(2)滴定时,用0.2000mol·L-1的盐酸来滴定待测溶液,不可选用 (填编号字母)作指示剂。
(A)甲基橙 (B)石蕊 (C)酚酞 (D)甲基红
(3)滴定过程中,眼睛应注视 ;在铁架台上垫一张白纸,其目的是 。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是 mol·L-1,烧碱样品的纯度是 。

(5)下列实验操作会对滴定结果产生的后果。(填“偏高”、“偏低”或“无影响”)
①观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果 。
②若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果 。
三、填空题
1.250 mL pH=12的某一元强碱(MOH)溶液与250 mL 0.025 mol·L-1 的硫酸溶液相混合, 假设混合后液体体积为500 mL。试求:
(1)混合液的pH;
(2)若原250 mL一元强碱中含溶质0.1 g, 则M的相对原子质量为多少?
(3)若给混合液中分别滴入几滴甲基橙、无色酚酞、紫色石蕊试液,则溶液的颜色分别是什么?
2.25℃时某浓度的氨水和硫酸铵混合溶液的c(H+)=5×10-8mol?L-1,取100mL该溶液与足量的浓NaOH溶液共热,可得NH3为560mL(标准状况),再向反应后溶液中加入足量的 BaCl2溶液 ,可得BaSO42.796g。求:
(1)原混合溶液中NH3?H2O电离出的c(OH-)浓度。
(2)混合溶液中NH3?H2O的物质的量浓度。
第三章 水溶液中的离子平衡测试参考答案
一、选择题:
1.D 2.C 3.C 4.A 5.A 6.C 7.B 8.D 9.D 10.A 11.D 12.A 13.D 14.D 15.B 16.D 17.C 18.A
二、填空题:
1.(1)酚酞试液遇蒸馏水不变色;遇浓氨水变红色;(2)酚酞试液变红;氨分子从A烧杯扩散到B烧杯中,溶于水使酚酞试液变红。
2.用量筒量取5mL的0.1mol?L-1Na2S2O3溶液分别注入两支试管中,再用量筒分别量取5mL两种待鉴硫酸溶液,同时分别倒入装有硫代硫酸钠溶液的试管中,观察现象。先变浑浊的为0.2mol?L-1 H2SO4 。
注意不能选用pH试纸、甲基橙试液、紫色石蕊试液等来鉴别。当两种溶液的pH相差较大(1个单位以上)时才能用pH试纸测定区分出来,题中两种硫酸溶液,浓度太接近无法用pH试纸加以区分。
3.(1) H2O2 HO2-+H+ HO2-
HO2-+H+ HO2- O22-+H+
O22-+H+
(2)H2O2 +Ba(OH)2====BaO2+2H2O
(3)H2O2 +H2O2 H3O2++HO2-
H3O2++HO2-
(4)Na2O2+2HCl====H2O2+2NaCl(相当于弱酸强碱盐的水解反应)。
4.(1)高碘酸 5HIO4 + 2 Mn2+ + 3H2O =2MnO4― + 5IO3- + 11H+ (2)a+b=14 a>b
5.稀氢氧化钠溶液的密度跟水的密度很接近,所以往其中加入水时溶液的体积可看作是相加。
(1)要使溶液的pH从12降为11,OH-离子浓度下降到原来的十分之一,体积应增大到原来的10倍。所以应加入900mL水。
(2)设需pH=10的氢氧化钠溶液xmL,则有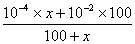 =10-11,计算可得x=1000mL。
=10-11,计算可得x=1000mL。
(3)设需pH=2的盐酸xmL,则有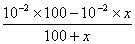 =10-11,计算可得x=81.8mL。
=10-11,计算可得x=81.8mL。
(4)加入醋酸时,生成醋酸钠溶液水解,可使溶液的pH偏高,所以加入醋酸的体积应比同浓度的盐酸略大一些,但由于醋酸钠溶液的pH只有8左右,所以不能将氢氧化钠全部中和。由于使100mLpH=12NaOH溶液完全中和,需100mL0.01mol?L-1醋酸,要使100mLpH=12NaOH溶液变为pH=11需0.01mol?L-1HCl 81.8mL,所以需加入0.01mol?L-1的醋酸应加入的范围是81.8mL<V<100mL。
6.(1)BOH、HY (2)HX、HY
提示:强酸跟强碱完全中和时溶液的pH等于7,弱酸跟弱碱完全中和时所得溶液的pH也可能等于7。从“酸HX和碱BOH恰好完全中和时溶液的pH小于7”可判断BOH必定是弱碱,所以HY必定是弱酸。HX的酸性必定比HY的酸性强。
7.(1)锥形瓶内溶液颜色的变化;红;无 (2)DE (3)9.00;26.10
提示:以酚酞作指示剂用盐酸滴定待测的氢氧化钠溶液达终点时,溶液颜色从“红”变成“无色”。读数时要注意滴定管的刻度是从上到下,从“0”开始依次增大的,读数的准确度要达到0.01mL。
提示:强酸跟强碱完全中和时溶液的pH等于7,弱酸跟弱碱完全中和时所得溶液的pH也可能等于7。从“酸HX和碱BOH恰好完全中和时溶液的pH小于7”可判断BOH必定是弱碱,所以HY必定是弱酸。HX的酸性必定比HY的酸性强。
8.(1)A (2)B (3)锥形瓶内溶液颜色的变化;便于观察锥形瓶内液体颜色的变化,减小滴定误差 (4)0.4000 mol·L-1 97.56 %(5)①偏高 ②偏高。
三、解答题:
1(1)pH=1.7;(2)Mr=23;(3)变红色、变无色、变红色。 (pH=12的一元强碱溶液中,c(OH-)=0.01mol·L-1,跟c(H+)=0.05mol·L-1稀硫酸混合后,溶液中c(H+)=0.02mol·L-1,所以混合溶液的pH=1.7。)
2.(1) 溶液中的c(OH–) = 1×10-14/5×10-8 = 2×10-7mol?L-1
由NH3?H2O电离出的c(OH -)= 2×10-7mol?L-1–5×10-8mol?L-1=1.5×10-7mol?L-1
(2)共产生的n(NH3 )=0.560mol/22.4mol?L-1 =0.0250mol
n[(NH4)2SO4]= 2.796g/233g?mol-1 = 0.0120mol
n(NH3?H2O) = 0.0250mol –2×0.0120mol = 0.00100mol
c(NH3?H2O) = 0.00100mol /0.100L = 0.0100mol?L-1
第二篇:第三章水溶液中的离子平衡测试题
第三章《水溶液中的离子平衡》测试题
说明:本试卷满分100分,考试时间50分钟。
一、选择题(每小题4分,每小题只有1.个.选项符合题意,共56分。)
1.下列说法正确的是( )
A、SO2溶于水所得溶液能导电,故二氧化硫属于电解质
B、硫酸钡难溶于水,但硫酸钡属于强电解质
C、醋酸溶液中只含有H+和CH3COO-
D、Cu能导电,所以铜是电解质
2.某学生的实验报告所列出的下列数据中合理的是
A、用10mL量筒量取7.13mL稀盐酸
B、用托盘天平称量25.20g NaCl
C、用广泛pH试纸测得某溶液的pH为2.3
D、用25mL滴定管做中和滴定时,用去某浓度的碱溶液21.70mL
3. 下列溶液中导电性最强的是( )
A、1L01.molL醋酸 B、01.L01.molLH2SO4溶液
C、05.L01.molL盐酸 D、2L0.1LH3PO4溶液
4.下列溶液一定呈中性的是( )
A、pH=7的溶液 B、c(H+)=c(OH-)=10-6mol/L溶液
C、使石蕊试液呈紫色的溶液 D、酸与碱恰好完全反应生成正盐的溶液
5.下列方程式书写正确的是( )
A、HCO--
3在水溶液中的电离方程式:HCO3+H2OH+2-
3O+CO3
B、H+2-
2SO3的电离方程式H2SO32H+SO3
C、CO2-CO2-
3+2H2OH2CO-
3的水解方程式:3+2OH
D、CaCO2+2-
3的溶解平衡方程式:CaCO3=Ca+CO3
6. 已知25℃,Kw =1.0×10-14 ;100℃,Kw =1.0×10-12,则下列说法正确的是(
A、室温下,CHCOONa溶液中Kw >1.0×10-14
3
1 )
B、温度升高时,Kw增大
C、室温下,0.1mol/L NaOH溶液中,由水电离出的C(H+) = 0.1mol/L
D、PH = 7的溶液一定为中性
7.下列事实一定能说明HF是弱酸的是( )
①常温下NaF溶液的pH大于7; ②用HF溶液做导电性实验,灯泡很暗; ③HF与NaCl不能发生反应; ④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体 ⑥HF与水能以任意比混溶
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
A、①②⑦ B、②③⑤ C、③④⑥ D、①④
8.向5mLNaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡沉淀变为黄色,再滴入一滴Na2S溶液并振荡沉淀变为黑色。则三种沉淀的溶解度关系为( )
A、AgCl=AgI=Ag2S B、AgCl>AgI>Ag2S
C、AgCl<AgI<Ag2S D、AgI>AgCl>Ag2S
9.用标准的盐酸滴定未知浓度的NaOH溶液时,下列各操作中,无误差的是( )
A、用蒸馏水洗净酸式滴定管后,注入标准溶液盐酸进行滴定
B、用蒸馏水洗涤锥形瓶后,再用NaOH溶液润洗,而后装入一定体积的NaOH溶液进行滴定
C、用碱式滴定管量取10.00mLNaOH溶液放入用蒸馏水洗涤后的锥形瓶中,再加入适量蒸馏水和2滴甲基橙试液后进行滴定
D、若改用移液管取待测液10.00mLNaOH溶液放入锥形瓶后,把留在移液管尖嘴处的液体吹入锥形瓶内,再加入1mL甲基橙指示剂后进行滴定
10.0.1mol/LNH4Cl溶液中离子浓度大小顺序正确的是( )
A、c(NH4)>c(Cl)>c(OH)>c(H) B、c(NH4) >c(Cl)>c(H)>c(OH)
C、c(Cl)>c(NH4)>c(OH)>c(H) D、c(Cl) >c(NH4)>c(OH)>c(H)
11.在0.1mol/L的CH3COOH溶液中存在如下电离平衡:
2 -+-+-+-++--++-+-
CH3COOH
CH3COO-+H+ 对于该平衡,下列叙述正确的是( )
A、加入少量NaOH固体,平衡向正反应方向移动 B、加水,反应速率增大,平衡向逆反应方向移动 C、滴加少量0.1mol/L HCl溶液,溶液中C(H+)减少 D、加入少量CH3COONa固体,平衡向正反应方向移动 12.下列各环境下的离子组合能大量共存的是( )
A、碱性溶液中:Mg 、Fe 、SO4 、H2PO4 B、pH=0的溶液中:NH4 、Ca 、CH3COO 、ClC、c(H)=10
+
-14
-1
+
+
2+
―
-
2+
3+
2―
―
mol·L 的溶液中:Na 、AlO2 、S 、SO3
2+
-
-
-
-2-2-
D、pH试纸变红的溶液中:Fe 、I 、NO3 、ClO
13.物质的量浓度相同的下列溶液中符合按PH由小到大顺序排列的是( ) A、Na2CO3、NaHCO3、NaCl、NH4Cl
B、Na2CO3、NaHCO3、NH4Cl、NaCl D、NH4Cl、(NH4)2SO4、Na2S、NaNO3
C、(NH4)2SO4、NH4Cl、NaNO3、Na2S
14.pH=13的 强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为( )
A、9:1 B、1:11 C、1:9 D、11:1
第二部分 非选择题(共44分)
二、填空题(共24分,每空2分)
15.有下列物质:①NaOH固体;②Cu丝;③HCl气体;④CO2气体;⑤稀硫酸;⑥蔗糖;
请用序号回答:
(1)可以导电的是 ; (2)属于电解质的是 ; (3)属于非电解质的是 。
3
16.氯化铝水溶液呈 (填“酸性”、“中性”、“碱性”),原因是: (用离子方程式表示)。把AlCl3溶液蒸
。 干,灼烧,最后得到的主要固体产物是
17.在6份0.01mol/L氨水中分别加入下列各物质:
A.浓氨水 B.纯水 C.少量K2CO3
D.少量浓H2SO4 E.少量NaOH固体 F.少量Al2(SO4)3固体
(1)能使c(OH)减小、c(NH4)增大的是
(2)能使c(OH) 增大、c(NH4) 减小的是_____
(3)能使c(OH) 和c(NH4)都减小的是____ __
18.(1)pH=2的H2SO4溶液中,水电离出的c(OH-) = 100倍后,PH = 。 -+-+-+
(2)将0.05mol/L的 H2SO4溶液和pH=11的氢氧化钠溶液等体积混合后溶液的pH
= 。
19.(12分)实验室要测定某试剂瓶中盐酸溶液的浓度(约为0.1mol/L),回答下列问题:
(1)配制0.1000mol/L的NaOH溶液250 mL,需要的主要仪器除了量筒、烧杯、玻璃
棒,还需用到的玻璃仪器是 ___ _(填仪器名称)
(2)写出表示测量原理的化学反应方程式:__________________________
(3)取20.00 mL待测液,用 式滴定管量取;
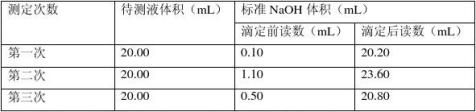
(4)根据下列数据,盐酸的浓度为 ;
(5)①没用待测液润洗锥形瓶
②滴定前仰视,滴定后俯视 。
三.计算题(8分,必须写出计算过程,否则不得分)
?120.将0.05mol?L的盐酸和未知浓度的NaOH溶液以1:2的体积比混合后,
4
用上述NaOH溶液滴定的pH?3一元弱酸HA的溶液20mL,达到终点时pH?12。
消耗NaOH溶液12.5mL。求:
(1)NaOH溶液的物质的量浓度
(2)一元弱酸HA的物质的量浓度
5
-
小学数学听课评课总结
小学数学听课评课反思我校安排了为期几周的听、评课,在听课中发现的问题和下一步如何加以整改与教师交换了意见,这些都有效地促进了教师教…
-
20xx急诊护理工作总结
急诊科20xx年护理工作总结20xx年门急诊科在院领导、护理部直接领导和大力支持下,在医院各科室的配合帮助下,我科全体医护人员齐心…
-
通安中学20xx年学生会工作总结
在本学年学生会工作即将结束之际,回顾学生会一年来的工作历程,我们深深地感到:每一项活动的顺利举行,均离不开学校领导的指导,离不全体…
-
学习生活自我总结
自我评价原作者#秋日雨思XP#保留所有权利ALLRIGHTSRECEIVED。时光飞快地流逝着,不知不觉中,长达四个多月的大一第一…
-
宁夏育才中学第二届学生会工作总结
宁夏育才中学学生会成立于20xx年,本届学生会自20xx年成立以来,本着自我管理、自我教育、服务同学为目标,在总校团委和学区团委的…