配合物的生成和性质
实验6 配合物的生成与性质
一、实验目的
1、了解有关配合物的生成与性质。
2、熟悉不稳定常数和稳定常数的意义。
3、了解利用配合物的掩蔽效应鉴别离子的方法。
二、实验原理
中心原子或离子与一定数目的中性分子或阴离子以配位键结合形成配位个体。配位个体处于配合物的内界。若带有电荷就称为配离子,带正电荷称为配阳离子,带负电荷称为配阴离子。配离子与带有相同数目的相反电荷的离子(外界)组成配位化合物,简称配合物。
简单金属离子在形成配离子后,其颜色,酸碱性,溶解性及氧化还原性等往往和原物质有很大的差别。配离子之间也可转化,一种配离子转化为另一种稳定的配离子。
具有环状结构的配合物称为螯合物,螯合物的稳定性更大,且具有特征颜色。利用此类鳌合物的形成作为某些金属离子的特征反应而定性、定量地检验金属离子的存在。
三、实验内容
1.配合物的生成
(1) CuSO4 溶液中滴加NH3·H2O,先产生蓝色沉淀,继续滴加,蓝色沉淀溶解得一深蓝色溶液:
Cu2+ + SO42- + 2NH3 =2NH4++Cu2(OH)2SO4↓
Cu2(OH)2SO4 + 8NH3 = 2[Cu(NH3)4]2++ SO42-+2OH-
深蓝色溶液[Cu(NH3)4]2+分为四份:
A:加碱:产生蓝色沉淀
[Cu(NH3)4]2+ +2OH- = 4NH3 + Cu(OH)2↓
再加酸:蓝色沉淀溶解
Cu(OH)2+4H+ = Cu2+ +4H2O
B: 滴加BaCl2:产生白色沉淀
[Cu(NH3)4]SO4+BaCl2 = BaSO4↓ +[Cu(NH3)4]Cl2
C: [Cu(NH3)4]SO4中加入1mL 乙醇, 溶液呈浑浊。
D: [Cu(NH3)4]SO4备用
(2) 在FeCl3中滴加NH4F:产生无色溶液
Fe3+ + 6F- = [FeF6]3-
[FeF6]3- + I- = 不反应
(3) 在K3[Fe(CN)6]中滴加KSCN:无现象
K3[Fe(CN)6] + SCN-无变化
在NH2Fe(SO4)2,FeCl3中分别滴加KSCN:溶液呈血红色
Fe3+ + n SCN- = [Fe(NCS)n]3-n
2.配位平衡的移动
(1) 配离子之间的转化
FeCl3中加水稀释:溶液呈无色
Fe3+ + 6H2O = Fe(H2O)63+
再滴加KSCN:溶液呈血红色
Fe(H2O)63+ + n SCN- = [Fe(NCS)n]3-n + 6H2O
再滴加NH4F:血红色褪去,溶液呈无色
[Fe(NCS)n]3-n+ 6F-= [FeF6]3- +n SCN-
再滴加饱和(NH4)2(C2O4)2:溶液出现浅黄色
[FeF6]3-+ 3(C2O4)22- = [Fe(C2O4)3]3-+6F-
(注意:实际中由于饱和(NH4)2(C2O4)2的浓度可能过小,常观察不到溶液的浅黄色,可使用固体(NH4)2(C2O4)2)
稳定性: [Fe(C2O4)3]3->[FeF6]3- > [Fe(NCS)n]3-n
(2)配位平衡与氧化还原反应
① A试管:FeCl3中加少许NH4F(s),溶液的黄色褪去,溶液呈无色,再滴加入KI,充分震荡后,加入CCl4,CCl4层呈无色
Fe3+ 6F-= [FeF6]3- [FeF6]3-+ I- = 不反应
B 试管:FeCl3中滴加入KI,充分震荡后,加入CCl4,CCl4层呈紫红色
2Fe3+ 2I- = 2Fe2+-+ I2
② A试管:HCl中加入小块Cu片:无现象
Cu + HCl = 不反应
B 试管:HCl中加入硫脲(s),再加入小块Cu片:产生气体
2Cu + 2HCl + 8CS(NH2)2 = 2{Cu[CS(NH2)2]4}Cl + H2
(3) 配离子稳定性的比较
① AgNO3中滴加Na2CO3,产生棕色沉淀
2 Ag+ + CO32- →Ag2O ↓(棕) + CO2
② a中沉淀离心后,加入NH3·H2O,沉淀溶解,得一无色溶液
Ag2O + 4NH3·H2O → 2[Ag(NH3)2]+ + 2OH- + 3H2O
③ b中再滴加NaCl,产生白色沉淀
[Ag(NH3)2]+ + Cl- = AgCl ↓(白) + 2NH3
④ c中白色沉淀离心后,加入NH3·H2O,沉淀溶解,得一无色溶液
AgCl + NH3·H2O→ [Ag(NH3)2]+ + Cl-
⑤ d中再滴加KBr,产生淡黄色沉淀
[Ag(NH3)2]+ + Br- →AgBr↓(淡黄色)
⑥ e中淡黄色沉淀离心后,加入Na2S2O3溶液,沉淀溶解,得一无色溶液
AgBr +2 S2O32- →[Ag(S2O3)2]3- + Br-
⑦ f中再滴加KI,产生黄色沉淀
[Ag(S2O3)2]3- + I- → AgI↓+ 2 S2O32-
⑧ g中黄色沉淀离心后,加入KCN溶液,沉淀溶解,得一无色溶液
AgI +2 CN- →[Ag(CN)2]- + I- (注意KCN溶液的毒性)
⑨ h中再滴加Na2S,产生黑色沉淀
2[Ag(CN)2]- + S2- → Ag2S↓+ 4CN-
所以: KSPq: AgCl >AgBr >AgI
Kfq:[Ag(CN)2]- > [Ag(S2O3)2]3- > [Ag(NH3)2]+
(4) 配位平衡与酸碱度
① H3BO3为一元弱酸: pH约为:4~5
H3BO3 + H2O = B(OH)4- + OH-
H3BO3与多元醇作用后,酸性增强:pH :约为3
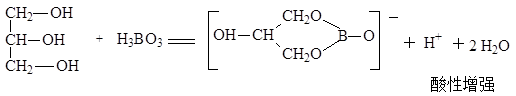
3. 配合物的某些应用
(1)鉴定某些离子
NiSO4中滴加NH3·H2O,得一蓝色溶液,再滴加二乙酰二肟,析出鲜红色沉淀
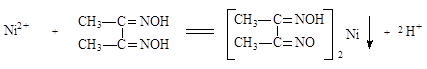
(2) 配合物的掩蔽效应
Co2++4SCN- → [Co(NCS)4]2- (溶于有机溶剂戊醇,显蓝绿色)
Fe3+会产生干扰:Fe3+ + n SCN- = [Fe(NCS)n]3-n(血红色)
Fe3+ 掩蔽方法:Fe3+ +6F- → [FeF6]3-
四、注意事项
1、严格控制化学试剂的用量;
2、注意进行Ni2+的实验时,必须控制溶液为微酸性或微碱性。
3、KCN为剧毒物质,使用时必须小心,废液注意回收。
第二篇:配合物的生成和性质
实验十 配合物的生成和性质
[课时安排] 3学时
[实验目的]
1.比较并解释配离子的稳定性。
2.了解配位离解平衡与其它平衡之间的关系。
3.了解配合物的一些应用。
[基本操作与仪器介绍]
1.离心机的使用
(1)将离心试管放入金属套管中,位置对称,重量平衡。如果只有一只离心管的沉淀需要进行分离,则可取另一支空的离心管,放等量的水。然后把两支离子试管分别装入离心机的对称套管中,保持平衡。
(2)使用时,打开旋钮,逐渐旋转变阻器,转速从小到大。
(3)离心时间和转速,由沉淀性质决定。结晶型紧密沉淀,转速1000转/min,1-2min后停止。无定型疏松沉淀,转速2000转/min,2-4min后停止。
2.离心分离操作
利用离心分离的方法,将少量沉淀与溶液进行分离的操作步骤:
(1)溶液的转移。离心沉降后,用吸管把清波与沉淀分开。其方法是,先用手指捏紧吸管上的橡皮头,排除空气,然后将吸管轻轻插入清液(切勿在插入清液以后再捏橡皮头),慢慢放松橡皮头,溶液则慢慢进入管中.随试管中溶液的减少,将吸管逐渐下移至全部溶液吸入管内为止。吸管尖端接近沉淀时要特别小心,勿使其触及沉淀。
(2)沉淀的洗涤。如果要将沉淀溶解后再做鉴定,必须在溶解之前,将沉淀洗涤干净。常用的洗涤剂是蒸馏水。加洗涤剂后,用搅拌棒充分搅拌,离心分离,清液用吸管吸出。必要时可重复洗几次。
[实验重要步骤]
1.简单离子与配离子的区别
在分别盛有2滴0.1mol/LFeCl3溶液和K3[Fe(CN)6]溶液的两支试管中,分别滴入2滴0.1mol/L NH4SCN溶液,有何现象?两种溶液中都有3价Fe ,如何解释上述现象?
2.配离子稳定性的比较
(1)往盛有2滴0.1mol/LFeCl3溶液的试管中,加0.1mol/L NH4SCN溶液数滴,观察有何现象?然后再逐滴加入饱和(NH4)2C204溶液,观察溶液颜色有何变化?写出有关反应方程 式,并比较Fe3+的两种配离子的稳定性大小。
(2)在盛有10滴0.1mol/L AgNO3溶液的试管中,加入10滴0.1mol/LnaCl溶液微热,分离除去上层清液,然后在该试管中按下列的次序进行试验:
a.滴加6 mol/L氨水(不断摇动试管)至沉淀刚好溶解。
b.加10滴0.1mol/L KBr溶液,有何沉淀生成?
C.除去上层清液,滴加1m0.1mol/L Na2S203溶液至沉淀溶解。
d.滴加0.1mol/L KI溶液,又有何沉淀生成?
写出以上各反应的方程式
(3)在0.5mL碘水中,逐滴加入0.1mol/L K4[Fe(CN)6]溶液,振荡,有何现象?
3.配位解离平衡的移动
首先制备[Cu(NH3)4]2+的溶液。再破坏该配离子,请按下述要求,自己设计实验步骤进行实验,并写出有关反应式。
(1)利用酸诚反应破坏[Cu(NH3)4]2+
(2)利用沉淀反应破坏[Cu(NH3)4]2+。
(3)利用氧化还原反应破坏[Cu(NH3)4]2+
4.配合物的某些应用
(1) Ni2+的鉴定
(2) 掩蔽干扰离子
(3) 硬水软化
[实验数据记录和结果]

[实验中应注意事项]
1、离心试管应对称放置。
2.离心机操作顺序:开关-设定时间-设定转速
[实验习题]
1.什么叫螯合剂,螯合物有什么特点?举个例子?
答:能够与中心离子形成环状结构配合物的多齿配体叫螯合剂,螯合物非常稳定,而且5元、6元环越多越稳定,例如EDTA.它与中心离子能形成5个5元环。
2.使用离心机进行离心分离时,操作时应注意什么?
答:离心试管置于套管中位置要对称,重量要平衡;转速要由小到大。
3.根据配位解离平衡的移动,你是如何设计实验方法来破坏[Cu(NH3)4]2+配离子?
答:利用酸碱反应,加入酸;利用沉淀反应,加入硫化钠;利用氧化还原反应,加入锌粉;利用生成更稳定的配合物,加入EDTA.
4.衣服上粘有铁锈时,可以用草酸洗去,试说明原理。
答:生成了可溶于水的[Fe(C2O4)3]3-。
5.可用哪些不同类型的反应,使FeSCN2+的红色褪去?
答:络合反应FeSCN2+→[FeF6]3-;氧化还原反应与碘离子→Fe2+;沉淀反应→Fe(OH)3
6.指出AgX(X:Cl,Br,I)的溶解度大小顺序?借助配位效应对沉淀溶解度的影响,分别指出哪些物质能溶解AgX(X:Cl,Br,I)?并指出产物配合物的稳定性大小顺序。
答: 溶解度:AgCl>AgBr>AgI;
AgCl溶于氨水,AgBr溶于硫代硫酸钠,AgI溶于氰化钾;
配合物的稳定性:[Ag(CN)2]-> [Ag(S203)2]3-> [Ag(NH3)2]+
-
配合物的生成和性质
配合物的生成和性质一实验目的1比较并解释配离子的稳定性2了解配位离解平衡与其它平衡之间的关系3了解配合物的一些应用二实验原理中心原…
-
配合物的生成和性质.新doc
实验6配合物的生成与性质一实验目的1了解有关配合物的生成与性质2熟悉不稳定常数和稳定常数的意义3了解利用配合物的掩蔽效应鉴别离子的…
-
实验四 配合物的生成和性质(免费)
实验四配合物的生成和性质1简单离子与配离子的区别铁氰化钾K3FeCN6加SCN无血红色Fe3nSCNFeNCSn3n有血红色结论F…
-
配合物的生成和性质
实验6配合物的生成与性质一实验目的1了解有关配合物的生成与性质2熟悉不稳定常数和稳定常数的意义3了解利用配合物的掩蔽效应鉴别离子的…
-
实验十一 配合物的生成、性质与应用
实验十一配合物的生成性质和应用一实验目的1了解配合物的生成和组成2了解配合物与简单化合物的区别3了解配位平衡及其影响因素4了解螯合…
-
稀土有机配合物的制备和性能研究实验报告
稀土有机配合物的制备及性能测定一实验目的1了解稀土元素的基本知识2理解光致发光的基本原理3熟练掌握稀土盐和稀土有机配合物的制备方法…
-
稀土有机配合物的制备及性能测定实验报告
稀土有机配合物的制备及性能测定北京化工大学理学院姓名班级学号时间20xx5820xx521一实验目的1了解稀土元素的基本知识2理解…
-
铬,锰及其化合物的相关性质的实验报告
铬锰及其化合物的相关性质1了解铬和锰的各种常见化合物的生成和性质2掌握铬和锰各种氧化态之间的转化条件3了解铬和锰化合物的氧化还原性…
-
1_4370073_三草酸根合铁(III)的制备与性质和组成分析实验报告
化学综合设计性实验报告三草酸根合铁III的制备与性质和组成分析教学院化学与制药工程学院班级药剂0901班姓名黄启学号0924013…
-
钠及其化合物的性质实验报告
天水一中化学实验报告班级姓名同组人指导教师日期实验题目钠及其化合物的性质实验目的1通过钠及其化合物的性质实验加深对碱金属及其化合物…