丙烯酰胺水溶液聚合
一、丙烯酰胺水溶液聚合
一、实验目的
1.掌握溶液聚合的方法和原理。
2.学习如何选择溶液。
3.掌握聚合物的处理方法。
二、实验原理
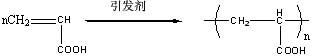
将单体溶于溶剂中而进行聚合的方法叫做溶液聚合。生成聚合物有的溶解有的不溶,前一种情况称为均相聚合,后者则称为沉淀聚合。自由基聚合,离子型聚合和缩聚均可用溶液聚合的方法。
在沉淀聚合中,由于聚合物处在非良溶剂中,聚合物链处于卷曲状态,端基被包裹,聚合一开始就出现自动加速现象,不存在稳态阶段。随着转化率的提高,包裹程度加深,自动加速效应也相应增强,沉淀聚合的动力学行为与均相聚合有明显不同。均相聚合时,依双基终止机理,聚合速率与引发剂浓度的平方根成正比。而沉淀聚合一开始就是非稳态,随包裹程度的加深,其只能单基终止,故聚合速率将与引发剂的浓度的一次方成正比。
在均相溶液聚合中,由于聚合物是处在良溶剂环境中,聚合物处于比较伸展状态,包裹程度浅链扩散容易,活性端基容易相互靠近而发生双基终止。只有在高转化率时,才开始出现自动加速现象,若单体浓度不高,则有可能消除自动加速效应,使反应遵循正常的自由基聚合动力学规律。因而溶液聚合是实验室中研究聚合机理及聚合动力学等常用的方法之一。
进行溶液聚合时,由于溶剂并非完全是惰性的,其对反应会产生各种影响,选择溶剂时应考虑以下几个问题:
(1)对引发剂分解的影响:偶氮类引发剂(偶氮二异丁腈)的分解速率受溶剂的影响很小,但溶剂对有机过氧化物引发剂有较大的诱导分解作用。这种作用按下列顺序依次增大:芳烃、烷烃、醇类、醚类、胺类,诱导分解的结果使引发剂的引发效率降低。
(2)溶剂的链转移作用:自由基是一个非常活泼的反应中心,它不仅能引发单体分子,而且还能与溶剂反应,夺取溶剂分子的一个原子,如氢或氯,以满足它的不饱和原子价。溶剂分子提供这种原子的能力越强,链转移作用就越强。链转移的结果使聚合物分子量降低。若反应生成自由基活性降低,则聚合速度也将减小。
(3)对聚合物的溶解性能,溶剂溶解聚合物的性能控制着活性链的形态(卷曲或舒展)及其粘度,它们决定了链终止速度与分子量的分布。
与本体聚合相比,溶液聚合体系具有粘度降低、混合及传热较容易、不易产生局部过热、温度容易控制等优点。但由于有机溶剂费用高,回收困难等原因,使得溶液聚合在工业上很少应用,只有直接使用聚合物溶液的情况下,如涂料、胶粘剂。浸渍剂和合成纤维放丝液等采用溶液聚合的方法。
丙稀酰胺为水溶性单体,其聚合物也溶于水。本实验采用水为溶剂进行溶液 1
聚合,其优点是:价廉、无毒、链转移常数小、对单体及聚合物溶解性能好,为均相聚合。
聚丙烯酰胺是一种优良的絮凝剂,水溶性好,被广泛应用于石油开采、选矿、化学工业及污水处理等方面。
三、主要仪器和试剂
丙烯酰胺 甲醇 过硫酸铵 浴锅 布氏漏斗
三口瓶 球型冷凝管 温度计 Y形管
四、实验步骤
在100ml三口反应瓶中间口装上搅拌器,在一个侧口装上氮气导管,另一侧按一个Y型管。利用Y形管的两个口分别装上温度计和冷凝管。将5克(0.07mol)丙烯酰胺和40ml蒸馏水加入反应瓶中,开动搅拌,在通氮气的情况下用水浴加热至30oC(参见附注)使单体溶解。然后把溶解于5ml蒸馏水中的0.025克过硫酸铵从冷凝管上口加入到反应瓶中,并用5ml蒸馏水冲洗冷凝管。逐步升温至90 oC(注意升温速度不要过快),聚合物便逐渐生成。在90 oC下反应2-3小时。反应完毕后,将得产物倒入盛有150ml甲醇得500ml烧杯中,边倒边搅拌,这时聚丙烯酰胺便沉淀出来。静置片刻,向烧杯中加入少量甲醇,观察是否仍有沉淀生成。若还有,则可再加少量甲醇,使聚合物沉淀完全,然后用布氏漏斗抽滤。沉淀用少量甲醇洗涤三次后,转移到表面皿上,在30 oC真空烘箱中干燥至恒重。称重,计算产率。
注:在排除氧气的情况下,可以获得分子量比较高的聚合物。若采用低温逆相乳液聚合,则可以获得分子量很高的聚合物。
五、思考题
1.进行溶液聚合时,选择溶剂应注意哪些问题?
2.工业上什么情况下采用溶液聚合?溶液聚合有哪些优缺点?
3.反应中为何不能升温太快?
参考资料
《高分子化学》,潘祖仁编,化学工业出版社
2
二、甲基丙烯酸甲酯的本体聚合
一、实验目的
本实验为存在和不存在链转移剂时甲基丙烯酸甲酯的本体聚合。了解本体聚合的原理,掌握本体聚合的方法。
二、实验原理
本体聚合是单体在不另加溶剂、介质下本身进行聚合反应的过程,用本体聚合的方法可以制得纯净的、分子量较高的聚合物。本体聚合中,随着转化率的提高,聚合物的粘度增加,反应产生的热量难于散发,同时由于粘度增加,长链运动受阻,使双基终止速率大大降低,致使聚合速率急剧增加而产生自动加速现象,这些都将引起分子量分布不均匀,从而影响产品性能。
甲基丙烯酸甲酯通过本体聚合可以制得有机玻璃,聚甲基丙烯酸甲酯由于有庞大的侧基存在,为无定形固体,其最突出的性能是具有高度的透明性,它的比重小,故其制品比同体积无机玻璃制品轻巧的多,同时又具有一定的耐冲击强度与良好的低温性能,是航空工业与光学仪器制造工业的重要原料。有机玻璃表面光滑,在一定的弯曲限度内,光线可在其内部传导而不逸出,故外科手术中利用它把光线输送到口腔喉部作照明。聚甲基丙烯酸甲酯的电性能有两,是很好的绝缘材料。
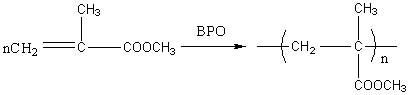
甲基丙烯酸甲酯在过氧化苯甲酰引发剂存在下,进行如下聚合反应:
下图为甲基丙烯酸甲酯在过氧化苯甲酰引发剂存在下聚合转化率与时间的关系曲线。
图1 甲基丙烯酸甲酯本体聚合时间与转化率曲线
以过氧化苯甲酰为引发剂,用量是:I. 2%; II. 1%; III. 0.5%; IV. 0.25%; V. 0.125% 聚合反应开始前有一段诱导期,聚合速率为零,体系无粘度变化。在转化率超过20%之后,聚合速率显著加快,而转化率达80%之后,聚合速率显著减小,最后几乎停止聚合,聚合配方中引发剂的含量,应视制备的模具厚度而定,一般情况如下:

3
本实验中,为了解决散热,避免自动加速作用可能引起的爆聚现象及单体转化为聚合物引起的体积收缩问题,所以一把都采用预聚合的方法,严格控制温度,使之安全渡过危险期;最后在较高温度下,继续完成聚合反应。 三、主要试剂和仪器
甲基丙烯酸甲酯 偶氮二异丁腈(重结晶)试管 三颈瓶 冷凝管 恒温水浴 四、实验步骤
准确称取0.03克偶氮二异丁腈(重结晶,重结晶方法可见实验十五),50克甲基丙烯酸甲酯,混合均匀,投入到10ml配有冷凝管与通氮气瓶的磨口三颈瓶中,开动冷却水,通氮气,采用水浴恒温,开动搅拌,升温至75-80oC,20-30分钟后取样,若预聚物具有一定粘度(转化率7-10%),则移去热源,冷却至o
50C左右,搅拌均匀。
取1.5×1.5厘米试管若干只,分别进行灌注,灌注高度一般为5-7厘米(灌注过多,压力过大,有可能使气泡不易逸出,留在聚合物内),然后静置片刻,或在60 oC的水浴中加热数分钟或在室温中直至硬化,硬化后,在沸水中熟化1小时,使反应趋于完全,撤出试管,可得到一透明度高,光洁的圆柱形聚甲基丙烯酸甲酯。
如采用玻璃板作模具,预聚液(转化率为8-10%)在55-60 oC水浴中恒温2小时,升温至95-100 oC1小时,撤去板后,可得到一透明光洁的有机玻璃薄板。 五、思考题
1.反应后期为什么要升高温度? 2.反应中为何要通氮气?
3.写出甲基丙烯酸甲酯聚合反应历程。
参考资料
1.《高分子化学实验室制备》,E. L. 麦卡弗里著,科学出版社 2. 《聚合物科学实验》,E. A. 柯林斯著,科学出版社
4

三、聚乙烯醇及其缩丁醛的制备
一、实验目的
1.了解聚合物中官能团反应的常识,并学会其中的操作技术。
2.了解大分子的基本有机化学反应,在高分子链上有合适的反应基团时,均可按小分子有机反应历程进行高分子反应。
3.了解通过高分子反应改性原理。
二、实验原理
由于单体乙烯醇并不存在,聚乙烯醇不可能从单体聚合而得,而只能以它的酯类(即聚乙酸乙烯酯)通过醇解在酸性条件下进行,通常用乙醇或甲醇作溶剂,酸性醇解时,由于痕量的酸极难自聚乙烯醇中除去,残留在产物中的酸,可能加速聚乙烯醇的脱水作用,使产物变黄或不溶于水;碱性醇解时,产品中含有副产品醋酸钠,目前工业上都采用碱性醇解法。
碱性醇解:
H C H CC C HNaOH
OCOCHOCOCH

H HH+CH3COONa+CH3COOCH3CCCC
H
OHOH
23322H2CHOH
酸性醇解:
C
H2 H2SO4 OCOCHOCOCH
HHH+CH3COOH+CH3COOCH3 CCC
H OHOH
醇解在加热和搅拌下进行。

初始时微量聚乙烯醇先在瓶壁析出,当约有60%的乙酰氨基被羟基取代后,聚乙烯醇即自溶液中大量析出,继续加热,醇解在两相中进行,在反应过程中,除了乙酸根被醇解外,还有支链的断裂,聚乙酸乙烯3322HCH2CHCCHOH 5
酯的支化度愈高,醇解后分子量降低就愈多。
聚乙烯醇是白色粉末,易溶于水,将它的水溶液自纺织头喷入Na2SO4-K2SO4的溶液中,聚乙烯醇即沉淀而出,再用甲醛处理就得高强度、密度大的人造纤维,商品名叫“维尼纶”。
聚乙烯醇水溶液在浓盐酸催化下与丁醛缩合制得的聚乙烯醇缩丁醛树脂,就是粘结力大,制造安全透明玻璃的一种原料,此外聚乙烯醇对许多有机溶剂的不溶性,可用来制造耐汽油的衬垫合管子。
三、主要试剂和仪器
聚乙酸乙烯酯 乙醇 氢氧化钾-乙醇溶液 正丁醛盐酸羟氨水溶液 搅拌器 三颈瓶 冷凝管 滴液漏斗等
四、实验步骤
1.乙酸乙烯酯的醇解-聚乙烯醇的制备
H2H2HH CCCCnn
OHOCOCH3
在装有搅拌器、冷凝管、温度计和滴液漏斗的500ml三颈瓶中加30ml16%的氢氧化钾-乙醇溶液[注1],用水浴保持温度在20-25oC左右[注2],滴加80克浓度为26%的聚乙酸乙烯酯溶液,速度不宜过快[注3],在40-45分钟内滴完,然后维持在此温度2小时,冷却至室温,用布氏漏斗过滤,产物为白-浅黄色固体,用60ml70%乙醇分四次洗涤,抽干,然后置于真空烘干箱中在50-60oC之间烘干。
[注1]氢氧化钾-乙醇溶液要先配好,过滤后再用,氢氧化钾的质量对产物的色泽影响很大。
[注2]温度不宜超过30oC,否则产物的颜色加深。
[注3]为防止结块,滴加速度不宜过快,生产上也有采用在聚乙酸乙烯酯的溶液中加入碱液进行醇解的操作方法,但在实验室中不宜采用,因为小实验的搅拌效率不高,反应过快,会产生冻胶现象,产物难以处理。
附:醇解度分析
反应式: HH+ CHCOONaCHC+NaOHCCnH
OHOCOCH NaCl + HONaOH + HCl
测度方法:准确称取聚乙烯醇样品1克,加入100ml蒸馏水,加热回流至全部溶解,冷却后加入酚酞指示剂,用0.01N氢氧化钾-乙醇溶液中和至微红色,加入25ml5N盐酸滴定至无色,同时作一空白实验。 23232
6
乙酰氨基含量%=(V2?V1)
W?0.059?100%
式中:N为盐酸标准溶液的当量浓度
V2为空白消耗盐酸的毫升数
V1为样品消耗盐酸的毫升数
W为样品重量
0.059是换算因子
2.聚乙烯醇缩丁醛的制备
在装有搅拌器、冷凝管、温度计的200ml三颈瓶中加入10克聚乙烯醇、90ml蒸馏水配成10%溶液,在70-80oC溶解1小时,待聚乙烯醇完全溶解后,冷却至8-10oC,测PH值。若溶液呈碱性,先加数滴20%的盐酸中和至中性,加入20%盐酸2.4ml,反应温度控制在8-10oC一小时、10-15oC一小时、15-20oC一小时,以后逐步升温至50-55oC,反应时间3小时左右[注1]。冷却至室温后,用砂芯漏斗抽气过滤,用大量水洗至中性,并除去未反应的丁醇[注2],产物为白色粉末,易溶于脂类或乙醇类中,易溶于苯和乙醇的混合液中,缩醛度约为40%,试验聚乙烯醇缩丁醛的溶解度,并同聚乙烯醇比较,在乙醇中的溶解度随着缩醛度的提高而提高。
[注1] 为防止结块,温度不能升的太快。工业生产上低温反应时间较长,因学生实验受时间限制,改用现在这种升温步骤。
[注2] 未反应的丁醛难溶于水,除去困难,可改用30-40 oC温水处理,或用低浓度的乙醇容易洗涤。
[附] 缩醛度和酸度的测定 HHCCCH2CH2NH2OHHCl+反应式:
nH COO
C8H7
HHCNOH+HCl +C8H7CCCH2CH2Hn
OHOH
KOH +HCl=KCl +H2O
测定方法:聚乙烯醇缩丁醇(PVB)样品经50oC真空烘箱干燥恒重,准确称取1克,置于250ml磨口三角烧瓶中,加入50ml乙醇,安上冷凝管,加热至60oC,使样品全部溶解,冷却后,加入1%酚酞指示剂用0.02N氢氧化钾-乙醇溶液滴定至微红色,加入7%盐酸羟胺水溶液25毫升,摇匀,并加热回流3小时,冷却后加入甲基橙指示剂,用0.5N的氢氧化钾溶液滴定至终点由红-黄,同时作一空白实验。 计算:(V2?V1)N?56.1
W?1000?100%
式中:V1是空白消耗氢氧化钾-乙醇溶液毫升数
V2是样品消耗氢氧化钾-乙醇溶液毫升数
56.1是换算因子
W是样品重
7
N是氢氧化钾-乙醇溶液的当量浓度 缩醛度%=V?N?0.088
W?100%
式中:V=(V2-V1)
W是样品重量
0.088是换算因子
V2是样品消耗氢氧化钾标准溶液毫升数
V1是空白消耗氢氧化钾标准溶液毫升数
3.聚乙烯醇缩甲醛的制备
250ml三口瓶,加蒸馏水50ml,聚乙烯醇7克,搅拌下100 oC加热溶解,降温至90 oC,加40%甲醛水溶液4.6ml,搅拌15分钟后加2.5N盐酸0.5ml,使溶液pH约1-3,在90 oC下搅拌约半小时,体系逐渐变稠,当有气泡或絮状物产生时,迅速加入8%NaOH1.5ml,再加入30-40ml蒸馏水,调体系pH约8-9,冷却降温,得透明粘稠液,即为市售的胶水。
五、思考题
1.聚乙烯的缩醛化反应为什么不能以100%进行,考虑其理由。
2.聚乙烯醇的缩醛化反应,还可用其他什么化学试剂,怎样使用?
3.聚乙烯醇缩醛化反应中,为什么不生成分子间交联的缩醛键?
参考资料
1.R. Sorenson, et.al, 王有槐等译,《高分子化学制备方法》,石油化学工业出版社
2.D.Braun,黄保同等译,《聚合物合成和表征技术》,第300、301页,科学出版社
3.《高分子化学实验讲义》,北京化工大学材料科学与工程学院高分子化学教研室编
四、低分子量聚丙烯酸(钠盐)的合成和分析
一、实验目的
1.掌握低分子量聚丙烯酸的合成
2.用端基滴定法测定聚丙烯酸的分子量
二、实验原理
聚丙烯酸时水质稳定剂的主要原料之一,高分子量的聚丙烯酸(分子量在几万或几十万以上)多用于皮革工业‘造纸工业等方面,作为阻垢效果有极大影响,从各项实验证明,低分子量的聚丙烯酸阻垢作用显著,而高分子量的聚丙烯酸丧失阻垢作用。
8
丙烯酸单体极易聚合,可以通过本体、溶液、乳液、和悬浮等聚合方法得到聚丙烯酸,它符合一般的游离基聚合反应规律,本实验用控制引发剂用量和应用调聚剂异丙醇,合成低分子量的聚丙烯酸,并用端基滴定法测定分子量。
三、主要试剂和仪器
丙烯酸 过硫酸铵 异丙醇 搅拌器 三颈瓶 滴液漏斗 pH计等
四、实验步骤
低分子量聚丙烯酸的合成
在带有回流冷凝管和两个滴液漏斗的100ml三颈瓶中,加入25ml蒸馏水和0.2克过硫酸铵,待过硫酸铵溶解后,加入1克丙烯酸单体和1.6克异丙醇。开动搅拌器,加热使瓶内温度达到65-70oC。在此温度下,把8克丙烯酸单体和1克过硫酸铵在8ml水中的溶液,分别由漏斗渐渐滴入瓶内,由于聚合过程中放出的热量,瓶内温度有所升高,反应液逐渐回流,其后在94 oC回流1小时,反应立即完成,聚丙烯酸分子量约在500-4000之间。
如要得到聚丙烯酸钠盐,在已制成的聚丙烯酸水溶液中,加入浓氢氧化钠溶液(浓度为30%)边搅拌边进行中和,使溶液得PH值达到10-12范围内,即停止,制得聚丙烯酸钠盐。
[附]端基法测定聚丙烯酸分子量
丙烯酸聚合物的酸性较其对应单体要弱,其滴定曲线随中和程度的增加而上升较慢,当聚丙烯酸只溶于水时,不易被精确的滴定。但是如果滴定在0.01-1M的中性盐类溶液中进行,滴定终点是清楚的,测定是准确的。
准确称量约0.2克样品放入100ml烧杯中,加入1M的氯化钠溶液50ml,用0.2M的氢氧化钠标准溶液滴定之,测定其pH值,用消耗的氢氧化钠标准溶液的毫升数对pH值作图,找到终点所消耗的碱量。
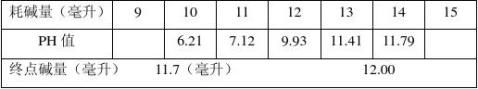
计算公式:M?2
1
72?VN
W?1000
式中M为聚丙烯酸分子量,
V为试样滴定所消耗的氢氧化钠标准溶液毫升数,
9
N为氢氧化钠标准溶液的当量浓度,
W为试样克数,
1
72为每克样品中所含有的羧基克当量的理论值,
2为聚丙烯酸1个分子链两端各有一个内酯。
五、注意事项
1.聚丙烯酸样品经薄膜蒸发起干燥处理或在石油醚中沉淀,沉淀物晾干后在50 oC烘箱中烘干,然后再于50 oC真空烘箱中烘干。
2.样品加入盐溶液后的浓度,对滴定情况很有影响,如果样品浓度大,加入的中性盐溶液的浓度也相应的增大,否则浓度大的样品其滴定曲线终点转折不明显(即不易确定终点),这是因为加入中性盐类,通过减少被电离的羟基周围的电离电偶层的厚度并从而降低对其相邻羟基的电离效果,因而引起酸强度的增加,中性盐类对电离度的作用,基本上取决于它们的浓度及阳离子的大小,但几乎不受阴离子特性的影响。
参考资料
1.天津化工研究院《水质稳定剂研制报告汇编》第205页,1977(内部资料)。
2.中国科学院有机化学研究所《聚丙烯酸钠防垢测试报告》第4页,19xx年(内部资料)。
五、偶氮二异丁腈分解速率的测定
一、实验目的
1.掌握测定偶氮二异丁腈分解速率的测定的基本原理和方法
2.了解有关引发剂方面的一些基本知识
二、实验原理
引发剂是一种能在热、光、辐射等作用下分解产生初级自由基,并能引发单 10
体聚合的物质,它在自由基聚合反应中占有十分重要的地位。引发剂的种类和用量对聚合反应速率以及聚合物的分子量关系极大。在一定温度下,对某一单体来说,其聚合速率在很大程度上取决于引发剂的分解速率。因此研究和测定引发剂的分解速率对聚合反应的控制具有实际生产意义。
引发剂的品种繁多,性质各异,但按其化学组成来分,大致可分为过氧化物和偶氮化物两大类。如按自由基的产生方式来分,又可分为热引发(包括光、热辐射)体系和氧化还原体系,在偶氮化合物中,偶氮二异丁腈是最常见的引发剂之一。
偶氮二异丁腈分解均匀,只形成一种自由基,不发生诱导分解之类的副反应,比较稳定,可以纯粹状态安全储存等优点。因此动力学研究和工业生产都广泛采用,缺点是,具有一定的毒性,分解效率低,属于低活性引发剂。
引发剂在加热下分解,产生初级自由基,由于化合物分子中各原子间的键能大小是有差别的,故均裂反应往往发生在键能最小的地方,偶氮二异丁腈各原子间的键能(千卡/克分子)如下:
H
HCHCH3
NCCNNCCN
CH3CH3
在各类键中,C-N键的键能最小,均裂就在此处发生,产生了异丁腈自由基,并放出氮气。
H
CH3HCHCH3 + 2CNCNCCNNCCN N2 CH3CH3CH3
大多数引发剂的分解反应一般属于一级反应,上式也是如此,其分解速率与引发剂浓度的一次方成正比,即:
d[I]
dt?Kd[I]
式中:Kd-引发剂分解速率常数,单位可以是秒-1·分-1·小时-1
[I]-引发剂浓度
t-时间

将上式积分得:In
[I]
[I]0[I][I]0?Kdt 或?eKdt
11
式中:[I]0和[I]分别表示引发剂的起始(t=0)浓度和时间t的浓度,单位为克分子/升。
由方程式1可以看出,1摩尔偶氮二异丁腈分解,可以放出1摩尔氮气,而氮气的体积在温度恒定时与引发剂浓度之间有着正比关系。假定分解反应在80oC分解完全,全部产生的氮气体积V∞与偶氮二异丁腈的起始浓度[I]0成正比,那么(V∞- Vt)则与t时的浓度[I]成正比(Vt为t时刻已放出的氮气的体积),代入(2)式:
InV?
V??Vt
V?
V??Vt?Kdt K或lg?dt2.303 V?
V??Vt这是一个直线方程,以lg对t作图,直线的斜率是Kt/2.303,本实验
就是在80oC的恒温下,在甲苯中偶氮二异丁腈分解,不断测定t时刻系统中放出的氮气体积Vt,通过作图而求出分解速率常数Kd。知道了分解速率常数Kd,还可以求出引发剂的半衰期,即引发剂分解至起始浓度一半所需要的时间,以t1/2表示,由[I]=1/2代入式(2),可得半衰期与分解速率常数Kd之间有如下关系式:
t1?
2In2Kd?0.693Kd
由上式可知,一级反应的半衰期与反应物浓度无关。
引发剂的活性可用分解速率常数Kd或半衰期t1/2表示,在某一温度下,分解速率常数越大,或半衰期越短,则引发剂的活性越高。在科学研究上,多用分解速率常数Kd表示,在工程技术上,则多用半衰期t1/2表示,单位取小时。
三、主要仪器和试剂
碳酸钠 甲苯 偶氮二异丁腈(重结晶) 水准瓶
带支管的圆底磨口瓶 恒温水浴 三通
四、实验操作
将50ml带有一支管的园底磨口瓶在80oC的恒温水浴中固定,用三段耐压管分别按顺序将烧瓶的支管,一根弯有约130度的玻璃管,三通活塞和量气管的顶部联结起来。量气管垂直固定,中间外壁缚一支温度计,用以指示管内温度,量气管底部通过一根橡皮管与水准瓶连接,水准瓶内装入碳酸钠溶液,加入几滴酚酞使其显红色,放置在铁圈上,整套装置如图所仪器装好后,首先要检查装置系统是否漏气。其方法是,将烧瓶用塞塞好,活塞旋向与大气相通的位置,抬高水准瓶,使量气管内的液面升到最高处,然后将活塞旋向与大气断开,使烧瓶与量气管相通,降低水准瓶的位置并固定,此时量气管的液面稍有下降,停一段时间后,如液面一直保持在同一高度,说明系统不漏气,如果液面继续下降,说明系 12
统密闭不好,应检查原因,采取相应措施。
往烧瓶中加入45ml蒸馏过的甲苯。将烧瓶用装有氮气进口瓶的橡皮管的橡皮塞塞紧,进气管应达到烧瓶的底部,调整活塞,将水准瓶提高到使液面充满量气管的高度,使系统中的空气派出,缓慢通入氨气流,使甲苯发泡20分钟,排气操作的目的,是派出系统中的氧。
样品容器是用一根玻璃管的一端在喷灯上烧熔,在石棉板上压平,然后喷制而成的,见图中的g,将其在分析天平上准确称取100-200mg偶氮二异丁腈(重结晶),记下当时的大气压,并假定在整个过程中保持不变。
取下氮气进口瓶,将烧瓶与大气断开,系统在几分钟内达到平衡后,打开塞子,用镊子垂直放进样品容器,塞上塞子,记录时间(作为零时)和量气管内液面的高度(作为起始刻度)。
由于在氮气产生前会有一诱导期,所以不必搅拌混合物来加快偶氮二异丁腈的溶解速率,注意观察量气管内液面的高度,如果液面下降,说明已有氮气放出,记录此时的时间和氮气放出体积。注意,在读数时,应将水准瓶和量气管的液面挑至水平,以后每隔五分钟,记录一次体积,直至氮气放出速率显著减慢为止,记下量气管壁的温度。
五、数据处理
1.实验条件下样品完全分解放出氢气的体积V?由下式求得:
V??nRTPN2?nRTP?PH2O?P甲苯
式中:PN2-系统中氮气的蒸汽压
P-当时的大气压
P-量气管温度下水的蒸汽压
P甲苯-量气管温度下甲苯的蒸汽压
lgP甲苯=A?BC?t(C)O
A=6.95464
B=1344.8
C=219.482
P单位:mmHg(毫米汞柱)
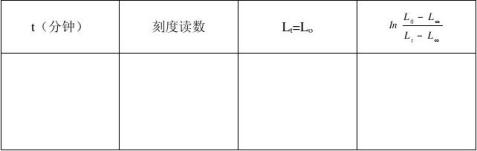
2.实验数据按下表格式填入:

13
最后以lgV?
V??Vt对t作图,由直线的斜率求出偶氮二异丁腈的分解速率Kd。
六、注意事项
1.仪器安装好后,要仔细检查系统是否漏气,如密封不好,不能开始实验。
2.放入样品容器,最好竖直向上,如倒扣里面,则影响样品溶解。
3.读量气管刻度时,一定以水准瓶和量气管内的液面在同一水平线上为准,否则数据不准确。
4.不要忘记记下当时的大气压和量气管的温度,否则无法处理实验数据。
七、思考题
1.本实验所用的仪器能用来测定过氧化苯甲酰放出来的CO2吗?为什么?
2.根据你所测得分解速率Kd,求AIBN的半衰期t1/2、
3.如果AIBN在600C时的分解速率是6.4×10-4分-1,此过程的活化能是多少?
4.如何正确读取量气管中液面的高度?
参考资料
《高分子化学实验室制备》,E. L. 麦卡弗里著,科学出版社
六、膨胀计法测定苯乙烯聚合反应速率
一、实验目的
1.了解膨胀计法测定聚合反应速率的原理。
2.掌握膨胀计的使用方法。
14

3.掌握动力学实验的操作及数据处理方法。
二、实验原理
自由基聚合反应是现代合成聚合物的重要反应之一,目前世界上,由自由基聚合反应得到的合成聚合物的数量居多。因此,研究自由基反应动力学具有重要意义。
聚合速率可由直接测定来反应的单体或所产生的聚合物的量求得。这被称为直接法;也可以从伴随聚合反应的物理量的变化求出。此即被成为间接法。前者适用于各种聚合方法,而后者只能用于均一的聚合体系。它能够连续地、精确的求得聚合物初期的聚合反应速率。
对于均一的聚合体系,在聚合反应进行的同时,体系的密度、粘度、折光度、介电常数等也都发生变化。本实验就是依据密度随反应物浓度变化的原理而测定聚合速率的。聚合物的密度通常也比其单体大,通过观察一定量单体在聚合时的体积收缩就可以计算出聚合速率。一些单体和聚合物的密度变化如下表所示:
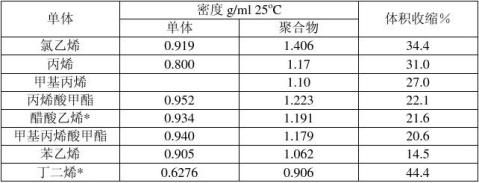
为了增大比容随温度变化的灵敏度,观察体积收缩是在一个很小的毛细管中进行,测定所用的仪器称为膨胀计(如图所示)。其结构主要由两部分组成,下部是聚合容器,上部连有带有刻度的毛细管。将加有定量引发剂的单体充满膨胀计,在恒温水浴中聚合,单体转变为聚合物时密度增加,体积收缩,毛细管内液面下降。每隔一定时间记录毛细管内聚合混合物的弯月面的变化,可将毛细管读数按一定关系式对时间作图。再根据单体浓度,从而求出聚合总速率的变化情况。动力学研究一般限于低转化率,在5-10%以下。
根据等活性理论,稳态,大分子链很长三个基本假定,在引发速率与单体浓度无关时,引发剂引发的聚合反应速率方程式如下:
Rp?d[M]dt?Kp(fKd[I]Kt1)2[M] (1)
式中:Kp、Kd、Kt分别为链增长反应,引发剂分解和链终止反应速率常数
[I]为引发剂浓度,[M]为单体浓度,f为引发效率。
在低转化率下,假定[I]保持不变,并将诸常数合并,得到:
15
d[M]dt
?K[M] (2)
其中:
K?K
p
(
fKd[I]K
t
1
)2
经积分得:
In[M]0[M]t
?Kt
(3)
式中:[M]0、[M]t各为单体的起始浓度,t时浓度。
设膨胀计的体积(即苯乙烯的起始体积)为V0,苯乙烯完全聚合后的体积为V∞,则(V0 -V∞)就是苯乙烯转化成聚苯乙烯总的体积收缩量,而t时刻所能达到的体积收缩量为(Vt -V∞),由于(V0 -V∞)和(Vt -V∞)分别与单体的起始浓度[M]0和t时剩下的苯乙烯浓度[M]t,将它们分别代入(3)式得:
In
V0?V?Vt?V?
?Kt
(4)
由于膨胀计毛细管的刻度是长度单位,故将上式分子、分母分别除以毛细管的横截面积即变换成长度:
In
L0?L?Lt?L?
?Kt
(5)
L0?L?Lt?L?
由(1)式可知,聚合反应速率对单体浓度为一级反应。则In对t作
图为一直线,其斜率等于K,而单体浓度已知,这样根据(2)式就可以计算出反应速率Rp,又因为:
K?K
p
(
fKd[I]K
t
1
)2
(6)
假定引发效率f为0.8,Kd值在《偶氮二异丁腈分解速率的测定》的实验中已测得,[I]的浓度已知。将这些数值代入上式,就可以求得(
KK
1pt
)2
值。这是一个
KK
1pt
重要数值,它反映了聚合反应的特征,在相同引发效率下,聚合速率与(成正比。
三、主要仪器和试剂
苯乙烯 偶氮二异丁腈(重结晶) 乙醚 膨胀计 锥形瓶 温度计 恒温水浴
16
)2
值
四、实验操作
在干净的150ml锥形瓶中,用移液管取比膨胀计体积稍多的新蒸馏的苯乙烯,准确取0.1%的偶氮二异丁腈(重结晶),待溶解完全后,小心装满膨胀计,达到毛细管最下面的刻度即可,将膨胀计的活塞封死,不能漏液。然后将膨胀计固定在80±0.1oC的恒温水浴中,使毛细管伸出到外面。此时,膨胀计的苯乙烯受热膨胀,沿毛细管上升,充满后将溢出的苯乙烯用滤纸拭去。
苯乙烯液体一经达到热平衡,体积开始缩小。此时应注意观察,从开始收缩时,作为零时,同时开动秒表,每隔一分钟,记录一次液体弯月面的刻度,直至液体通过毛细管的全部刻度。
实验一结束,就应取出膨胀计,倒出聚合混合液,小心用乙醚反复清洗三次。以防进一步聚合堵塞毛细管。洗净后,放入烘箱中烘干,留作下一组用。
五、数据处理
1.计算Lo值,即苯乙烯的起始体积所能装满的毛细管的高度
Lo?
VoA
Vo为膨胀计的体积,可由在一定温度下装满水的重量之差求出,或者通过滴定管滴定。A为毛细管的横截面积,也可由吸入一定长度的汞柱的重量差求得(这两个数据由老师给出)。
2.计算L∞值,即完全聚合聚苯乙烯的体积所能装满的毛细管的高度。
L??
V?A
苯乙烯重量聚苯乙烯密度
Vo?d(苯乙烯,80C)d(聚苯乙烯,80C)
oo
而V?
?=
不同温度下苯乙烯和聚苯乙烯的密度如下:

D苯乙烯=0.9240-0.000918t(C)
17
4.作图
选择时间间隔相同的实验数据,以In线,其斜率就是K。
最后分别求出聚合反应速率Rp和常数(
KK
1pt
L0?L?Lt?L?
对时间t作图,应得到一条直
)2
之值。
六、注意事项
1.加入引发剂的量是以苯乙烯的重量为基准的,力求计算和称量准确,否则影响实验数据。
2.使用和清洗膨胀计应十分小心,不要损坏仪器。
3.实验一结束,就应立即清洗膨胀计,以免聚合物堵塞毛细管。
4.实验结束后,应等膨胀计凉至室温再拧开旋钮,否则膨胀计易损坏。
七、思考题
1.实验求出的(
KK
1pt
)2
值,除了推导动力学的三个基本假定外,在处理时还使用
了哪些假定?
2.讨论本实验引起误差的主要原因及改进意见。
3.本体聚合的特点是什么?本体聚合对单体有何要求? 4.对于高转化率情况下的自由基聚合反应能用此法研究吗?
参考资料
1.《高分子化学》,浙江大学、天津大学合编。 2.《高分子化学实验室制备》,E.L.麦卡弗里著,科学出版社 3.《聚合物的合成与表征技术》西德D.布劳恩等著,黄葆同等译。
18
19
-
实验四 丙烯酰胺水溶液聚合
高实验四分子化学实验报告丙烯酰胺水溶液聚合丙烯酰胺水溶液聚合一实验目的1掌握溶液聚合的方法及原理2学习如何正确的选择溶剂3掌握丙烯…
-
丙 烯 酰 胺 的 水 溶 液 聚 合
丙烯酰胺的水溶液聚合一实验目的1掌握溶液聚合的方法及原理2学习如何正确的选择溶剂二实验原理与本体聚合相比溶液聚合体系具有粘度低搅拌…
-
丙烯酰胺水溶液聚合
高分子化学实验报告09高分子1班实验四四丙烯酰胺水溶液聚合一实验目的1掌握溶液聚合的方法及原理2学习如何正确的选择溶剂二实验原理与…
-
丙 烯 酰 胺 的 水 溶 液 聚 合-思考题
丙烯酰胺的水溶液聚合一实验目的1掌握溶液聚合的方法及原理2学习如何正确的选择溶剂二实验原理与本体聚合相比溶液聚合体系具有粘度低搅拌…
-
实验五_丙烯酰胺的水溶液聚合
实验五丙烯酰胺水溶液聚合一实验目的1掌握溶液聚合的方法和原理2学习如何选择溶液3掌握聚合物的处理方法二实验原理将单体溶于溶剂中而进…
-
实验报告2 SDS-聚丙烯酰胺凝胶电泳法
实验二SDS聚丙烯酰胺凝胶电泳法SDSPAGE测定蛋白质的分子量1原理11聚丙烯酰胺凝胶的性能及制备原理111性能聚丙烯酰胺凝胶的…
-
实验四 丙烯酰胺水溶液聚合
高实验四分子化学实验报告丙烯酰胺水溶液聚合丙烯酰胺水溶液聚合一实验目的1掌握溶液聚合的方法及原理2学习如何正确的选择溶剂3掌握丙烯…
-
丙 烯 酰 胺 的 水 溶 液 聚 合
丙烯酰胺的水溶液聚合一实验目的1掌握溶液聚合的方法及原理2学习如何正确的选择溶剂二实验原理与本体聚合相比溶液聚合体系具有粘度低搅拌…
-
丙烯酰胺水溶液聚合
高分子化学实验报告09高分子1班实验四四丙烯酰胺水溶液聚合一实验目的1掌握溶液聚合的方法及原理2学习如何正确的选择溶剂二实验原理与…
-
实验四:丙烯酰胺水溶液的聚合
高分子实验四丙烯酰胺水溶液聚合化学实验报告一实验目的1掌握溶液聚合的方法及原理2学习如何正确的选择溶剂二实验药品仪器及装置药品丙烯…