药读后感
读书
今天在书店里买了一本鲁迅写的《朝花夕拾·呐喊》的书。我读了其中的一篇叫《药》的文章,让我深有体会。
这篇文章主要写了老栓为了医好小栓的痨病而听谣言,相信了人血馒头可以治痨病,不惜大把大把的银子,在茶馆中卖力工作 , 为
人血馒头,这是一
的父爱。
唉,但是吃过人血馒头的小栓还的就是替儿子买来种何等伟大而无奈是死了。同时 , 在这个城市的另一边-古轩亭口 , 鲜血的来源者是一位叫夏瑜的青年 , 因为参加推翻满清运动而被斩首。在凄凉的坟场上,只剩两个失去爱子的母亲,无限的伤痛··
这种迷信体现了当时中国社会中处处充斥的愚昧、无知和迂腐。也说明了当时老百姓的纯朴。
这篇文章作者鲁迅先生用一群愚昧无知的小人物 , 来暗喻封建中国的社会中,有一群可悲的人民 ,它们的无知使他们无法对革命主张产生认同,不但平白牺牲许多有抱负的青年,更阻碍了社会的进步,其结果也使自己不断挣扎在困顿的生活中,鲁迅认为这些人既可悲又可怜。
我觉得在现实生活中不能听信谣言,要相信科学,没有什
么是科学解释不出来的。
第二篇:药品注册现场核查管理规定读后感
以下内容仅为个人学习《药品注册现场核查管理规定》的体会,梳理出相关内容,供同行学习交流与讨论。标准解释应以国家局注册司的解释为准。
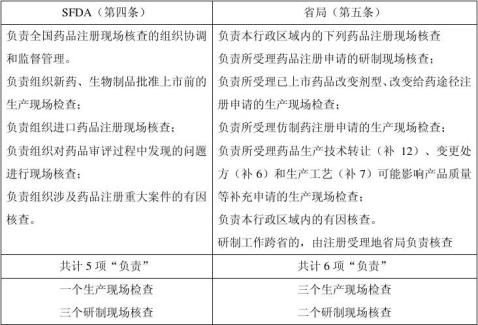
一、总 则
常规
现场核查分
有因
研制情况实地确证
研制现场核查 原始记录审查
现场核查分 确证申报资料真实性、准确性和完整
(常规) 样品批量生产过程等实地检查
生产现场检查 核定(药审中心) 生产工艺相符合 申报(申请人)
提示:非常有必要认真学习理解执行好《药品注册现场核查要点及判定原则》(附件1),下简称《判定原则》
现场有因核查:具体条件见第3条规定
二、职责分工
三、药品注册研制现场核查
药物临床前研究现场核查药学研究现场核查 抽样3批 药理、毒理研究现场核查 (生物制品) 临床试验现场核查
(省局) 药物临床试验现场核查 临床试验用药物制备条件现场核查
抽查临床用药品
样品试制情况现场核查
对药学、药理毒理等研究发生变化的内容现场核
查
注:提出注册申请时,同时提交《药品研制情况申报表》
重点关注:申报资料的真实性、准确性和完整性,与原始记录是否有一致性
对申报生产研制情况实施现场核查
申报生产研制现场核查 抽样3批(生物制品除外)
(省局) 《药品注册研制核查报告》(附件3)和申报资料送交药审中心
核查依据:《判定原则》(附件1)
重点关注:药品生产企业的设施、设备以及生产批量与其生产条件的匹配性;申报的工艺与实际生产工艺的符合性。
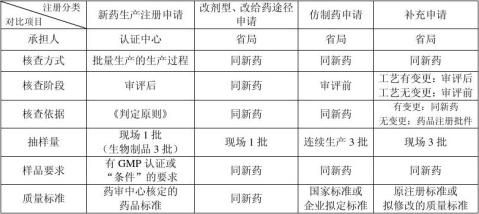
四、药品注册生产现场检查
核定的生产工艺(药审中心提供)的可行性
样品批量生产过程等进行生产现场检查
新药注册生产现场检查 现场检查时抽样1批(生物制品3批),质量标准应由药审中 (认证中心) 心提供
《药品注册生产现场检查报告》(附件5)(未发布)送交药
审中心
核查范围:见《判定原则》
重点关注:生产现场检查所涉及的内容与其资料的真实性;
批量生产与其生产条件和能力的匹配性;
批量生产的工艺规程与核定的工艺、处方及质量标准的一致性;
设备、工艺验证数据对工艺参数的支持性;
生产过程GMP的符合性;
避免交叉污染措施的可行性。
核定的生产工艺(药审中心提供)的可行性 改剂型、改给药途径生产现场检查 样品批量生产过程等进行生产现场检查
(省局) 现场检查时抽样1批(质量标准应由药审中心提供) 《药品注册生产现场检查报告》(附件5)送交药审
中心
核查范围:见《判定原则》
重点关注:同新药
两个申请同时提交(注册和现场)
仿制药生产现场检查 对样品批量生产过程等进行生产现场检查
(省局) 3批样品
《药品注册生产现场检查报告》(附件5)和申报资料送交药审
中心
核查范围:见《判定原则》
重点关注:批量生产的工艺规程与申报的工艺、处方及质量标准的一致性;
其他同新药。
《药品补充申请表》、申报资料、
前提条件: 《药品注册生产现场检查申请表》
生产工艺未发生变更的 一并(相当于仿制药)报省局
补充申请生产现场检查 (笔者理解多指“技术转让”) 对样品批量生产过程等进行生产现场检查
(省局) 核查依据:药品注册批件 抽样3批(未分类别,未要求“连续”) 技术转让 《药品注册生产现场检查报告》(附件5)和申 变更处方 报资料送交药审中心
变更生产工艺 《药品补充申请表》、申报资料
反之: 中心审评后发出生产现场检查通知至省局 生产工艺发生变更的 对样品批量生产现场检查
核查依据:《判定原则》 抽样3批样品(未分类别,未要求“连续”) 重点关注:同新药 《药品注册生产现场检查报告》(附件5)和申
报资料送交药审中心
五、小 结
各类注册生产现场检查对比表
六、药品注册检验抽样要求
抽取量:全检量的3倍(不分贵重与否) 样品要求 装量:按每1倍单独签封
登记手续:抽样人员 签名、盖公章 被抽样单位有关人员
填写《药品注册抽样记录单》(签名、盖章)
七、其 他
1、检查人员:2人以上+1名省局观察员
2、如果对检查结果有异议,可在5日内直接向派出检查组的部门(认证中心)或药监部门提出申述
3、核查中发现问题,必要时应予取证(复印、拍照、录像等是常用的方式)
-
读XX本书读后感
在我拿起这本书名字叫麦田里的守望者我没有想到这么薄的一本书会产生这么大影响在我心中产生这么大的影响一个少年形象出现在我的脑海中他是…
-
读读后感
读小学生之友有感白马桥乡中心小学六班李诗琦指导老师江芳兰读书使人善于思考读书使人深刻使人睿智书给了人成长与精神的营养这本小学生之友…
-
阅读经典读后感
我心中的榜样读西游记有感西游记是我国四大名著之一它是明朝末年吴承恩写的这部小说讲述的是唐僧师徒四人去西天取经的故事在去西天的路上有…
-
教师读一本好书读后感
教师读一本好书读后感教师读一本好书读后感挤出时间读点书吧只有这样你才能偶尔遭遇好书一个人与一本书之间冥冥中有一种缘份读书对于我们教…
-
《怎样读书》读后感
怎样读书读后感看了胡适先生的怎样读书一书得到一些感悟胡适先生在书中提到读书可以有三种说法一要读何书这个问题不易解决因为个人的见解不…
-
小学生鲁迅读本读后感
小学生鲁迅读本读后感篇一小学生鲁迅读本gt读后感暑假里我一直在读一本书小学生鲁迅读本是刘发建先生编写的从开始到结束我一直被一座中学…
-
鲁迅全集读后感
1读野草有感有谁不珍爱自己的青春星月蝶杜鹃虚无的名利红颜的静女然而对于一代文豪鲁迅先生而言这一切却又是多么地quot悲凉缥缈quo…
-
《鲁迅传》读后感
中华民族坚强的精神脊梁读鲁迅传周棹帆读中学的时候学过好几篇鲁迅先生的文章如狂人日记药阿Q正转等等总是感觉老先生的文章晦涩难懂乏味拗…
-
民族魂——读鲁迅有感
民族魂鲁迅读鲁迅文集有感鲁迅是中国的民族魂毫不夸张的说他书写了近代中国的历史和文化他犀利的笔触觉醒了一代又一代的中国青年人与其说他…
-
《鲁迅》读后感
看客繁华的东门处处华灯高照一派歌舞升平的景象已经是夜晚8点东门的街道上仍然是熙熙攘攘川流不息我低着头背着一个大书包随着人流缓缓前进…
-
《你在为谁工作》读后感 药剂科
《你在为谁工作》读后感(药学人员)《你在为谁工作》这本书中提出了人人都需要自我反思的人生问题,并对这个问题进行了深刻细致的解答,它…