热传递教学反思
《热的传递》一课教学反思
刘成波
《热的传递》这节课,首先我是以学生日常生活中常见的现象进行导入,在充分调动学生积极性的同时,提出问题:热在固体、液体、气体中都是怎样传递的?由此引出本课的重点:研究热传递的三种方式:传导、对流、和辐射。由于时间的问题,我就本节课中最重要的也是最容易出问题的传导这个实验的设计,结合课堂呈现的效果做如下反思:
一.材料的选择:教材中,传导这个实验是用金属棒粘上火柴进行加热,观察火柴掉落的顺序。离火源越近越先掉落,越远越后掉落。
二.实验的设计:为了体现热在固体中是从温度高的地方传到温度低的地方,我引导学生先作猜想,并画出示意图,讲解从一端或者中间加热两种方式,引导学生从温度上加以区分,从而得出热在固体中传递的规律:如果从一端加热,热向另一端传递;如果从中间加热,热向两端传递。
三.效果:从本节课的教学效果来看,学生在实验时,基本上能按操作步骤进行。通过让学生动手实验和教师的演示实验,培养了学生的动手操作能力和观察能力、发现问题的能力;也通过了让学生交流、汇报,来培养学生的概括能力和口头表达能力。但学生的语言表达上有点欠缺。
第二篇:反应热教学反思
反应热教学反思
宁化一中 刘敏华
反应热在近几年的全国卷和各地高考试卷中频繁出现,是一个非常“热”的考点。学生对此知识点较难掌握,在考试中易失去宝贵的分数,甚至与大学失交臂,令人遗憾、痛心。在近几年的高三及高二(鲁科版)的教学中,我尝试着从以下几个方面着手,取得了较好的效果。
一、透彻讲解概念是前提
在学习反应热时,正确讲透“三热”(即反应热、中和热、燃烧热)的概念,对于学生理解、掌握、应用至关重要,是学好反应热的前提。
在人教版全日制普通高级中学教科书(必修加选修)中分两节对此知识作了详细的阐述,而在现今使用的鲁科版《化学反应原理》中,虽未提及中和热和燃烧热的概念,但活动与探究中“测定中和反应的反应热”也说明中和热、燃烧热仍有讲解的必要。对于“三热”复习时,可列表比较如下:
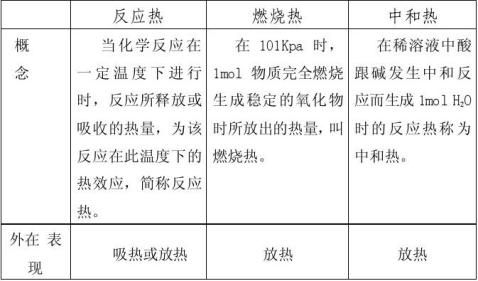

通过列表比较后,再配以适当的练习,发:①lmol H2SO4与lmol Ba(OH)2完全中和所放出的热量是中和热吗?②在1O1kPa时,lmol碳燃烧放出的热量称为碳的燃烧热,这样说对吗?应该把它们如何改动才对呢?通过一些代表性练习后,对于概念就能很好的理解。
二、正确书写热化学方程式是基础
书写热化学方程式是在学习反应热当中的重要一个环节,也是考试中常考的重要知识点。在书写热化学方程式时,要注意以下几点:
(1)要在反应物和生在物的化学式后面用括号注明各物质的聚集状态。因为反应的焓变与各反应物和生成物的聚集状态有关,一般用英文字母g,l和S分别表示气态、液态和固态,水溶液中的溶质则用aq表示。
(2)在△H后要注明反应温度,因为同一反应在不同的温度下进行时,其焓变是不同的。对于298K时进行的反应,可以
不注明反应的温度。
(3)△H的单位是J/mol或KJ/mol
(4)根据焓的性质,若化学方程式各物质的量的系数加倍,则△H数值的绝对值也加倍。若反应逆向进行,则△H的数值改变符号,但绝对值保持不变。
以上四条相辅相成,缺一不可,但学生在书写热化学方程式的过程中常常丢三落四,正负问题,系数扩大或缩小问题,状态问题等缺乏考虑,一着不慎,满盘皆输。在讲解时首先要让学生明白各要点的意义。其次让学生明白各点的重要性,正负不是数学意义,而是表示吸热与放热。再次提醒学生写完后一定要按以上四条加以检查,确保无误。
近几年的高考中,书写热让学方程式的试题可以说俯拾皆是,如07年理综 (天津卷)中第29题的第二小题,若灼烧6gFeS2业的SO2全部转化为SO3气体时放出9.38KJ热量,产生的SO3与水全部化合生成H2SO4,放出13.03KJ的热量,写出SO3气体转化为H2SO4的热化学方程式:_____________。
把热化学与方程式的简单计算相结合,既考查了学生的基础,又考查了学生的思维能力和审题能力。
三、全面理解实质是解题的关键
化学反应的实质是旧建的断裂和新键的形成。在断裂旧的过程中,必须吸收能量,而在形成新的化学键的同时也会伴随着能量的释放。由于反应物和生成物本身的键能不同,导致反应中有热效应。△H在理论上是等于反应物的总键能减去生成物的总键能。当生成物的形成所释放的总能量化反应物断裂化学键吸收的总能量大时,就是放热反应,△H为负值,反之,则是吸热反应,△H为正值。且某物质的键能越大,该物质内
部的能量越低,该物质越稳定。
例如,曾有这样一个考题。信息1:通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能,键能的大小可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。

构为:
(3)S2Cl2的结构类似于H2O2,最外层均达到8e,其结构式为_______
根据以上信息,写出制取S2Cl2 的热化学方程式_______ 解析:本题是以信息的形式加以考核,硫的分子S8中含有8个S-S键,同时应有4个Cl2发生反应,生成4个S2Cl2分子,所以也应断裂4个Cl-Cl键,从而可以求出断键时所消耗的能量。形成4个S2Cl2分子时形成8个S-Cl键和4个S-S键,所以总的焓变应为(4×243+8×266-8×272-4×266)kJ,由是热化学方程或为4Cl2(g)+S8(s)=4S2Cl2(l) △H= -140kj/mol。
四、灵活运用盖斯定律是技巧
盖斯定律在旧教材中是作为阅读材料,让有兴趣的同学阅读领会。而在鲁科版教材中是作为教材的一个必讲的教学内信息2:(1)硫的分子式实为S8,是一个八元环分子,其结
容,运用在应焓变的计算上,也可以看出新版教材对此知识点的要求有所加深。在解答有关反应热的问题时,要注意盖斯定律的应用。此定律指出对于一个化学反应,无论是一步完成还是分步完成,其反应的焓变是一样的。这就好比人们在登山时,往往有很多条路可以选择,但不论选择哪条路,从山脚爬到山顶,上升的高度总是相同的。
运用此定律,不仅可以推知一些难以直接测定的化学反应的反应热,还是高中与大学《物理化学》知识的连接点。在运用盖斯定律时,我注重引导学生分析目标方程式与已知方程式的关系,运用书写热让学方程式注意点之四,对已知热化学方程式加以变形。
例如:已知C(s) +O2(g)=CO2(g) △H1=-393.5 KJ /mol…… 2H2(g)+O2(g)= 2H2O(l) △H2=-571.6KJ/mol…… 2H2(g)+502(g)=4CO2(g)+2H2O(l) △H3=-2599KJ/mol…… 计算2C(S)+H2(g)=C2H2(g)的反应焓变。
解析:目标热化学方程式中含有2个C(s),所以把①×2,含有1个H2(g),所以②÷2;目标热化方程式的生成物中只有1个C2H2(g),所以③÷2,再把反应物与生成物颠倒,将所得的各式相加即可求出目标反应的反应焓变。
五、强化训练是提升能力的保证
在理科的学习中,“做题是必不可少的,没有一定量的训练就不会有一定的熟练程度,能力的提升就变成了无本之木,无源之水。古人说“熟能生巧”并不是没有道理的。在高三学科会上也听专家讲要精讲精冻,切忌摘“题海”战术,但“题湖”战术还是要的。让学生做一定量的有针对性、代表性、典型性的题目,引导学生学会总结。每做一题或几个相似的题目,
要注意能够学会提炼题目的内涵,做到“举一反三”和“举三归一”,提高训练的效率和质量,做到事半功倍。
在选题给学生训练时结合学生所掌握的基础知识和学生易犯、常犯的错误,有的放矢。多让学生自我总结归纳,启发学生去分析解决问题,从错误中学习,从练习中提升自己的思维能力、审题能力、灵活运用知识的能力。
“得其法者,事半而功倍也”。教学是一门深奥的学问,只有通过常反思,才能发现教学中的不足,避免重蹈覆辙,提高教学效率。
参考文献
①五明如、高盘良、王磊著《化学反应原理》山东科学技术出版社。
②《中学化学》05年第二期 张银发 学习反应热时应注意几个问题。
③中国致出版社 最新3年全国各省市高考试卷总汇及详解(理综)。
-
学前班教学反思
教学改革反思随着课堂改革的不断深入自己所带的是学前班学生年龄小我自己没有耐心有急噪心理对幼儿没有起到耐心教对他们有放纵现象在今后的…
-
学前班教学反思
学前班教学反思崔俊红作为一名刚刚从幼儿园来学前班的小朋友来说,他们对任何事物都是充满了好奇,注意力不能够集中,课堂的过程又是一个比…
-
学前教育 教学反思
教学反思幼儿园社会教育课后反思周一上午是123的幼儿园社会教育社会领域的教育是幼儿园五大领域中很重要的一部分涉及了儿童社会化的问题…
-
学前班拼音教学反思
学前班拼音教学反思拼音是小学教学的第一道难关,也是小学教学中最枯燥,乏味的内容之一汉语拼音课的教学内容只有字词,没有句子,更没有故…
-
学前班数学上册教学反思(8篇)
找同类按材料分类教学反思教师尤自清找同类按材料分类是本单元的最后一课与前面6课形成一个完整的结构特别是与第1课构成相互呼应的关系在…
-
《光和影》教学设计与反思 (2)
光和影教学设计宿豫区蔡集中心小学季冬梅教材分析光和影是教科版五年级上册科学光单元的第一课是本单元的起始课从本课到第四课是研究光的传…
-
《怎样得到更多的光和热》教学反思
教科版小学五年级科学上册怎样得到更多的光和热教学反思这节课我对教材进行了处理重点让学生专注于颜色对吸收光的作用课文中要求五种颜色的…
-
《共享阳光》教学反思
共享阳光教学反思门坎初中何春伦共享阳光系九年级思想品德第三单元最后一课也是本单元的落脚点学生在学习了解了我国弱势群体存在的原因特征…
-
光的折射教学反思
光的折射教学反思这次我们参加全县特岗物理教师优质课的比赛本次参赛的是人教版物理八年级上册第四章第四节光的折射的教学内容光的折射是重…
-
优秀阳光教学反思
优秀阳光教学反思阳光教学反思阳光教学反思阳光教学反思阳光这篇课文以抒情的笔调诗一般的语言给我们描绘了阳光给万物带来的生机与美丽禾苗…