《盐类水解》教学反思
《盐类水解》教学反思
小时候跟着体育教师学习广播操,每一节每一个动作都要认真操练,而且是把每一节都进行分解传授。从这里也受到一些启发,我们的课堂教学也是否可以借鉴以下,注重结果固然重要,但关注过程和方法更为关键,所以在课堂教学中要正确处理好目的、过程和方法!在盐类水解的教学中,要注意以下几个循序渐进的问题。
一:对水解的理解要循序渐进
盐类的水解,根据水解的离子可以逐步进行阐述。先单一离子的水解,如醋酸钠、氯化铵等。然后两种离子的水解,有相互促进的如硫化铝、醋酸铵等,有相互抑制的,如硫酸亚铁铵。再根据促进的程度,分促进的厉害的和轻的等。 二:对水解的应用要循序渐进
水解的应用种类较多,一气学完,不利于学生的消化和吸收。可以借助教材如利用碳酸氢钠和硫酸铝溶液的双水解讲授灭火,借助氯化亚锡的实验引出配制三氯化铁,借助硫化铝的水解讲述物质的制备,借助醋酸钠的实验讲述热碱去污等等,这样分开处理就可达到循序渐进的目的。
三:对水解方程式的书写要循序渐进
根据水解离子的多少,水解方程式的书写也要做好分解讲授。先写单一离子水解的,再写多元弱酸、弱碱离子水解的,再写阴阳离子都水解的。这样,学生在理解和掌握上就能降低难度,易于掌握。
可见,一气呵成是魄力,但循序渐进,分步进行也不失为一种艺术。
第二篇:盐类的水解规律(教案)
盐类的水解规律(教案)
教学目标:
1.使学生理解盐类水解的实质,能解释强碱弱酸盐和强酸弱碱盐的水解。
2.能通过比较、分类、归纳、概括等方法得出盐类水解的规律,揭示盐类水解的本质。
3.能运用盐类水解的规律判断盐溶液的酸碱性,会书写盐类水解的离子方程式。
教学重点:盐类水解的本质
教学难点:盐类水解方程式的书写和分析
教学过程:
【导课】生活中如果遇到火灾怎么办?
打119,找水源,找泡沫灭火器·····
【切题】泡沫灭火器的使用:倒置,喷出大量泡沫隔绝空气灭火。灭火器的成分是硫酸铝和碳酸氢钠溶液,为什么倒置可以产生二氧化碳和氢氧化铝?,请听《盐类的水解》
[问题引入] 酸溶液显酸性,碱溶液显碱性,盐溶液一定显中性吗?如何设计实验证明?
一、探究盐溶液的酸碱性:(常温,中性溶液PH=7,判断溶液酸碱性最简易方案:用PH试纸测PH)
【活动与探究】用pH试纸检验下列两组溶液的酸碱性:【学生实验】
(一)NaCl、 NH4Cl、CH3COONa(二)AlCl3、Na2CO3、Na2SO4、
盐 的 类 型 (从生成该盐的酸和碱的强弱分)
【讨论】为什么不同的盐溶液的酸碱性不同?由上述实验结果分析,盐溶液的酸碱性与生成该盐的酸和碱的强弱间有什么关系?
盐的组成:
酸 + 碱 = 盐+ 水

 强酸 强碱 强酸强碱盐 如:NaCl KNO3
强酸 强碱 强酸强碱盐 如:NaCl KNO3
 强酸弱碱盐 NH4Cl Al2(SO4)3
强酸弱碱盐 NH4Cl Al2(SO4)3
 弱酸 弱碱 弱酸强碱盐 CH3COONa Na2CO3
弱酸 弱碱 弱酸强碱盐 CH3COONa Na2CO3
弱酸弱碱盐 CH3COONH4
△正盐的组成与盐溶液酸碱性的关系:(谁强显谁性,都强显中性)
①强碱弱酸盐的水溶液 显碱性 c(H+)< c(OH—)
②强酸弱碱盐的水溶液 显酸性 c(H+)> c(OH—)
③强酸强碱盐的水溶液 显中性 c(H+)= c(OH—)
【总结归纳】 盐类水解规律:有弱才水解,无弱不水解,谁强显谁性,都强显中性,多弱具体定。
练习1:推测以上活动与探究中(二)组溶液的酸碱性,并用实验验证。
【讨论】 ①正盐溶液中为什么含有H+、OH—?
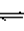 盐溶液中存在水的电离平衡:H2O H+ + OH—
盐溶液中存在水的电离平衡:H2O H+ + OH—
②为什么不同正盐的水溶液中c(H+)、c(OH—)大小关系会不同?酸碱性不同?
说明水的电离平衡受到了破坏。
结合实验结果具体分析:
【讨论】1.CH3OONa溶液 (显碱性,为什么?)
CH3OONa=CH3OO— + Na+
+
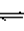 H2O H+ + OH—
H2O H+ + OH—

CH3COOH
①总的化学方程式
②总的离子方程式
③溶液中_____(有或无)弱电解质(化学式: )生成,水的电离平衡__________(被破坏或不受影响),并向 方向移动,因而 (促进、抑制)了水的电离。C(H+) C(OH—)(填“>”“<”或“=”),呈 性。
【讨论】2。NH4Cl溶液(显酸性,为什么?)
NH4Cl = Cl— + NH4+
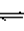 +
+
H2O H+ + OH—
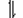
NH3?H2O
①总的化学方程式
②总的离子方程式
③溶液中_____(有或无)弱电解质(化学式: )生成,水的电离平衡__________(被破坏或不受影响),并向 方向移动,因而 (促进、抑制)了水的电离。C(H+) C(OH—)(填“>”“<”或“=”),呈 性。
【讨论】3。NaCl溶液(中性,为什么?)
溶液中_____(有或无)弱电解质(化学式: )生成,水的电离平衡__________(被破坏或不受影响),C(H+) C(OH—)(填“>”“<”或“=”),呈 性。
二、盐的水解:
1、定义:这种在水溶液中盐电离出来的离子跟水所电离出来的H+或OH—结合生成弱电解质的反应,叫做盐类的水解。
2、盐的水解实质:弱酸根离子与H2O 电离出的H+结合生成弱酸或弱碱的阳离子与H2O 电离出
的OH—结合生成弱碱,破坏了水的电离平衡,使这正向移动,使溶液中C(H+) 与C(OH—)
不等,显酸性或碱性。
水 解
即: 盐 + 水  酸 + 碱
酸 + 碱
中 和
3、盐类水解反应是酸碱中和反应的逆过程。
4.盐类水解的规律:有弱才水解,无弱不水解,越弱也水解,谁强显谁性,都强显中性,都弱具体定。
5、水解方程式:(阅读P75—76的信息提示,总结书写水解方程式的注意点)
①盐类水解是可逆反应,反应方程式中要写“ ”号。
”号。
②一般盐类水解的程度很小,水解产物很少。通常不生成沉淀或气体,也不发生分解。在书写离子方程式时一般不标“↓”或“↑”,也不把生成物(如H2CO3、NH3?H2O等)写成其分解产物的形式。
③多元弱酸的盐分步水解,以第一步为主。
例:Na2CO3的水解
第一步:CO32— + H2O  HCO3— + OH—(主要)
HCO3— + OH—(主要)
第二步:HCO3— + H2O  H2CO3 + OH—(次要)
H2CO3 + OH—(次要)
【拓展】为什么泡沫灭火器可以让硫酸铝溶液和碳酸氢钠溶液混合生成氢氧化铝和二氧化碳呢?
铝离子可以水解呈酸性,碳酸氢根离子可以水解呈碱性,两溶液混合相互促进水解,反应进行得
很彻底,这种叫双水解反应,方程式书写用“等号”而不是“可逆号”,产生氢氧化铝以沉淀形式出现,二氧化碳逸出。 【详见课本P79拓展视野:盐类水解与泡沫灭火器】
【问题解决】课本P76
1、________________________________________________________________
________________________________________________________________
2、________________________________________________________________
________________________________________________________________
【总结】

【巩固练习】判断下列盐溶液的酸碱性,若该盐能水解,写出其水解反应的离子方程式。
(1)KF (2)NH4NO3 (3)Na2SO4 (4)CuSO4
-
《盐类水解》教学反思
盐类水解教学反思小时候跟着体育教师学习广播操每一节每一个动作都要认真操练而且是把每一节都进行分解传授从这里也受到一些启发我们的课堂…
-
盐类水解教学反思
盐类水解教学反思盐类水解这个知识点既是高考的重点又是高考的难点本节教材涉及的知识面较宽综合性较强是前面已学过的离子反应电解质的电离…
-
盐类的水解教学反思
盐类的水解教学反思倪维能准备这次集体备课我收获了很多深刻地体会到要真正上好一节课真的很不简单编写的教案和制作的课件在备课组成员的帮…
-
盐类水解教学反思
盐类水解教学反思郭正刚本节课首先引导学生根据溶液酸碱性与溶液中HOH浓度的关系这一核心思路综合应用第1节的知识和弱电解质电离平衡的…
-
盐类的水解教学反思
盐类的水解教学反思安丰中学化学组准备这次备课我收获了很多深刻地体会到要真正上好一节课真的很不简单编写的教案和制作的课件在备课组成员…
- 公开课--盐类的水解_教学设计
-
人教版选修4:盐类的水解 影响盐类水解的主要因素和盐类水解反应的利用 教学设计
第三章水溶液中的离子平衡第三节盐类的水解课时2影响盐类水解的主要因素和盐类水解反应的利用化学学院20xx级4班丁弘正20xx210…
-
盐类的水解教学反思
盐类的水解教学反思倪维能准备这次集体备课我收获了很多深刻地体会到要真正上好一节课真的很不简单编写的教案和制作的课件在备课组成员的帮…
-
盐类水解教学反思
盐类水解教学反思盐类水解这个知识点既是高考的重点又是高考的难点本节教材涉及的知识面较宽综合性较强是前面已学过的离子反应电解质的电离…
-
盐类水解教学反思
盐类水解教学反思郭正刚本节课首先引导学生根据溶液酸碱性与溶液中HOH浓度的关系这一核心思路综合应用第1节的知识和弱电解质电离平衡的…