高一化学《化学反应的速率》教学反思
高一化学《化学反应的速率》教学反思
看了有关《化学反应速率》的视频后,有很大的感触,对于自己在教学上有一定的促进作用。在进入本课堂的内容之前,老师先通过多媒体播放图片(爆炸,溶洞)来提出问题。哪个反应快慢?来引出今天要讲的化学反应速率。这是值得我学习的地方,通过生活中的现象,让学生更直观的理解。引出反应速率后再以提问的方式把学生带回课本,让学生阅读课本上的内容来回答有关反应速率的定义、表达式和单位。提高学生的自主能力。然后再通过简单的计算题来教学生利用化学反应速率的表达式进行运算。印象较深的是,在进行计算的时候,利用学生的错误回答深入到对化学反应速率定义的理解。再次强调化学反应速率是对于浓度的变化量。然后正确的和学生讲解三段式的解法。让学生求其他的反应速率,通过学生自己在求解的过程中发现计量系数之比和浓度变化量之比的关系。再引入影响化学反应速率的因素通过日常生活中要想牛奶不变质的方法,来引导学生,从而得出是改变了温度的因素。通过课堂的气氛可以看得出来,这样的教学是较成功的。老师在将要讲到一个知识点的时候都可以利用生活的知识来引导学生,让学生一步一步的跟上老师的步伐。只有不断的学习才会不断的进步,看了老师的视频后,更知道自己应该如何去改进自己教学上的问题,从而达到更好地教学效果。做一个自己喜欢自己,学生喜欢自己的老师。
第二篇:高一化学教学案:化学反应速率和限度2
江苏省西亭高级中学高一化学教案
高一化学教学案 课题:化学反应速率和限度②
[知识与技能]:1、了解可逆反应、化学反应限度的涵义
2、初步了解影响化学反应限度的因素,初步学会根据反应速率判断化学反应所能达到的
限度。
3、了解人类如何利用和控制化学反应,了解提高燃料的利用率的方法和措施。
[过程与方法]:1、重视培养学生的科学探究的的基本方法,提高科学探究的能力。
2、通过实验探究,让学生发现问题,逐步形成了化学反应限度的概念,并以上述观点为指
导去分析和解决实际问题。
[教学重点]:反应限度概念;了解影响化学反应限度的因素。
[教学难点]:化学反应限度的本质原因及外部特征。
[教学过程]:
[复习提问]:1、
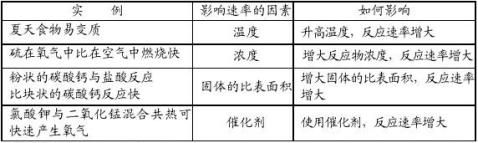
[问题情境]: 那么,在实际反应中,反应物能否按相应的计量关系完全转化为生成物呢?
[教师精讲]:不能,因为大多数反应都存在一定的可逆性。在一定条件下反应能进行到什么程度?这就是
我们这一节所研究的主要问题—化学反应的限度。
[板 书]:二、化学反应的限度
[科学史话]: P50─在化学的发展史上,有一件与之有关的事曾经引起了化学家极大的兴趣。(炼铁高炉
尾气之谜)。
[讲解分析]: 科学研究表明,不少化学反应都具有可逆性,即正向反应(反应物→生成物)和逆反应(生
成物→反应物)都能同时进行,那么,象这样的反应叫可逆反应
[板 书]:1、可逆反应
(1)、定义:_____________________________,如:_______________
-(2)、说明:有些反应可逆性很小,如:Ag++Cl=AgCl,我们只视作“不可逆而已”(AgCl
-+在溶液中仍有微弱的电离:AgCl =Ag+Cl)。
[典型例题]:1、P51的思考与教流。
182、对于可逆反应2SO2+O2 3,在混合气体中充入一定量的O2足够长时间后,
18O2原子 ( D )
A、只存在于O2中 B、只存在于SO3和O2中
C、只存在于SO2和O2中 D、存在于SO2、SO3和O2中
[问题探究]: 可逆反应在一定条件下反应物不能完全消耗,存在着一个反应程度的问题,请分析当反
应达到最大限度时,化学反应所表现出来的特征?(从速率、物质的浓度两方面来分析)
[教师精讲]: 反应开始时,反应物浓度最大,正反应速率最大;生成物浓度为零,逆反应速率为零。
随着反应的进行,反应物浓度降低,正反应速率减小;生成物浓度增大,逆反应速率增大。
当正反应速率等于逆反应速率时,反应物浓度和生成物浓度不再发生改变,达到表面静止的
状态——平衡状态。
[归纳小结]:2、化学反应的限度——化学平衡状态
当一个可逆反应进行到 速率与 速率相等时, 和 的浓度不再改变,达到表面
上 的一种“平衡状态”,我们称为“化学平衡状态”,这就是这个反应所能达到的限度.
[提 问]: 反应所能达到的限度有几个主要特征?
[归纳小结]:3、反应所能达到的限度主要特征:(1)正反应速率与逆反应速率相等(2)反应物与生成物
浓度不在改变(3)混合体系中各组分的质量分数不在发生变化(4)条件变,反应所能达到的限度发生变化。
[典型例题]:例3、可逆反应达到平衡的重要特征是 ( D )
1
江苏省西亭高级中学高一化学教案
A、反应停止了 B、正、逆反应的速率均为零
C、正、逆反应都还在继续进行 D、正、逆反应的速率相等
例4、下列说法正确的是 ( A )
A、无论怎样控制反应条件,2molSO2与1molO2反应都不会生成2molSO3
B、任何化学反应中的反应物都能全部转化成生成物
C、化学反应的限度决定于反应物的性质,与外界的条件无关
D、可逆反应中,使用催化剂只能增大正反应的化学反应速率
例5、在一定温度下,可逆反应X(g)+3Y

2Z(g)达到平衡的标志是( AC )
A、Z生成的速率与Z分解的速率相等
B、单位时间生成a mol X,同时生成3a mol Y
C、X、Y、Z的浓度不再变化
[探讨交流]: 阅读科学史话-炼铁高炉尾气之迷,当高炉高度增加,为什么CO浓度比例没发生变化?
[教师精讲]:反应条件不变,反应所能达到的限度相同,反应物与生成物浓度不在改变,CO浓度比例不发
生变化。
[过 渡]:在生产和生活中,人们希望促进有利的反应,抑制有害的反应,这就设计到反应条件的控制。
[板 书]:三、化学反应条件的控制
[指导阅读]: P52建筑物定向爆炸胶片,根据建筑物定向爆炸及实验室或生活中的化学反应,探究要
使反应符合人们的期望,应如何控制反应条件?
[归纳小结]: 控制反应条件的意义:按需要改变化学反应的速率和反应限度。
[探究分析]: 煤是我国能源的主要来源,能否充分提高煤的燃烧效率对我国经济建设有重要意义。阅
读课文52页,提高煤的燃烧效率可以采取哪些措施?
1、煤的状态与煤燃烧的速率有何关系?与煤的充分燃烧有何关系?
2、空气用量对煤的充分燃烧有什么影响?为什么?
3、应选择什么样的炉(灶)膛材料?理由是什么?
4、如何充分利用煤燃烧后的废气中的热量?
[讲解分析]:提高燃料的燃烧效率实际上是从多方面控制燃烧反应的条件。从环境保护方面考虑,发展洁
净煤技术、减少污染物的排放、提高煤炭利用率,已成为我国及国际上的一项重要研究课题。
[归纳小结]:1、提高燃料燃烧效率的措施
①、尽可能使燃料 ,提高 的转化率.关键是燃料与 或 要尽可能充
分地接触,且空气要适当 .
②、尽可能充分地利用燃料燃烧所释放出的 ,提高热能的 .
2、提高燃料的燃烧效率实质上是从多方面控制 (包括 )它的意义在
于 、 、 (如煤在气化过程中可以脱硫、除去灰分等)。
[典型例题]:例6、下列说法不正确的是 ( D)
A、化石燃料在任何条件下都能充分燃烧
B、化石燃料在燃烧过程中能产生污染环境的CO、SO2等有害气体
C、直接燃烧煤不如将煤进行深加工后燃烧效果好
D、固体煤变为气体燃烧后,燃烧效率将更低
例7、中国燃料锅炉采用沸腾炉逐渐增多,采用沸腾炉的好处在于 ( D )
A、增大煤炭燃烧时的燃烧热并形成清洁能源,使化学反应更容易进行
B、减少炉中杂质气体(如SO2)等的形成
C、提高煤炭的热效率并减少CO的排放
D、使得燃料燃烧充分,从而提高燃料的利用率
[课堂小结]:略。
[课堂作业]:P53 1、2、4
[板书计划] 二、化学反应的限度
1、反应所能达到的限度:当一个反应进行到正反应速率与逆反应速率相等时,反应物与生成物浓度
2
江苏省西亭高级中学高一化学教案
不在改变,达到表面上静止的一种“平衡状态”。
2、反应所能达到的限度主要特征:(1)正反应速率与逆反应速率相等
(2)反应物与生成物浓度不在改变
(3)混合体系中各组分的质量分数不在发生变化
(4)条件变,反应所能达到的限度发生变化。
三、化学反应条件的控制

高一化学教学案 课题:化学反应速率和限度②
1、下列关于燃料充分燃烧的说法,不正确的是 ( A )
A.空气量越多越好 B.应通入适量的空气
C.固体燃料燃烧前要粉碎 D.液体燃料燃烧时可以以雾状喷出
2、下列说法中,正确的是 ( CD )
A.如果某一反应的反应物能量总和高于生成物能量总和,则该反应是吸热反应
B.我国目前使用最多的燃料是酒精
C.煤炭直接燃烧不仅产生大量烟尘,而且生成SO2,导致酸雨的形成
D.煤经过处理后制得水煤气、干馏煤气等,可提高燃烧效率和减少环境污染 3、下列过程中,需要增大化学反应速率的是 ( D )
A、钢铁的腐蚀 B、食物腐败 C、塑料老化 D、工业合成氨
4、在m A + n B
p C的反应中,m、n、p为各物质的计量数。现测得C每分钟增加a mol/L,B每
分钟减少1.5a mol/L,A每分钟减少0.5a mol/L,则m:n:p为( C )
A、2:3:2 B、2:3:3 C、1:3:2 D、3:1:2
5、NO和CO都是汽车尾气中的有害物质,它们能缓慢地反应生成氮气和二氧化碳,对此反应,下列叙述正确的是 ( C )
A、使用适当的催化剂不改变反应速率 B、降低压强能提高反应速率
C、升高温度能提高反应速率 D、改变压强对反应速率无影响
6、使铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( B )
A、加热 B、不用稀硫酸,改用98%的浓硫酸
C、滴加少量CuSO4溶液 D、不用铁片,改用铁粉
7、对于可逆反应M+N Q达到平衡时,下列说法正确的是 ( C )
A、M、N、Q三种物质的量浓度一定相等 B、M、N全部变成了Q
C、反应混合物各成分的百分组成不再变化 D、反应已经停止
8、在溶液中发生的反应,对反应速率不发生影响的因素是 ( B )
A.温度 B.压强 C.浓度 D.催化剂
9、面粉厂必须严禁烟火的主要原因是 ( D )
A、防止火灾发生 B、防止污染面粉 C、吸烟有害健康
D、颗粒极小的面粉扩散到空气中与空气充分接触,一旦引发反应,极易发生爆炸
10、反应 A (g) + 3B (g) = 2C(g) + 2D(g) 在不同情况下测得化学反应速率,其中最快的是 ( A )
A.υ(D) = 0.4 mol/(L·S) B. υ(B) = 0.6 mol/(L·S)
C.υ(C) = 0.5 mol/(L·S) D. υ(A) = 0.15 mol/(L·S)
11、在反应:C+CO22CO中,可使反应速率增大的措施是 ( C )
①增大压强 ②升高温度 ③通入CO2 ④增加碳的量 ⑤降低压强
A、①②③④ B、②③④⑤ C、①②③ D、②③④
12、下列措施对增大反应速率明显有效的是 ( D )
A、Na与水反应时增大水的用量 B.Fe与稀硫酸反应制取H2时,改用浓硫酸
C、在K2S04与BaCl2两溶液反应时,增大压强
D.Al在氧气中燃烧生成A1203,将Al片改成Al粉
3
江苏省西亭高级中学高一化学教案
13、(4分)在2 L的密闭容器中,充人2 molN2和3 molH2,在一定条件下发生反应,3 s后测得N2为1.9
mol,则以H2的浓度变化表示的反应速率为 。
4
-
《化学反应速率》教学反思
化学反应速率教学反思铁岭市第二高级中学化学反应速率的概念及计算依然是重点内容而影响化学反应速率的因素在新教材中只介绍了催化剂和温度…
- 化学反应速率教学设计与反思
-
化学反应速率教学反思
化学反应速率教学反思新课程里的教学难易程度一直是很难把握的本节课化学反应速率的概念及计算是重点内容而影响化学反应速率的因素在新教材…
-
化学反应速率教学反思
化学反应速率教学反思新课程倡导以quot主动参与乐于探究交流与合作quot为主要特征的学习方式这是广大教师课堂教学中所要积极探索的…
-
高一化学《化学反应的速率》教学反思
高一化学化学反应的速率教学反思看了有关化学反应速率的视频后有很大的感触对于自己在教学上有一定的促进作用在进入本课堂的内容之前老师先…
-
九年级化学期末教学反思
20xx.2初三化学期末考试反思期末考试已经结束自己以失败告终,我所任教的班优秀率第16,合格率第17,平均分第17,我很是失落。…
-
20xx-20xx(下)高三化学教学反思
20xx-20xx(下)高三化学教学反思化学组陈维清本年度我担任高三(2)班的化学教学工作,并兼高三(2)班的班主任工作。感觉压力…
-
初中化学高效课堂教学反思
初中化学高效课堂教学反思吉安县登龙中学尹庐鹰新课标下的初中化学如何围绕新课标、考纲为学生的发展上好每一节课、如何开展化学课堂的高效…
-
九年级化学教学反思
九年级化学教学反思新课程的实施给学校带来了新的活力,给课程注入了新的生机,给教师迎来了新的发展机遇。新的《九年级化学课程标准》为化…
-
初三化学教学反思
初三化学教学反思——化学方程式的教学反思(化学组张桂凤)回顾多年的化学教学工作,结合这次的研讨课,想说的真是太多太多。下面就是我的…
-
新课改下高中化学教学反思
新课改下高中化学教学反思罗开梅重庆铜梁二中402560摘要随着课程改革的不断深入以培养学生知识与技能过程与方法情感态度与价值观三维…