化学反应速率案例案例(新教材)
化学反应的速率和限度(第1课时)
教学案例
教材分析:本章内容是在社会生产、生活和科学研究中有广泛应用的知识,是对人类文明进步和现代化发展有重大价值的知识,与我们每个人息息相关。因此,化学能对人类的重要性和化学反应速率、限度及其条件控制对化学反应的重要性,决定了本章学习的重要性。
在前面两节中,教材着重探讨化学能向其他形式的能量(如热能和电能)的转化,并指出化学反应中的物质变化及伴随发生的能量变化是化学反应的两大基本特征。本节教材则是从另一个角度研究化学反应,探讨人类面对具体的化学反应要考虑的两个基本问题:外界条件对化学反应速率和反应的限度的影响。人类利用和控制化学反应,必须了解这些问题。
本节内容是对前两节内容的拓展和完善。通过学习使学生对化学反应特征的认识更深入、更全面,在头脑中建立起一个有关化学反应与能量的完整而又合理的知识体系。
课程标准关于化学反应与能量及化学反应速率与限度的内容在初中化学、高中必修模块和选修模块中均有安排,既有学习的阶段性,又有必修、选修的层次性,在具体内容上前后还有交叉和重叠,学生概念的形成和发展呈现一种螺旋式上升的形态。
本节从日常生活中学生熟悉的大量化学现象和化学实验入手,引出反应速率的概念。在此基础上又通过实验探究,总结影响化学反应速率的因素,但不涉及对反应速率进行定量计算或同一反应中不同物质间反应速率的相互换算。同时本章在选材上尽量将化学原理与实验、实例相结合,对化学概念或术语(如化学能、化学电池、催化剂、反应限度等)采用直接使用或叙述含义而不下定义的方式出现,以降低学习的难度。
知识与技能
理解基本的化学反应速率的概念和影响化学反应速率的外界条件。
过程与方法
1、 重视培养学生科学探究的基本方法,提高科学探究能力。
2、 通过实验探究分析影响化学反应速率的外界条件。
情感、态度、价值观
有参与化学科技活动的热情,将化学知识应用于生产、生活实践的意识,能够对与化学有关的社会和生活问题做出合理的判断。
教学重点
化学反应速率的概念;了解影响化学反应速率的因素。
教学难点
化学反应速率的有关计算
教学方法
实验探究式、讨论启发式教学
教学准备
多媒体课件、演示实验用品等
教学过程


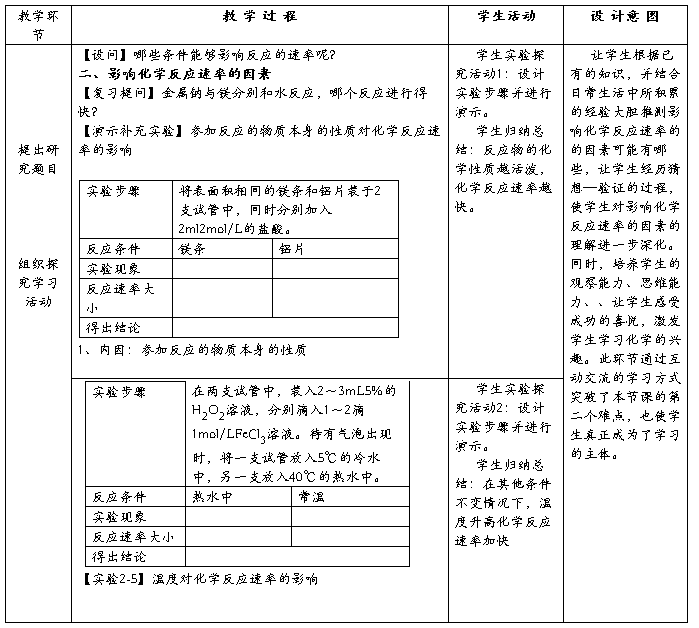


【板书设计】
第三节 化学反应速率和限度
一、化学反应速率
1、概念
2、表示方法
3、表达式:v(B)=△c(B)/△t
4、单位:mol/(L?s) 或mol/(L?min)
二、影响化学反应速率的因素
1、内因:参加反应的物质本身的性质
2、外因:
(1)温度的影响
(2)催化剂的影响
(3)浓度的影响
(4)其它因素:固体表面积、反应物的状态、气体的压强等
教学反思
一、不足之处
1.图片引入慢一些,让学生对反应快慢的认识有一个缓冲。
2.补充有关概念的正误判断。
3.区别v(N)和v(N2)。
4.结论一定要严密。强调在同一化学反应中、同一时间内,用不同物质表示反应速率时,各物质的反应速率之比等于化学方程式各物质的化学计量数之比。
5.应多给学生一些记结论的时间
6.巩固练习中强调由分到秒的单位换算,注意题目中的陷阱。
7.注意实验细节:铝在实验前应用砂纸去掉氧化膜。
8. 演示实验除用大屏幕投影让学生观察实验现象外,还应让学生实际观察。
9.强调FeCl3为新增催化剂,并与MnO2的催化效果进行对比:不同催化剂,催化效果不同。
二、成功之处
1.课堂设计非常合理。
2.教学过程也非常顺畅。
3.以和反应速率有关的几幅图片引入很好,让学生知道化学反应速率有快慢之分,同时又和实际生活相联系,从而激发学生的求知欲。
 ①内因:表面积相同的镁条和铝片分别加入2ml与相同浓度的盐酸反应。
①内因:表面积相同的镁条和铝片分别加入2ml与相同浓度的盐酸反应。
4.补充的两个实验非常好
②浓度:相同镁带分别与适量的1mol/L盐酸和0.1mol/L盐酸反应,
5.习题选择比较好,让学生不仅能够会计算,同时要仔细、认真,不要掉进陷阱中。
第二篇:化学反应速率(案例)
公 开 课 教 案
课 题:《化学反应速率》
执教者:阜宁明达中学 余正富
时 间:2007.3.21上午第一节
地 点:高一(11)
知识目标:
1.使学生了解化学反应速率的概念及表示方法。
2.使学生理解浓度、压强、温度和催化剂等条件对化学反应速率的影响。
3.使学生能初步运用有效碰撞,碰撞的取向和活化分子等来解释浓度、压强、温度和催化剂等条件对化学反应速率的影响。
情感目标:通过从宏观到微观,从现象到本质的分析,培养学生科学的研究方法。 能力目标:培养学生综合运用知识分析解决问题的能力,培养学生的思维能力,阅读与表达能力。
重点: 浓度对化学反应速度的影响。外界条件对可逆反应的正逆反应速率的影响。
难点: 浓度对化学反应速率影响的原因。
教学方法: 诱思探究法
教学过程
第一课时
[阅读教材引入]本章的主要内容和学习本章的意义
两个问题:反应进行的快慢-化学反应速率问题。
反应进行的程度-化学平衡问题。
意义:是学习化学所必需的基础理论并能指导化工生产。
[录象] 古代建筑物受到腐蚀的记录片。
[讲述] 从片中我们知道,古代建筑物在本世纪所遭受的腐蚀比过去几百年甚至几千年所遭受的腐蚀还要严重的原因是酸雨。为什么会使腐蚀的速度变快呢? 这就是我们第一节要研究的化学反应速率问题。
[板书]第一节 化学反应速率
[指导实验] [实验2-1] 等浓度的盐酸和醋酸分别与大理石反应。
现象:在加入盐酸的试管里,大理石与盐酸迅速反应,有大量气泡产生。而加入醋酸的试管里,反应缓慢,只有少量气泡产生。
[讲解] 不同的化学反应进行的快慢不一样,如何表示化学反应速率呢?
结论:不同的化学反应有快有慢。
[板书]一、化学反应速率

1、定义:化学反应速率是用来衡量化学反应进行快慢程度的,通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。
2、表达式:略
[设问]对于同一化学反应,用不同物质表示化学反应速率,数值是否一样呢?让我们看下面的练习。
[投影]练习:在给定条件下,氮气与氢气在密闭容器中合成氨。起始时加入氮气和氢气且浓度分别为1.0 mol/L 和3.0 mol/L,2秒后,氮气的浓度为0.8 mol/L ,氢气的浓度为2.4 mol/L,氨气的浓度为0.4 mol/L 。分别用氮气、氢气和氨气的浓度变化表示的这2秒内的化学反应速率是多少?有什么关系?
[计算、思考]
3H2 + N2 = 2NH3
起始 3.0 1.0 0
浓度mol/L
2S后 2.4 0.8 0.4
浓度mol/L

[总结]同一反应,用不同物质浓度表示化学反应速率,数值之比等于方程式中系数比,应指明是用那种物质的浓度变化表示的速率,化学反应速率实质是平均反应速率。
[过渡] 下面来研究影响化学反应速率的因素。
补充实验:
在三只试管里分别放入5 mL相同浓度的稀盐酸,分别加入长短、粗细大致相同的铜丝,铝丝,铁丝。
[讲解]铜是氢后金属,不能置换酸中的氢,铝的金属活动性比铁强,铝的反应速率快,说明物质的性质即内因是决定化学反应速率的重要因素。那么,外界条件对化学反应速率是如何影响呢?
现象:铜丝与稀盐酸不反应;铝丝比铁丝溶解的快,气体生成的快。
[板书]二、外界条件对化学反应速率的影响
[指导实验][实验2-2] 大理石与不同浓度的盐酸反应,并给其中一个加热。
[实验2-3] H2O2的分解反应
(2-2)现象:在加入1 mol/L盐酸的试管中有大量的气泡冒出,在加入0.1 mol/L盐酸的试管中气泡产生得很慢。加热后,反应速率明显加快。
(2-3)现象:在H2O2中加入MnO2粉末时,立即有大量气泡产生,在没有加入MnO2粉末的试管只有少量气泡。
[提出问题] 通过以上实验,说明影响化学反应速率的外界条件有那些?是如何影响的?
[回答]
影响化学反应速率的外界条件有浓度、温度和催化剂。浓度越大、温度越高、使用催化剂,则化学反应速率越快。
[板书]1、浓度对化学反应速率的影响
当其它条件不变时,增加反应物的浓度,可以增大化学反应速率。
[设问] 对于有气体参加的反应压强对化学反应速率也有影响,为什么?
[回答]
对于气体来说,当其它条件不变时,体积与所受的压强成反比。如果气体的压强增大,体积就缩小,则浓度就会增大,化学反应速率就加快。
[板书]
2、压强对化学反应速率的影响
对于有气体参加的反应,增大压强,可以增大化学反应速率。
3、温度对化学反应速率的影响
当其它条件不变时,升高温度,可以增大化学反应速率。
4、催化剂对化学反应速率的影响
使用催化剂可以加快化学反应速率。
[阅读]P35 最后自然段。影响化学反应速率的外界条件还有什么?
[设问]为什么在补充实验中选择长短、粗细大致相同的金属?
[回答]因为固体颗粒的大小对化学反应速率也有影响。
[追问]怎样影响?
[回答]颗粒越细,接触面积越大,化学反应速率越快。
[留疑] 外界条件对化学反应速率的影响的原因是什么?

[课堂练习]
1、反应4NH3 (g) + 5O2(g) == 4NO(g)+6H2O(g),在10L的密闭容器中进行,半分钟后,水蒸汽的物质的量增加了0.45 mol,则此反应的平均速率v(x)(反应外物的消耗速率或生成物的生成速率)可表示为( )
A.v(NH3)= 0.010 mol/(L·s)
B.v(O2)= 0.0010 mol/(L·s)
C.v(NO )= 0.0010 mol/(L·s)
D.v(H2O )= 0.045 mol/(L·s)
2、在四个不同的容器中,采用不同条件进行合成氨反应,根据下列在相同时间内测定的结果判断,生成氨的速率最快的是 ( )
A.用H2 表示的反应速率为0.1 mol/(L·min)
B.用NH3表示的反应速率为0.3 mol/(L·min)
C.用N2表示的反应速率为0.2mol/(L·min)
D.用H2 表示的反应速率为0.3 mol/(L·min)
3、增大压强,能使下列反应速率加快的是( )
A.Na2SO4溶液与BaCl2溶液反应
B.CO和水蒸气在一定条件下反应生成CO2和H2
C.将CO2通人石灰水中
D.Na2O溶于水
4、在带有活塞的密闭容器中发生反应:Fe2O3+ 3H2 =2Fe+3H2O,采用下列措施不能改变反应速率的是( )
A.增加Fe2O3投入量
B.保持容器体积不变,增加通人H2 的量
C.充入N2,保持容器内压强不变
D.充入N2,保持容器内体积不变
[答案]
1、C;2、C;3、B、C;4、A、D
[作业] P36: 一、二
教学反思:
本节课主要是引领学生从定性角度到定量角度认识化学反应速率。本节课共设三大板块:创设情境,建立速率的概念、化学反应速率概念、有关化学反应速率的简单计算,其中建立学习化学概念的思维是重中之重。
本节课是以类比物理上上速度的概念和阅读教材相关内容,引导学生自己归纳出反应速率的概念、表示方法、及单位,体现学生是课堂教学的主题,教师只
是课堂的组织者、指导者和策划者。最后,再运用反应速率的计算公式进行简单的计算,做到从练习中巩固所学知识。
-
《化学反应速率》教学反思
化学反应速率教学反思铁岭市第二高级中学化学反应速率的概念及计算依然是重点内容而影响化学反应速率的因素在新教材中只介绍了催化剂和温度…
- 化学反应速率教学设计与反思
-
化学反应速率教学反思
化学反应速率教学反思新课程里的教学难易程度一直是很难把握的本节课化学反应速率的概念及计算是重点内容而影响化学反应速率的因素在新教材…
-
化学反应速率教学反思
化学反应速率教学反思新课程倡导以quot主动参与乐于探究交流与合作quot为主要特征的学习方式这是广大教师课堂教学中所要积极探索的…
-
高一化学《化学反应的速率》教学反思
高一化学化学反应的速率教学反思看了有关化学反应速率的视频后有很大的感触对于自己在教学上有一定的促进作用在进入本课堂的内容之前老师先…
-
新课改下高中化学教学反思
新课改下高中化学教学反思罗开梅重庆铜梁二中402560摘要随着课程改革的不断深入以培养学生知识与技能过程与方法情感态度与价值观三维…
-
新课改下的高中化学教学反思
浅谈新课改下的高中化学教学反思长沙县二中熊卓军410154摘要教学反思是提高教师教学水平和学科教学质量必不可少的一种途径本文论述了…
-
化学教学反思
高中化学教师教学反思无为职教中心周冬萍139xxxxxxxx摘要化学教学要树立课程改革的基本理念尊重和满足不同学生的需要运用多种教…
-
浅谈高中化学学案教学反思
浅谈高中化学学案教学反思河津三中马义荣学案教学在我校已实施一年多通过学案教学确实能发挥学生主体作用大多数学生学习积极性明显提高学生…
-
高二化学付瑞丽教学反思
新课改下高中化学教学反思经开区实验中学高二年级付瑞丽高中化学新课程改革已有一年在走入新课程的这段时间我们是否对自己以往的教学思想和…