离子共存问题教学案例分析
《离子共存问题》
一、学生已有的认识
关于离子共存问题覆盖面很广 ,牵涉的知识很多 ,综合性也很强 ,学生普遍感到很棘手 ,错误率高也就在所难免。在中学阶段,学生对于溶液问题的认识大体经历一下几个阶段。首先,在初中,学生学习了溶液等基础知识。在高中时,学生学习了离子反应、电离平衡等概念,最后在上述学习的基础上,学生们开始讨论离子共存问题。
二、学生的认知障碍
主要存在以下几个方面的问题:
1、对强、弱电解质的概念理解不透彻;
2、没有深刻地归纳和总结离子反应的实质;
3、不知道在同一溶液中离子能否大量共存;
4、没有完全掌握离子共存规律及在指定溶液中可能存在的离子;
5、对离子不能大量共存的规律掌握不全;
三、产生认知障碍的原因
我觉得这些问题的出现,主要由以下几方面因素导致:
1、学生对离子大量共存条件的规律记忆不够;
2、上课的课时不足,导致学生对离子共存问题的理解不够清晰;
3、离子共存问题的学习,需要掌握很多化学概念以及离子反应,而有的学生基础知识掌握不全、不牢,理解起来比较困难;
4、老师在做实验时,有的学生只注重表面现象,不懂得实质反应,也不善于思考、分析;
5、审题的能力不够,对题目中设置的限制条件,能否转化题干中的信息不是十分理解。
四、解决学生认知障碍的策略
我觉得在课时允许的条件下,教师在讲授离子共存问题一课时,应做到以下几点:
1.在新课程的教学设计中建议变换思路,紧紧抓住某些离子的特殊反应,由学生自己构建出离子能否共存条件的知识框架。
2.学生应该在平时多注意归纳离子共存问题的规律,老师应该帮
学生回想、理解离子共存问题。
3.在教学过程中由于学生对基础知识掌握的程度不同,老师应该通过复习化学的一些基本知识帮助学生回想和记忆,及那些情况下,离子不能大量共存。
4.联系实际,加深学生对其理解。启发学生思考,以加深离子共存问题的理解和认识。
五、检测习题
1、下列各组离子在水溶液中能大量共存的是( )
(A)Na+、Ba2+、OH-、AlO2- (B)H+、Na+、Cl-、SO32-
(C)H+、Na+、HPO42-、NO3- (D)K+、Ca2+、ClO-、SO42-
2、下列各组离子在水溶液中能够大量共存的是( )
(A)Al3+、SO42-、HCO3-、NO3- (B)NH4+、Cl-、SiO32-、SO42-
(C)NH4+、NO3-、CH3COO-、HCO3- (D)Fe3+、Cl-、HCO3-、NO3-
3、下列各组离子在水溶液中不能大量共存的是( )
(A)Na+、Mg2+、NO3-、I- (B)H+、Fe2+、NO3-、Cl-
(C)Na+、K+、ClO-、S2- (D)H+、Fe2+、SO42-、I-
4、下列各组离子在水溶液中不能大量共存的是( )
(A)H+、Na+、CH3COO-、Cl- (B)Na+、[Ag (NH3)2]+、OH-、NO3-
(C)H+、K+、MnO4-、Cl- (D)Na+、K+、AlO2-、NO3-
5、在加入铝粉能产生氢气的溶液中,下列离子能大量共存的是 ( )
A Na+ Ba2+ Cl- NO3- B Fe2+ K+ NO- Cl-
C Na+ Mg2+ AlO2- SO42- D NH4+ NO3- CO32- Na+
第二篇:离子共存问题总结
1. 复习重点
(1)增加限制条件,如强酸性、无色透明、碱性、pH=1、甲基橙呈红色、发生氧化还原反应等。
(2)定性中有定量,如“由水电离出的H+或OH-浓度为1×10-10mol/L的溶液中,……”。
2.难点聚焦
(一)、由于发生复分解反应,离子不能大量共存。
1、有气体产生。如CO32-、HCO3-、S2-、HS-、SO32-、HSO3-等易挥发的弱酸的酸根与H+不能大量共存,主要是由于发生CO32-+2H+=CO2↑+H2O、HS-+H+=H2S↑等。
2、有沉淀生成。如Ba2+、Ca2+、Mg2+等不能与SO42-、CO32-等大量共存,
主要是由于Ba2++CO32-=BaCO3↓、Ca2++SO42-=CaSO4↓(微溶);
Mg2+、Al3+、Cu2+、Fe2+、Fe3+等不能与OH-大量共存是因为
Cu2++2OH-=Cu(OH)2↓,Fe3++3OH-=Fe(OH)3↓等;
SiO32-、AlO2- 、S2O32-等不能与H+大量共存是因为
SiO32-+2H+=H2 SiO3↓、AlO2-+H++H2O=Al(OH)3↓、S2O32-+2H+=S↓+SO2↑+H2O
3、有弱电解质生成。
如OH-、ClO-、F-、CH3COO-、HCOO-、PO43-、HPO42-、H2PO4-等与H+不能大量共存,
主要是由于OH-+H+=H2O、CH3COO-+H+=CH3COOH等;
一些酸式弱酸根及NH4+不能与OH-大量共存是因为
HCO3-+OH-=CO32-+H2O、HPO42-+OH-=PO43-+H2O、NH4++OH-=NH3·H2O等。
4、一些容易发生水解的离子,在溶液中的存在是有条件的。
如:AlO2-、S2-、HS-、CO32-、HCO3-、SO32-、HSO3- 、ClO-、F-、CH3COO-、HCOO-、PO43- 、SiO32-、C6H5O-等必须在碱性条件下才能在溶液中大量存在;Mg2+、Al3+、Cu2+、Fe2+、Fe3+、NH4+等必须在酸性条件下才能在溶液中大量存在。
(二)、由于发生氧化还原反应,离子不能大量共存
1、一般情况下,具有较强还原性的离子不能与具有较强氧化性的离子大量共存。如I-、、S2-、HS-和Fe3+不能大量共存是由于2I-+2Fe3+=I2+2Fe2+、2Fe3++ S2-=S↓+2Fe2+、2Fe3++3S2-=S↓+2Fe S↓。
2、在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。如NO3-和I-在中性或碱性溶液中可以共存,但在有大量H+存在情况下不能共存;SO32- 、S2O32-和S2-在碱性条件下可以共存,但在酸性条件下由于发生2S2-+SO32-+6H+=3S↓+3H2O、2S2-+S2O32-+6H+=4S↓+3H2O不能共存。ClO-与S2-不论是在酸性条件下还是在碱性条件下都不能大量共存。
(三)、由于形成络合离子,离子不能大量共存
中学化学中还应注意有少数离子可形成络合离子而不能大量共存的情况。如Fe3+和SCN-、C6H5O-,由于Fe3++SCN- [Fe(SCN)]2+等络合反应的发生而不能大量共存。
[Fe(SCN)]2+等络合反应的发生而不能大量共存。
(四)、能水解的阳离子与能水解的阴离子一般不能同时存在在同一溶液中,即离子间能发生“双水解”反应。例如:Al3+和HCO3-,Al3+和CO32-,Al3+和S2-,Al3+和HS-,Al3+和AlO2-,Al3+和C6H5O-,Fe3+和AlO2-,Fe3+和HCO3-,Fe3+和CO32-,NH4+和AlO2-等。如3AlO2-+Al3++6H2O=4Al(OH)3↓等。特别注意:NH4+和CO32-、NH4+和HCO3-、NH4+和CH3COO-在同一溶液中能大量共存。
注意事项:1.首先必须从化学基本概念和基本理论出发,搞清楚离子反应的规律和“离子共存”的条件。在中学化学中要求掌握的离子反应规律主要是离子间发生复分解反应和离子间发生氧化还原反应,以及在一定条件下一些微粒(离子、分子)可形成络合离子等。“离子共存”的条件是根据上述三个方面统筹考虑、比较、归纳整理而得出的。因此解决“离子共存”问题可从离子间的反应规律入手,逐条梳理。
2.审题时应注意题中给出的附加条件,如:
①酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃性气体的溶液、由水电离出的H+或OH-浓度为1×10-10mol/L的溶液等。
②有色离子:MnO4-,Fe3+,Fe2+,Cu2+,Fe(SCN)2+使溶液呈现一定的颜色。
③MnO4-、NO3-、Cr2O72-等在酸性条件下具有强氧化性。
④注意题目要求“一定大量共存”、“可能大量共存”还是“不能大量共存” 等要求。
3.审题时还应特别注意以下几点:
(1)注意溶液的酸碱性对离子间发生氧化还原反应的影响。如:Fe2+与NO3-能共存,但在强酸性条件下发生3Fe2++NO3-+4H+=3Fe3+ + NO↑+2H2O而不能大量共存;I-与NO3-能共存,但在强酸性条件下不能大量共存;MnO4- 与Cl-在强酸性条件下也不能大量共存;S2-与SO32-在碱性条件下可共存,但在酸性条件下不能大量共存。
(2) 弱酸的酸式根离子(如HCO3-、HSO3-、HS-、HPO42-、H2PO4-)既不能与H+大量共存也不能与OH-大量共存。如:HCO3-+OH-=CO32-+H2O (HCO3-遇碱时进一步电离)
HCO3-+H+=CO2↑+H2O。
(3) 注意挖掘题目中隐含的信息,排除干扰信息,克服非智力因素失分。
离子方程式的书写正误是历年高考必出的试题,考查离子方程式的目的主要是了解考生使用化学用语的准确程度和熟练程度,具有一定的综合性。从命题的内容看,存在着三种特点:
⑴所考查的化学反应均为中学化学教材中的基本反应,错因大都属于化学式能否拆分、处理不当、电荷未配平、产物不合理和漏掉部分反应等。
(2)所涉及的化学反应类型以复分解反应、溶液中的氧化还原反应为主。
⑶一些重要的离子反应方程式,在历年考卷中多次重复。
4.离子方程式正误判断规律(八“看”)
⑴看离子反应是否符合客观事实,不可主观臆造产物及反应。
⑵看“=”“≒”“↑”“↓”等是否正确。
⑶看表示各物质的化学式是否正确。如HCO3-不能写成CO32-+H+
⑷看是否漏掉离子反应。
⑸看电荷是否守衡。
⑹看反应物或产物的配比是否正确。
⑺看是否符合题设条件及要求。
⑻看物料是否守衡。
3. 例题精讲
[例1]下列各组中的离子,能在溶液中大量共存的是:
A.K+、Ag+、NO3-、Cl- B.Ba2+、Na+、CO32-、OH-
C.Mg2+、Ba2+、OH-、NO3- D.H+、K+、CO32-、SO42-
E.Al3+、Fe3+、SO42-、Cl- F.K+、H+、NH4+、OH-
解析:A组中:Ag++Cl-=AgCl↓ B组中,Ba2++CO32-=BaCO3↓
C组中,Mg2++2OH-=Mg(OH)2↓ D组中,2H++CO32-=CO2↑+H2O
E组中,各种离子能在溶液中大量共存。
F组中,NH4+与OH-能生成难电离的弱电解质NH3·H2O,甚至有气体逸出。
NH4++OH-=NH3·H2O或NH4++OH-=NH3↑+H2O
答案:E
[例2]在pH=1的无色透明溶液中,不能大量共存的离子组是:
A.Al3+、Ag+、NO3-、I- B.Mg2+、NH4+、NO3-、Cl-
C.NH4+、K+、S2-、Br- D.Zn2+、Na+、NO3-、SO42-
解析:题目给出两个重要条件:pH=1(即酸性)和无色透明,并要求找出不能大量共存的离子组。选项A中Ag+与I-不能共存,生成黄色的AgI不溶于HNO3(H+和NO3-),Al3+、NO3-、H+都为无色,符合题意。选项B、D中的各离子虽都是无色的,但能共存于酸性溶液中,不符合题意。选项C中各离子能够共存,且为无色,但S2-与H+不能大量共存,所以C也符合题意。 答案:A、C
[例3]下列各组离子,在强碱性溶液中可以大量共存的是:
A.K+、Na+、HSO3-、Cl- B.Na+、Ba2+、AlO2-、NO3-
C.NH4+、K+、Cl-、NO3- D.K+、Na+、ClO-、S2-
解析:A中HSO3-+OH-=SO32-+H2O C中NH4++OH-=NH3·H2O
D中ClO-具有强氧化性,S2-具有还原性,发生氧化还原反应 答案:B
[例4]下列各组离子在水溶液中能大量共存的是:
(1)I-、ClO-、NO3-、H+ (2)K+、NH4+、HCO3-、OH-
(3)SO32-、SO42- 、Cl-、OH- (4)Fe3+、Cu2+、SO42- 、Cl-
(5)H+、K+、AlO2-、HSO3- (6)Ca2+、Na+、SO42- 、CO32-
A.(1)和(6) B.(3)和(4) C.(2)和(5) D.(1)和(4)
解析:通常组合选择题需对题干及各项逐一分析,选出符合题意的组合,然后与各选项比较得出结论。但本题可用排除法,先判断出组合(1)由于次氯酸是弱酸,故ClO-与H+不能大量共存,发生反应:H++ClO-=HClO,次氯酸有较强的氧化性以及硝酸(NO3-、H+)都能与I-(具有还原性)发生氧化还原反应,因此该组不合题意,凡是含(1)的选项即A和D都不正确,可以排除。(2)中因发生:NH4++OH-=NH3·H2O,HCO3-+OH-=CO32-+H2O而不能大量共存,由此排除C,正确答案为B。其中(3)和(4)这两组离子在水溶液中能大量共存。本题涉及的组合(5)也不能大量共存,因为发生:H++AlO2-+H2O=Al(OH)3↓,H++HSO3-=SO2↑+H2O而不能大量共存。组合(6)中因Ca2++CO32-=CaCO3↓析出沉淀而不能大量共存。 答案:B
[例5]下列各组离子,能够在溶液中大量共存的是:
A.Na+、Al3+、NO3-、AlO2- B.Na+、Ca2+、HCO3-、HSO4-
C.Cu2+、K+、NO3-、OH- D.S2O32-、Na+、H+、SO42-
E.Fe3+、Cl-、SCN-、K+ F.Fe3+、NH4+、Cl-、NO3-
G.Fe2+、Cl-、NO3-、H+ H.Na+、Al3+、SO42-、HCO3-
解析:解本题的关键在于熟悉离子反应、盐类水解、氧化还原反应的规律以及某些特殊离子的存在条件是否由于其它离子的存在而遭破坏。下列各组离子,因为发生下列反应不能大量共存。
A组:Al3++3AlO2-+6H2O=4Al(OH)3↓ B组:HCO3-+HSO4-=H2O+CO2↑+SO42-
C组:Cu2++2OH-=Cu(OH)2↓ D组:S2O32-+2H+=SO2↑+S↓+H2O
E组:Fe3++3SCN-=Fe(SCN)3 G组:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
H组:Al3++3HCO3-=Al(OH)3↓+3CO2↑ F组:能大量共存 答案:F
[例6]下列离子方程式正确的是
A.AlCl3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+;
B.C6H5ONa溶液中通入少量CO2:2C6H5O-+CO2+H2O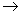 2C6H5OH+ CO32-;
2C6H5OH+ CO32-;
C.FeBr2溶液中通入少量Cl2:2Br-+Cl2=Br2+2Cl-;
D.Mg(HCO3)2溶液中加入足量NaOH溶液: Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O.
解析:B中不论CO2多少,均得HCO3-;C中应先氧化Fe2+。 答案:A、D
[例7]下列离子方程式正确的是
A.向NaHSO4溶液中逐滴加入Ba(OH)2溶液,至沉淀完全:
2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O
B.碳酸钠与醋酸溶液反应:CO32-+2CH3COOH=CO2↑+2CH3COO- +H2O
C.将1~2mL氯化铁饱和溶液加入到20 mL沸水中:
Fe3++3H2O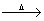 Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
D.氢氧化铁与氢碘酸中和:Fe(OH)3+3H+=Fe3++3H2O
解析:A应为H++SO42-+Ba2++OH-=BaSO4↓+H2O; D中氢碘酸有还原性,要还原
+3价的铁:2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O
答案:B、C
[例8]下列离子方程式正确的是
A.等物质的量浓度的Ba(OH)2溶液与明矾溶液以体积比3比2混合
3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓
B.Fe(OH)2溶于稀硝酸中 Fe(OH)2+3H+=Fe2++3H2O
C.H218O中投入Na2O2固体 2H218O+2O22-=4OH-+18O2↑
D.CuCl2溶液中加入Na2S溶液 Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑
解析:B中硝酸有氧化性,要氧化+2价的铁:3Fe(OH)2+10H++NO3-=3Fe3++NO↑+8H2O;
C应为2H218O+2 Na2O2=2 Na OH+2 Na 18OH+O2↑;D应为Cu2++S2-=Cu S↓ 答案:A
[例9]下列离子方程式的书写正确的是
A.FeS固体与稀HNO3溶液混合 FeS+2H+=2Fe2++H2S↑
B.NH4HSO4溶液中加入足量Ba(OH)2溶液 H++SO42-+Ba2++OH-=BaSO4↓+H2O
C.Ca(ClO)2溶液中通入足量的CO2气体 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
D.等浓度等体积的Ca(H2PO4)2溶液与NaOH溶液混合 Ca2++H2PO4-+OH-=CaHPO4↓+H2O
解析:A中硝酸有氧化性,要氧化+2价的铁和-2价的硫;
B应为NH4++H++SO42-+Ba2++2OH-=BaSO4↓+NH3·H2O+H2O; C中CO2足量应生成HCO3-。
答案:D
[例10]下列离子方程式书写正确的是
A.将少量SO2气体通入NaClO溶液中 SO2+2ClO-+H2O=SO32-+2HClO
B.向KHSO4溶液中加入Ba(OH)2溶液至所得溶液的pH=7 Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
C.向Ca(HCO3)2溶液中滴入过量的NaOH溶液 Ca2++2 HCO3-+2OH-=CaCO3↓+CO32-+2H2O
D.112mL(S.T.P)Cl2通入10mL1mol/L的FeBr2溶液中 2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2
解析:A中SO32-要被HClO 氧化;D中Cl2少仅氧化Fe2+ 答案:B、C
-
初中物理实验教学案例分析)
水城县花戛乡初级中学教师:教学案例分析(20xx年秋季学期)教师:柳成会20xx年x月x日《声音的产生与传播》实验教学案例由于我们…
-
小学英语课堂故事教学案例分析
小学英语课堂故事教学案例分析一、背景介绍如何以故事为载体,训练学生的阅读能力,培养学生创造性的思维能力,是每个小学英语教师在设计教…
-
小学数学课堂教学案例分析
小学数学课堂教学案例分析一、教学案例实录教学过程:1、创设情境,激趣引入(1)谈活:你们喜欢摆图吗?你最喜欢摆什么?(学生争先恐后…
-
小学语文教学案例分析
小学语文教学案例分析——反复朗读的意义高阳中心校临水小学武维茂崔峦老师曾经说过:“在小学的阅读教学中,对于景美、情深的课文,教师要…
-
展示设计项目教学案例分析
展示设计教学中的项目教学案例分析李德真内容摘要:本文通过对09级20xx-20xx第二学期展示设计教学中的项目教学实践案例,分析项…
-
优秀教师教学案例分析的心得体会3
优秀教师教学案例分析的心得体会黄凤玲小学语文教学对象是正在成长中的儿童,若何把小学生培育好,不能有半点差错。它要求每一位教师在上课…
-
教学案例分析
教学案例分析20xx年x月x日,我观看了一节口语交际课-----“小小推销员”,让我印象深刻。口语交际课在我的教学中是个难点,无从…
-
出题英语教学案例分析
英语教学案例分析案例1:一节英语课学习了句型“Weshould?;It’sso?”,在课堂结尾的时候,教师给学生呈现了大象的图片,…
-
20xx年江西教师招聘考试小学语文教学案例分析精选三
20xx年江西教师招聘考试小学语文教学案例分析精选三(中公江西教师网http://jx.zgjsks.com/)【江西教师考试课程…
-
黑龙江教师招聘考试小学语文教学案例分析精选二
文章来源:中公黑龙江教师考试网黑龙江教师招聘考试小学语文教学案例分析精选二假若你是扁鹊前不久执教小学语文第八册《扁鹊治病》这课,在…
-
聚划算案例分析
三金冠女装:Artka.taobao.com店铺名:我是阿卡在聚划算团队的帮助和指导下,Artka阿卡对满换购的营销工具在1月x日…