篇一 :化学实验报告 实验__氢氧化钠标准溶液的配制与标定1
实 验 报 告
姓名: 班级: 同组人: 自评成绩:
项目: 氢氧化钠标准溶液的配制与标定课程: 学号:
一、实验目的
1. 掌握氢氧化钠溶液的配制和标定方法。
2. 熟悉滴定操作和滴定终点的判断。
…… …… 余下全文
篇三 :盐酸和氢氧化钠标准溶液浓度的标定实验报告
盐酸和氢氧化钠标准溶液浓度的标定实验报告
一、实验目的
1.掌握NaOH标准溶液的标定方法。
2.了解基准物质邻苯二甲酸氢钾的性质及应用。
3.进一步学习碱式滴定管的使用。
4.掌握强碱滴定弱酸的滴定过程、指示剂选择和终点的确定方法。
二、实验原理
溶液的配制方法主要分直接法和间接法两种。
(1)直接法:准确称取一定质量的基准物质,溶解后定量转移到容量瓶中,稀释至一定体积,根据称取物质的质量和容量瓶的体积即可计算出该标准溶液准确浓度。
例:配制0.017 mol/L K2Cr2O7标准溶液250mL。准确称取K2Cr2O7 1.2-1.3gK2Cr2O7于100mL小烧杯,加适量水溶解后定量转入250mL容量瓶中,用水稀释至刻度,摇匀。计算其准确浓度。
可直接配制标准溶液的物质应具备的条件:
①必须具备有足够的纯度 一般使用基准试剂或优级纯;
②物质的组成应与化学式完全相等 应避免:结晶水丢失;吸湿性物质潮解; ③稳定——见光不分解,不氧化 重铬酸钾可直接配制其标准溶液。
…… …… 余下全文
篇四 :实验4 NaOH标准溶液的标定
实验二 NaOH标准溶液的标定
一、实验目的
1.掌握用邻苯二甲酸氢钾标定氢氧化钠溶液的原理和方法。
2.熟练减量法称取基准物质的方法。
3.熟练滴定操作和用酚酞指示剂判断滴定终点。
二、实验原理
固体NaOH具有很强的吸湿性,且易吸收空气中的水分CO2,因而常含有Na2CO3,且含少量的硅酸盐、硫酸盐和氯化物,因此不能直接配制成准确浓度的溶液,而只能配制成近似浓度的溶液,要用基准物质进行标定,才能获得准确的浓度。 由于NaOH溶液中碳酸钠的存在,会影响酸碱滴定的准确度,在精确的测定中应配制不含Na2CO3的NaOH溶液并妥善保存。
用邻苯二甲酸氢钾基准物质标定NaOH准确浓度。邻苯二甲酸氢钾易制得纯品,在空气中不吸收水,容易保存,摩尔质量大,是一种较好的基准物质。 用邻苯二甲酸氢钾标定NaOH溶液的反应式为:
KHC8H4O4 + NaOH ==KNaC8H4O4 + H2O
由反应可知,1mol KHC8H4O4与1mol NaOH完全反应。到化学计量点时,溶液呈碱性,pH值约为9,可选用酚酞作指示剂,滴定至溶液由无色变为浅粉色,30s不褪即为滴定终点。
三、实验试剂及仪器
…… …… 余下全文
篇五 :实验报告_酸碱标准溶液的配制和标定
实验一酸碱标准溶液的配制和标定
实验目的
1. 掌握标准溶液的配制方法。
2. 掌握滴定法定量测定溶液浓度的原理,熟悉滴定管、移液管的准备、使用及滴定操作。
3. 熟悉甲基橙和酚酞指示剂的使用和终点的确定。
实验原理
酸碱滴定法是化学定量分析中最基本的分析方法。一般能与酸或碱直接(或间接)发生酸碱反应的物质大多可用酸碱滴定法测定他们的浓度。
按酸碱反应方程式中的化学计量系数之比,酸与碱完全中和时的pH值称为化学计量点,达到化学计量点时,应满足如下基本关系:
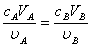
式中,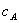 、
、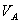 、
、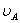 分别为酸的“物质的量”浓度、体积、化学计量系数;
分别为酸的“物质的量”浓度、体积、化学计量系数;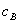 、
、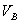 、
、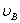 分别为碱的“物质的量”浓度、体积、化学计量系数。其中,酸、碱的化学计量系数由酸碱反应方程式决定。
分别为碱的“物质的量”浓度、体积、化学计量系数。其中,酸、碱的化学计量系数由酸碱反应方程式决定。
由于酸、碱的强弱程度不同,因此酸碱滴定的化学计量点不一定在pH=7处。通常,酸碱溶液为无色,酸碱中和是否完全,需用指示剂的变色来判断。指示剂往往是一些有机的弱酸或弱碱,它们在不同pH值条件下颜色不同。用作指示剂时,其变色点(在化学计量点附近)的pH值称为滴定终点。选用指示剂要注意:①变色点与化学计量点尽量一致;②颜色变化明显;③指示剂用量适当。
…… …… 余下全文
篇六 :实验 二 HCl、NaOH标准溶液的配制与标定
实验二 HCl、NaOH标准溶液的配制与标定
[实验目的]
1、掌握HCl标准溶液的配制和标定的原理
2、进一步熟练滴定分析基本操作。
[实验原理]
标定是准确测定标准溶液浓度的操作过程。间接法配制的标准溶液浓度是近似浓度,其准确浓度需要进行标定。
1. 标定HCl标准溶液
基准物质有:无水碳酸钠、硼砂(Na2B4O7·10H2O)等。本实验采用无水Na2CO3标定HCl,其反应式为:Na2CO3 + 2HCl = 2NaCl + H2O + CO2
滴定至反应完全时,化学计量点的pH = 3.89,突跃范围为5.0-3.5,可选用甲基橙(3.1-4.4)为指示剂。终点颜色变化为:黄色到橙色。
由反应式可知n(Na2CO3):n(HCl)=1:2,摩尔质量为M(Na2CO3)= 106.00 g·mol-1
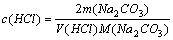
2. HCl溶液标定NaOH溶液
NaOH+HCl = H2O+NaCl 摩尔比1:1
进行计算就可求得NaOH的浓度: C(NaOH) = C(HCL)V(HCL) / V(NaOH)
…… …… 余下全文
篇七 :EDTA标准溶液的标定和水的硬度测定(实验报告)
EDTA标准溶液的标定和水的硬度测定
(四川农业大学生命科学与理学院(625014)应用化学09-2 王雨20096824 )
【摘 要】本实验利用络合滴定法分别标定了EDTA标准溶液、测定了自来水的硬度。 首先,以CaCO3为基准物质、钙指示剂指示滴定终点标定了EDTA标准溶液的浓度, 得到其平均浓度为0.01592 mol?L-1。再以铬黑T为指示剂、用标定后的EDTA测定了 水的总硬为12.61±0.01(°),以钙指示剂为指示剂测得水的钙硬为9.46±0.01(°), 则有镁硬为3.15±0.01(°)。
【关键词 】EDTA ;标定 ;水 ;硬度
1 引言
EDTA是乙二胺四乙酸或其二钠盐的简称(缩写为H4Y或Na2H2Y?2H2O),由于前者的溶解度小,通常用其二钠盐配制标准溶液。尽管EDTA可制得纯品,但EDTA具有与金属离子配位反应普遍性的特点,即使是水和试剂中的微量金属离子或器壁上溶出的金属离子也会与EDTA反应,故通常仍用间接法配制标准溶液。一般先配成浓度约为0.01mol?L-1的溶液,再用基准物质来标定,常用的基准物质是Zn、ZnO、CaCO3、Bi、Cu、MgSO4?7H2O、Hg、Ni、Pb等。本实验控制pH在12~13的酸度下,以钙指示剂指示终点滴定,用CaCO3作为基准物质进行滴定。
…… …… 余下全文
篇八 :EDTA标准溶液的标定和水的硬度测定(实验报告)
EDTA标准溶液的标定和水的硬度测定
(四川农业大学生命科学与理学院(625014)应用化学09-2 王雨20096824 )
【摘 要】本实验利用络合滴定法分别标定了EDTA标准溶液、测定了自来水的硬度。
首先,以CaCO3为基准物质、钙指示剂指示滴定终点标定了EDTA标准溶液的浓度,得到其平均浓度为0.01592 mol·L-1。再以铬黑T为指示剂、用标定后的EDTA测定了水的总硬为12.61±0.01(°),以钙指示剂为指示剂测得水的钙硬为9.46±0.01(°),
则有镁硬为3.15±0.01(°)。
【关键词 】EDTA ;标定 ;水 ;硬度
1引言
EDTA是乙二胺四乙酸或其二钠盐的简称(缩写为H4Y或Na2H2Y·2H2O),由于前者的溶解度小,通常用其二钠盐配制标准溶液。尽管EDTA可制得纯品,但EDTA具有与金属离子配位反应普遍性的特点,即使是水和试剂中的微量金属离子或器壁上溶出的金属离子也会与EDTA反应,故通常仍用间接法配制标准溶液。一般先配成浓度约为0.01mol·L-1的溶液,再用基准物质来标定,常用的基准物质是Zn、ZnO、CaCO3、Bi、Cu、MgSO4 7H2O、Hg、Ni、Pb等。本实验控制pH在12~13的酸度下,以钙指示剂指示终点滴定,用CaCO3作为基准物质进行滴定。
7H2O、Hg、Ni、Pb等。本实验控制pH在12~13的酸度下,以钙指示剂指示终点滴定,用CaCO3作为基准物质进行滴定。
…… …… 余下全文