实验4 NaOH标准溶液的标定
实验二 NaOH标准溶液的标定
一、实验目的
1.掌握用邻苯二甲酸氢钾标定氢氧化钠溶液的原理和方法。
2.熟练减量法称取基准物质的方法。
3.熟练滴定操作和用酚酞指示剂判断滴定终点。
二、实验原理
固体NaOH具有很强的吸湿性,且易吸收空气中的水分CO2,因而常含有Na2CO3,且含少量的硅酸盐、硫酸盐和氯化物,因此不能直接配制成准确浓度的溶液,而只能配制成近似浓度的溶液,要用基准物质进行标定,才能获得准确的浓度。 由于NaOH溶液中碳酸钠的存在,会影响酸碱滴定的准确度,在精确的测定中应配制不含Na2CO3的NaOH溶液并妥善保存。
用邻苯二甲酸氢钾基准物质标定NaOH准确浓度。邻苯二甲酸氢钾易制得纯品,在空气中不吸收水,容易保存,摩尔质量大,是一种较好的基准物质。 用邻苯二甲酸氢钾标定NaOH溶液的反应式为:
KHC8H4O4 + NaOH ==KNaC8H4O4 + H2O
由反应可知,1mol KHC8H4O4与1mol NaOH完全反应。到化学计量点时,溶液呈碱性,pH值约为9,可选用酚酞作指示剂,滴定至溶液由无色变为浅粉色,30s不褪即为滴定终点。
三、实验试剂及仪器
1.待标定的NaOH溶液
2.邻苯二甲酸氢钾基准试剂
3.酚酞指示剂
4.碱式滴定管
5.锥形瓶
6.量筒
四、实验步骤
用差减法称取KHC8H4O4基准物质约0.6g于250 mL锥形瓶中,加入50mL蒸馏水,加入2滴酚酞指示剂,用待标定的NaOH溶液滴定至呈微红色并保持30 s不褪色,平行标定3份。
五.实验要点
1.滴定之前,一定要检查滴定管下端是否有气泡。
2.由于氢氧化钠容易吸收空气中的二氧化碳,所以采用酚酞做指示剂,这样可以消除二氧化碳的影响。
3.计算NaOH溶液的浓度公式是:CNaOH=1000*mKHC8H4O4/(VNaOH* MKHC8H4O4)
六、实验数据
表1 KHC8H4O4标定NaOH溶液
编号 mKHC8H4O4/g VNaOH/mL CNaOH/(mol.L-1) CNaOH平均值/(mol.L-1)
相对标准偏差 相对标准偏差/%
1 0.6008 31.49 0.09343
2 0.5998 30.90 0.09505 0.09441
3 0.5999 31.00 0.09476
七、结果讨论
NaOH易吸收CO2和水分,所以只需要用台秤称取NaOH即可;由于NaOH固体易吸收空气中的CO2和水分,固配制NaOH标准溶液时不能用直接法;标定时,为了避免装入后的NaOH标准溶液被稀释,应用NaOH标准溶液润洗滴管2~3次;而锥形瓶中有水不会影响被测物质量的变化,所以锥形瓶不需先用标准溶液润洗或烘干;盛氢氧化钠溶液的试剂瓶应用橡皮塞,因NaOH与玻璃的成分之一SiO2作用会使塞子与瓶口粘结而打不开。橡皮塞耐碱腐蚀,但易被酸侵蚀,它与有机液体、有机蒸气接触容易发生溶胀,引起有机溶剂污染;滴定开始时,可快。由于离终点远,滴落点颜色无明显变化,但不能成“水线”,以免溶液溅出。滴落点颜色有变化或消失慢时,滴定放慢。随着终点的接近,改为
滴1滴搅几下(一滴多搅),或控制滴加速度为加1滴,经搅拌后溶液颜色稳定,下1滴正好滴下。
第二篇:实验_NaOH溶液的配制和标定(报告样板)
实验 NaOH溶液的配制和标定
一、实验目的
(略)
二、原理
以邻苯二甲酸氢钾(C6H4·COOH·COOK)作基准物,标定NaOH标准溶液的反应如下:
C6H4·COOH·COOK + NaOH = C6H4·COONa·COOK + H2O
化学计量点时的反应产物是邻苯二甲酸钾钠,在水溶液中显弱碱性,因此可用酚酞作指示剂。
三、实验内容
1.0.1mo1·L-1NaOH溶液的配制
配制方法同上一次实验。
2.0.1mo1·L-1NaOH溶液浓度的标定
实验步骤:
准确称取邻苯二甲酸氢钾0.4~0.6g三份于锥形瓶

 终点(粉红,30s内不褪色)。
终点(粉红,30s内不褪色)。
记录NaOH用量,求出 ,并求出三份测定结果的相对平均偏差,要求小于0.3%。
,并求出三份测定结果的相对平均偏差,要求小于0.3%。
四、数据记录和结果处理

计算式:
 ,
, 
五、讨论和思考题(预习报告中不必写)
用邻苯二甲酸氢钾作基准物,标定0.1mol·L-1NaOH溶液的准确浓度。计算邻苯二甲酸氢钾的称量范围?
答:邻苯二甲酸氢钾即C6H4·COOH·COOK或写为KHC8H4O4或写为 ,
,
邻苯二甲酸氢钾和NaOH的反应:
NaOH + KHC8H4O4 = KNaC8H4O4 + H2O
当滴定到达化学计量点,此反应的化学计量关系:
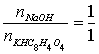 ( 1 )
( 1 )
式中, ——反应消耗NaOH的量(单位:mol),
——反应消耗NaOH的量(单位:mol),
 ——反应消耗KHC8H4O4的量(单位:mol)
——反应消耗KHC8H4O4的量(单位:mol)
因为, ,
,  代入( 1 )得
代入( 1 )得

所以, 
已知滴定管使用体积需是 20~30 ml,故
当 =0.1mol·L-1,
=0.1mol·L-1, =20mL时,
=20mL时,
当 =0.1mol·L-1,
=0.1mol·L-1, =30mL时,
=30mL时,
所以用邻苯二甲酸氢钾标定0.1mol·L-1NaOH溶液的准确浓度,应称取基准物0.4~0.6克。
-
化学实验报告 实验__氢氧化钠标准溶液的配制与标定1
实验报告姓名班级同组人自评成绩项目氢氧化钠标准溶液的配制与标定课程学号一实验目的1掌握氢氧化钠溶液的配制和标定方法2熟悉滴定操作和…
-
氢氧化钠溶液浓度的标定 实验报告
实验报告姓名班级同组人项目氢氧化钠溶液浓度的标定课程分析化学学号一实验目的1学会称量瓶电子天平滴定管等常用滴定仪器的准备和使用方法…
-
盐酸和氢氧化钠标准溶液浓度的标定实验报告
盐酸和氢氧化钠标准溶液浓度的标定实验报告一实验目的1掌握NaOH标准溶液的标定方法2了解基准物质邻苯二甲酸氢钾的性质及应用3进一步…
-
实验4 NaOH标准溶液的标定
实验二NaOH标准溶液的标定一实验目的1掌握用邻苯二甲酸氢钾标定氢氧化钠溶液的原理和方法2熟练减量法称取基准物质的方法3熟练滴定操…
-
实验报告_酸碱标准溶液的配制和标定
大学化学实验实验一酸碱标准溶液的配制和标定实验目的1掌握标准溶液的配制方法2掌握滴定法定量测定溶液浓度的原理熟悉滴定管移液管的准备…
-
实验报告_酸碱标准溶液的配制和标定
大学化学实验实验一酸碱标准溶液的配制和标定实验目的1掌握标准溶液的配制方法2掌握滴定法定量测定溶液浓度的原理熟悉滴定管移液管的准备…
-
EDTA标准溶液的标定和水的硬度测定(实验报告)
EDTA标准溶液的标定和水的硬度测定四川农业大学生命科学与理学院625014应用化学092王雨20xx6824摘要本实验利用络合滴…
-
化学实验报告——盐酸溶液的标定
化学实验报告无机及分析化学题目盐酸溶液的标定学院班级姓名学号指导老师年月日制时间盐酸浓度的标定一实验目的1练习酸碱标准溶液的标定方…
-
化学实验报告 实验__氢氧化钠标准溶液的配制与标定1
实验报告姓名班级同组人自评成绩项目氢氧化钠标准溶液的配制与标定课程学号一实验目的1掌握氢氧化钠溶液的配制和标定方法2熟悉滴定操作和…
-
EDTA标准溶液的标定和水的硬度测定(实验报告)
EDTA标准溶液的标定和水的硬度测定四川农业大学生命科学与理学院625014应用化学092王雨20xx6824摘要本实验利用络合滴…