篇一 :高中离子方程式汇总
高中离子方程式汇总
1、向氢氧化钠溶液中通入少量CO2 : 2NaOH + CO2 ==== Na2CO3+ H2O CO2 + 2OH- 32-+ H2O
2.过量CO2通入氢氧化钠溶液中:CO2+NaOH 3 CO2+ OH- HCO3-
2?2?反应分两步进行,第一步为:CO2+2OH-===CO3+H2O,第二步为:CO3+
?CO2+H2O===2HCO3。
3.在澄清石灰水中通入过量二氧化碳:Ca(OH)2+ 2CO2══Ca(HCO3)2 CO2+ OH- 3-
4.氨水中通入少量二氧化碳: 2NH3?H2O+CO2== (NH4)2 CO3+ H2O 2NH3?H2O+CO2== 2NH4+ +2H2O
5.二氧化碳通入碳酸钠溶液中:Na2CO3+CO2 +H2O══2 NaHCO3 CO32-+ CO2 +H2O══HCO3-
6.苯酚钠溶液中通入少量二氧化碳: CO2+H2O+C6H5ONa→C6H5OH+ NaHCO3
CO2+H2O+C6H5O-→C6H5OH+ HCO3-
7.烧碱溶液中通入过量二氧化硫: NaOH +SO2==NaHSO3 OH- +SO2 3-
…… …… 余下全文
篇二 :高中化学全部离子方程式大全总结
高中全部化学离子方程式总结
钠及其化合物
*1、钠与水反应:2Na++2H2O=2Na++2OH–+H2↑
2、钠与硫酸铜溶液:2Na+2H2O+Cu2+=Cu(OH)2↓+H2↑
3、钠与稀硫酸:2Na+2H+=2Na++ H2↑
*4、过氧化钠与水反应:2Na2O2+2H2O=4Na++4OH–+O2↑
碳、硅及其化合物
*1、碳酸氢钠溶液与强酸溶液混合:HCO3-+H+=CO2↑+H2O
*2、碳酸氢钠溶液与氢氧化钠溶液:HCO3-+ OH–= H2O+CO32–
3、向碳酸氢钙溶液中加入过量的氢氧化钠: 2HCO3-+Ca2++2OH–=CaCO3↓+2H2O+CO32–
4、向碳酸氢钙溶液中加入少量的氢氧化钠:Ca2++HCO3-+OH–=CaCO3↓+H2O
*5、澄清石灰水通入少量CO2:Ca2++2OH–+CO2=CaCO3↓+H2O
*6、澄清石灰水通入过量CO2:OH–+CO2=HCO3-
7、碳酸氢钠溶液与少量石灰水反应:Ca2++2OH–+2HCO3-=CaCO3↓+CO32–+2H2O
8、碳酸氢钠溶液与过量石灰水反应:HCO3-+OH–+Ca2+=CaCO3↓+H2O
…… …… 余下全文
篇三 :高中化学离子方程式总结
高中化学离子方程式总结 高中化学离子方程式总结
在离子反应中,反应物之间物质的量的相对大小有时候决定反应的实质、产物的种类和存在形式,所以,我们一定要仔细辨析这些反应,才能找到恰当的方法突破难点。
一、碱与酸酐的反应
多酸的酸酐与碱反应,酸酐少量生成正盐,酸酐过量生成酸式盐。
1、CO2与NaO
少量CO2:CO2+2OH-==CO32-+H2O
过量CO2:CO2+OH-==HCO3-
此外,当CO2通入NaAlO2、Ca(ClO)2、Na2SiO3等溶液中时,CO2少量生成碳酸盐,过量生成碳酸氢盐。不过有一个例外,当CO2通入苯酚钠溶液中,无论CO2少量还是过量,均生成碳酸氢钠,苯酚的酸性强于碳酸氢钠酸性的缘故。
类似的还有:SO2、H2S等通入到碱液中。
二、氢氧化铝的两性
2、AlCl3与NaOH
少量NaOH:Al3++3OH-==Al(OH)3↓
过量NaOH:Al3++4OH-==AlO2-+2H2O
3、NaAlO2与HCl
少量HCl:AlO2-+H++H2O==Al(OH)3↓
-+3+过量HCl:AlO2+4H==Al+2H2O
所以,以NaAlO2 或AlCl3为原料制备Al(OH)3沉淀,一定控制好酸碱的用量。
…… …… 余下全文
篇四 :高中化学离子方程式总结
高中化学离子方程式总结.txt跌倒了,爬起来再哭~~~低调!才是最牛B的炫耀!!不吃饱哪有力气减肥啊?真不好意思,让您贱笑了。我能抵抗一切,除了诱惑……老子不但有车,还是自行的……
在离子反应中,反应物之间物质的量的相对大小有时候决定反应的实质、产物的种类和存在形式,所以,我们一定要仔细辨析这些反应,才能找到恰当的方法突破难点。
一、碱与酸酐的反应
多酸的酸酐与碱反应,酸酐少量生成正盐,酸酐过量生成酸式盐。
1、CO2与NaO
少量CO2:CO2+2OH-==CO32-+H2O
过量CO2:CO2+OH-==HCO3-
此外,当CO2通入NaAlO2、Ca(ClO)2、Na2SiO3等溶液中时,CO2少量生成碳酸盐,过量生成碳酸氢盐。不过有一个例外,当CO2通入苯酚钠溶液中,无论CO2少量还是过量,均生成碳酸氢钠,苯酚的酸性强于碳酸氢钠酸性的缘故。
类似的还有:SO2、H2S等通入到碱液中。
二、氢氧化铝的两性
2、AlCl3与NaOH
少量NaOH:Al3++3OH-==Al(OH)3↓
过量NaOH:Al3++4OH-==AlO2-+2H2O
…… …… 余下全文
篇五 :高中化学离子方程式总结
高中化学离子方程式知识归纳
夏崇金 2013.04.08
在离子反应中,反应物之间物质的量的相对大小有时候决定反应的实质、产物的种类和存在形式,所以,我们一定要认真分析这些反应,才能找到恰当的方法突破难点。
一、碱与酸式盐 1、Ba(OH)2和NaHSO4
溶液呈中性:2H++SO42-+Ba2++2OH-==2H2O+BaSO4↓ SO42-沉淀完全++SO42-+Ba2++OH-==H2O+BaSO4↓ 2、NaHCO3和Ca(OH)2
石灰水少量:Ca2++2OH-+2HCO3-==CaCO3↓+CO32-+2H2O 石灰水过量:Ca2++OH-+HCO3-==CaCO3↓+H2O 3、Ca(HCO3)2和Ca(OH)2
石灰水少量或过量:Ca2++OH-+HCO3-==CaCO3↓+H2O 4、Mg(HCO3)2和NaOH
NaOH少量:Mg2++2OH-==Mg(OH)2↓
NaOH过量:Mg2++2HCO3-+4OH-==Mg(OH)2↓+2CO32-+2H2O
方法:少量物质定为1,且符合组成关系,过量物质需要多少写多少。 二、碱与酸酐的反应
…… …… 余下全文
篇六 :高中化学方程式总结 邱威严
高中化学方程式总结
邱威严
注:由于反应条件不方便打出,因此在后面括号标出(未标表示没有条件)
第一部分 无机方程式
1、钠与空气常温下反应
4Na+O2==2Na2O
2、钠再空气中加热(过氧化钠为黄色固体)
2Na+O2==Na2O2(加热或点燃)
3、钠与水反应(现象浮、游、熔、响、红)
2Na+2H2O==2NaOH+H2↑
4、铁与水蒸气反应
3Fe+4H2O(g)==Fe3O4+4H2(加热)
5、铝与氢氧化钠溶液反应
2Al+2NaOH+2H2O==2NaAlO2+3H2↑
2Al+2OH-+2H2O==2AlO-+3H2↑
6、氧化钠与水反应
Na2O+H2O==2NaOH
…… …… 余下全文
篇七 :高中离子方程式汇总
1、硝酸銀與鹽酸及可溶性鹽酸鹽溶液:Ag++Cl-=AgCl↓
2、鈉與水反應:2Na+2H2O=2Na++2OH–+H2↑
3、鈉與硫酸銅溶液:2Na+2H2O+Cu2+=2Na++Cu(OH)2↓+H2↑
4、過氧化鈉與水反應:2Na2O+2H2O=4Na++4OH–+O2↑
5、碳酸氫鹽溶液與強酸溶液混合:HCO3-+H+=CO2↑+H2O
6、碳酸氫鹽溶液與醋酸溶液混合:HCO3-+CH3COOH=CO2↑+H2O+CH3COO-
7、氫氧化鈣溶液與碳酸氫鎂反應:
Ca2++2OH-+2HCO3-+Mg2+=Mg(OH)2↓+CaCO3↓
8、向碳酸氫鈣溶液中加入過量的氫氧化鈉:
2HCO3-+Ca2++2OH–=CaCO3↓+2H2O+CO32–
9、向碳酸氫鈣溶液中加入少量的氫氧化鈉:Ca2++HCO3-+OH–=CaCO3↓+H2O
10、澄清石灰水與少量小蘇打溶液混合:Ca2++OH–+HCO3-=CaCO3↓+H2O
11、澄清石灰水通入少量CO2:Ca2++2OH–+CO3=CaCO3↓+H2O
12、澄清石灰水通入過量CO2:OH–+CO2=HCO3-
13、碳酸氫鈉溶液與少量石灰水反應:Ca2++2OH–+2HCO3-=CaCO3↓+CO32–+2H2O
14、碳酸氫鈉溶液與過量石灰水反應:HCO3-+OH–+Ca2+=CaCO3↓+H2O
15、等物質的量氫氧化鋇溶液與碳酸氫銨溶液混合:
Ba2++2OH–+NH4++HCO3-=BaCO3↓+H2O+NH3?H2O
16、碳酸鈉溶液與鹽酸反應:CO32–+H+=HCO3- 或CO32–+2H+=CO2↑+H2O
17、向氫氧化鈉溶液中通入少量的CO2¬:CO2+2OH–=CO32–+H2O
18、過量的CO2通入氫氧化鈉溶液中:CO2+OH–=HCO3-
19、碳酸氫銨溶液中加入過量氫氧化鈉溶液:
NH4++HCO3-+2OH–=NH3↑+CO32–+2H2O
20、碳酸鈣與鹽酸反應:CaCO3+2H+=Ca2++CO2↑+H2O
21、碳酸鈣與醋酸反應:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O
22、澄清石灰水與稀鹽酸反應:H++OH–=H2O
23、磷酸溶液與少量澄清石灰水:H3PO4+OH–=H2O+H2PO4–
24、磷酸溶液與過量澄清石灰水:2H3PO4+3Ca2++6OH–=Ca3(PO4)2↓+6H2O
25、碳酸鎂溶於強酸:MgCO3+2H+=Mg2++CO2↑+H2O
26、硫酸鎂溶液跟氫氧化鋇溶液反應:
Ba2++2OH–+Mg2++SO42–=BaSO4↓+Mg(OH)2↓
27、硫酸溶液跟氫氧化鋇溶液反應:Ba2++2OH–+2H++SO42–=BaSO4↓+2H2O
28、硫酸氫鈉溶液與氫氧化鋇反應至中性:2H++SO42–+2OH–+Ba2+=2H2O+BaSO4↓
29、硫酸氫鈉溶液與氫氧化鋇反應至硫酸根完全沈澱:
H++SO42–+OH–+Ba2+=BaSO4↓+H2O
30、硫酸鋁溶液中加入過量氫氧化鋇溶液:
2Al3++3SO42–+8OH–+3Ba2+=3BaSO4↓+2AlO2–+4H2O
31、氫氧化鎂與稀硫酸反應:Mg(OH)2+2H+=Mg2++2H2O
32、鋁跟氫氧化鈉溶液反應:2Al+2OH–+2H2O=2AlO2–+3H2↑
33、物質的量之比爲1:1NaAl合金置於水中:Na+Al+2H2O=Na++AlO2–+2H2↑
34、氧化鋁溶於強鹼溶液:Al2O3+2OH–=2AlO2–+H2O
35、氧化鋁溶於強酸溶液:Al2O3+6H+=2Al3++3H2O
36、氫氧化鋁與氫氧化鈉溶液:Al(OH)3+OH–=AlO2–+2H2O
37、氫氧化鋁與鹽酸溶液反應:Al(OH)3+3H+=Al3++3H2O
38、硫酸鋁溶液與碳酸氫鈉溶液:Al3++3HCO3-=Al(OH)3↓+CO2↑
39、硫酸鋁溶液與碳酸鈉溶液:2Al3++3CO32–+3H2O=2Al(OH)3↓+3CO2↑
40、氯化鋁溶液中加入過量氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+
41、明礬溶液加熱水解生成沈澱:Al3++3H2O=Al(OH)3↓+3H+
42、氯化鋁溶液與偏鋁酸鈉溶液:Al3++3AlO2–+6H2O=4Al(OH)3↓
43、偏鋁酸鈉溶液中加入氯化鐵溶液:Fe3++3AlO2–+6H2O=Fe(OH)3↓+3Al(OH)3↓
44、偏鋁酸鈉溶液中加入少量鹽酸:AlO2–+H++H2O=Al(OH)3↓
45、偏鋁酸鈉溶液中加入過量鹽酸:AlO2–+4H+=Al3++2H2O
46、偏鋁酸鈉溶液中加入氯化銨溶液:AlO2–+NH4++H2O=Al(OH)3↓+NH3↑
47、金屬鐵溶於鹽酸中:Fe+2H+=Fe2++H2↑
48、鐵粉與氯化鐵溶液反應:Fe+2Fe3+=3Fe2+
49、銅與氯化鐵溶液反應:Cu+2Fe3+=Cu2++3Fe2+
50、硫化亞鐵與鹽酸反應:FeS+H+=Fe2++H2S↑
51、硫化鈉與鹽酸反應:S2–+2H+=H2S↑
52、硫化鈉溶液中加入溴水:S2–+Br2=S↓+2Br–
53、氯化亞鐵溶液中通入氯氣:2Fe2++Cl2=2Fe3++2Cl–
54、向硫酸鐵的酸性溶液中通入足量的H2S:2Fe3++H2S=2Fe2++S↓+2H+
55、氯化鐵溶液中滴加少量硫化鈉溶液:2Fe3++S2–=S↓+2Fe2+
56、硫化鈉溶液中滴加少量氯化鐵溶液:2Fe3++3S2–=S↓+2FeS↓
57、氯化鐵溶液中滴加少量碘化鉀溶液:2Fe3++2I–=2Fe2++I2
58、氯化鐵溶液與氫氧化鈉溶液反應:Fe3++3OH–=Fe(OH)3↓
59、氯化鐵溶液跟過量氨水反應: Fe3++3NH3?H2O=Fe(OH)3↓+3NH4+
60、氯化鐵溶液與硫氰化鉀溶液: Fe3++3SCN–=Fe(SCN)3
61、氯化鐵溶液跟過量鋅粉反應: 2Fe3++3Zn=2Fe+3Zn2+
62、鋅與稀硫酸: Zn+2H+=Zn2++H2↑
63、鋅與醋酸: Zn+2CH3COOH=CH3COO–+Zn2++H2↑
64、鋅與氯化銨溶液: Zn+2NH4+=Zn2++NH3↑+H2↑
65、氯化鐵溶液加入碘化鉀溶液: 2Fe3++2I-=2Fe2++I2
66、硫酸亞鐵溶液中加用硫酸酸化的過氧化氫溶液:2Fe2++H2O2+2H+=2Fe3++2H2O
67、硫酸亞鐵溶液中加用硫酸酸化的高錳酸鉀溶液:
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
68、四氧化三鐵溶於濃鹽酸: Fe3O4+8H+=2Fe3++Fe2++4H2O
69、氧化鐵溶於鹽酸: Fe2O3+6H+=2Fe3++3H2O
70、氧化鐵溶於氫碘酸溶液: Fe2O3+2I-+6H+=2Fe2++I2+3H2O
71、用氯化鐵與沸水反應制氫氧化鐵膠體:Fe3++3H2O Fe(OH)3+3H+
72、向溴化亞鐵溶液通入足量的氯氣:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
73、向溴化亞鐵溶液通入少量氯氣: 2Fe2++Cl2=2Fe3++2Cl-
74、向碘化亞鐵溶液通入足量氯氣: 2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-
75、向碘化亞鐵溶液通入少量氯氣: 2I-+Cl2=I2+2Cl-
76、碘化鉀溶液中加入氯水: 2I-+Cl2=I2+2Cl-
77、碘化鉀溶液中加入過量氯水: I-+3Cl2+3H2O=6H++IO3-+6Cl-
78、溴化鈉溶液中加入氯水: 2Br-+Cl2=Br2+2Cl-
79、亞硫酸溶液中加入氯水: H2SO3+Cl2+H2O=4H++2Cl-+SO42-
80、亞硫酸溶液中加入氯化鐵: H2SO3+2Fe2++H2O=4H++2Fe2++SO42-
81、亞硫酸溶液中加入雙氧水: H2SO3++H2O2=2H++H2O+SO42-
82、氯氣通入水中: Cl2+H2O=H++Cl-+HClO
83、氯氣通入碳酸氫鈉溶液中: Cl2+HCO3=Cl-+CO2+HClO
84、亞硫酸鈉溶液中加入溴水: SO32-+H2O+Br2=SO42-+Br-+2H+
85、亞硫酸鈉溶液中加入雙氧水: SO32-+H2O2=SO42-+2H2O
86、二氧化硫通入溴水中: SO2+Br2+2H2O=4H++2Br-+SO42-
87、單質鐵溶於過量稀硝酸中(NO):Fe+NO3-+4H+=Fe3++NO↑+2H2O
88、過量單質鐵溶於稀硝酸中(NO):3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O
89、單質銅與稀硝酸反應: 3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
90、單質銅與濃硝酸反應: Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O
91、銅片插入硝酸銀溶液: 2Ag++Cu=2Ag+Cu2+
92、用氨水吸收少量SO2: SO2+2NH3+H2O=2NH4++SO32-
93、用氨水吸收過量的SO¬2 : SO2+NH3+H2O=NH4++HSO3-
94、稀硝酸中通入SO2: 3SO2+2NO3-+2H2O=3SO42-+2NO↑+4H+
95、濃硝酸中通入SO2: SO2+2NO3-=SO42-+2NO2↑
96、氯化銨與氫氧化鈉兩種濃溶液混合加熱:NH4++OH- NH3↑+H2O
97、向次氯酸鈣溶液中通入SO2: Ca2++SO2+ClO-+H2O=CaSO4↓+Cl-+2H+
98、用碳酸鈉溶液吸收過量SO2: CO32-+H2O+2SO2=CO2↑+2HSO3-
99、硫酸銅溶液中通入硫化氫: H2S+Cu2+=CuS↓+2H+
100、硫酸銅溶液中加入硫化鈉溶液:S2-+Cu2+=CuS↓
101、電解飽和食鹽水: 2Cl-+2H2O 2OH-+H2↑+Cl2↑
102、電解硫酸銅溶液: 2Cu2++2H2O 2Cu↓+O2↑+4H+
103、電解氯化銅溶液: Cu2++2Cl- Cu↓+Cl2↑
104、電解熔融氯化鈉: 2Na++2Cl-(熔融) 2Na+Cl2↑
105、電解熔融氧化鋁: 4Al3+ +6O2- 4Al+3O2↑
106、二氧化錳與濃鹽酸共熱: MnO2+2Cl-+4H+ Mn2++Cl2↑+2H2O
107、氯氣通入冷的氫氧化鈉溶液中:Cl2+2OH-=Cl-+ClO-+H2O
108、氯氣通入熱的氫氧化鉀溶液中:3Cl2+6OH-=5Cl-+ClO3-+3H2O
109、次氯酸鈣溶液通入過量的二氧化碳:ClO-+H2O+CO2=HClO+HCO3-
110、次氯酸鈉溶液中加入濃鹽酸: ClO-+Cl-+2H+=Cl2↑+H2O
111、氯酸鉀與濃鹽酸: ClO3-+5Cl-+6H+=3Cl2↑+3H2O
112、硫化鈉、亞硫酸鈉混合液中加入稀硫酸:2S2-+SO32-+6H+=3S↓+3H2O
113、NO2溶于水: 3NO2+H2O=2H++NO3-+NO↑
114、NO2通入亞硫酸鈉溶液: SO32-+NO2=SO42-+NO↑
115、硫化鈉的第一步水解: S2-+H2O HSO3-+OH-
116、碳酸鈉的第一步水解: CO32-+H2O HCO3-+OH-
117、氯化鋇溶液與硫酸反應: Ba2++SO42-=BaSO4↓
118、硫溶於熱的氫氧化鈉溶液: 3S+6OH-=2S2-+SO32-+3H2O
119、醋酸鋇溶液與硫酸反應:Ba2++2CH3COO-+2H++SO42-=BaSO4↓+2CH3COOH
120、醋酸與氫氧化鉀溶液反應: CH3COOH+OH-=CH3COO-+H2O
121、醋酸與氨水反應: CH3COOH+NH3?H2O=CH3COO-+NH4++2H2O
122、苯酚溶於氫氧化鈉溶液: C6H5OH+OH-=C6H5O-+H2O
123、苯酚與氯化鐵溶液反應: 6C6H5OH+Fe3+=[Fe(C6H5O)6]3-+6H+
124、苯酚鈉溶於醋酸溶液: C6H5O-+CH3COOH=C6H5OH+CH3COO-
125、苯酚鈉溶液中通入少量CO2:C6H5O-+H2O+CO2=C6H5OH+HCO3-
126、碳酸鈉溶液中加入過量苯酚:C6H5OH+CO32-=C6H5O-+HCO3-
127、碳酸鈣跟甲酸反應: CaCO3+HCOOH=Ca2++CO2↑+H2O+HCOO-
128、甲酸鈉跟鹽酸反應: HCOO-+H+=HCOOH
129、小蘇打溶液與甲酸溶液反應:HCOOH+HCO3-=CO2↑+H2O+HCOO-
130、Na2C2O4溶液中加入酸性高錳酸鉀溶液:
5C2O42-+2MnO4-+16H+=10CO2↑+2Mn2++8H2O
131、酸性高錳酸鉀溶液與雙氧水:5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O
132、酸性氯化亞鐵溶液與雙氧水:2Fe2++H2O2+2H+=2Fe3++2H2O
133、SO2通入酸性高錳酸鉀溶液:5SO2+2MnO4-+2H2O=5SO42-+2Mn2++4H+
134、乙烯通入酸性高錳酸鉀溶液生成CO2:
5C2H4+12MnO4-+36H+=10CO2↑+12Mn2++28H2O
135、乙酸乙酯與氫氧化鈉溶液:CH3COOCH2CH3+OH-=CH3COO-+HOCH2CH3
136、硬脂酸甘油酯與氫氧化鈉溶液:
(C17H35COO)3(C3H5O3)+3OH-=3C17H35COO-+CH2(OH)CH(OH)CH2OH
137、氯乙烷在氫氧化鈉溶液中水解:CH3CH2Cl+OH-=CH3CH2OH+Cl-
138、硝酸銀溶液中滴入少量氨水: Ag++NH3?H2O=AgOH↓+NH4+
139、硝酸銀溶液中滴加氨水至過量:Ag++2NH3?H2O=[Ag(NH3)2]++2H2O
140、葡萄糖發生銀鏡反應:
CH2(OH)(CHOH)4CHO+2[Ag(NH3)2]++2OH-=
CH2(OH)(CHOH)4COO-+NH4++3NH3+H2O+2Ag↓
141、硫酸銅溶液中加入氫氧化鈉溶液:Cu2++2OH-=Cu(OH)2↓
142、硫酸銅溶液中加入少量氨水:Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+
143、硫酸銅溶液中加入過量氨水:Cu2++4NH3?H2O=[Cu(NH3)4]2++4H2O
144、硫酸鋅溶液中加入少量氨水:Zn2++2NH3?H2O=Zn(OH)2↓+2NH4+
145、硫酸鋅溶液中加入過量氨水:Zn2++4NH3?H2O=[Zn(NH3)4]2++4H2O
…… …… 余下全文
篇八 :(完美版)高中有机化学方程式总结
高中有机化学方程式总结
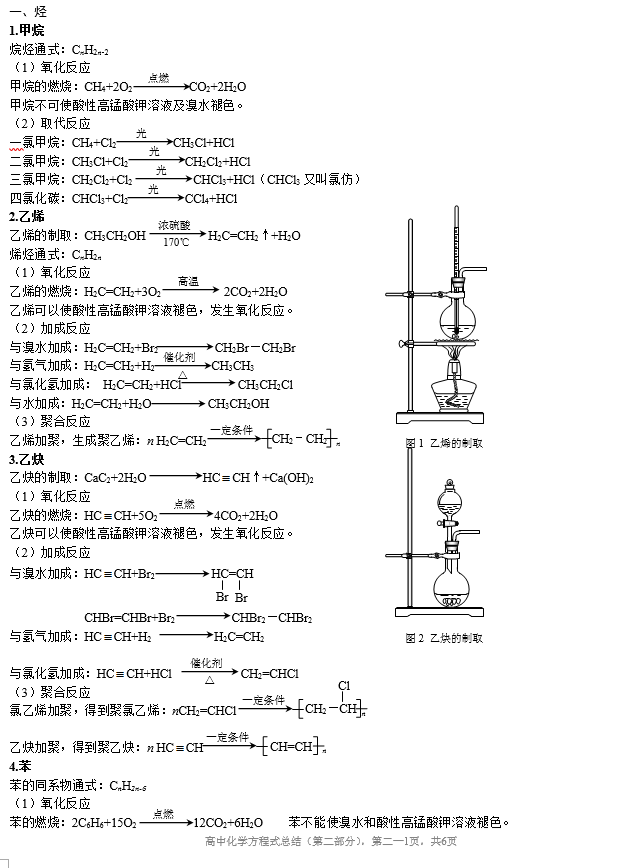
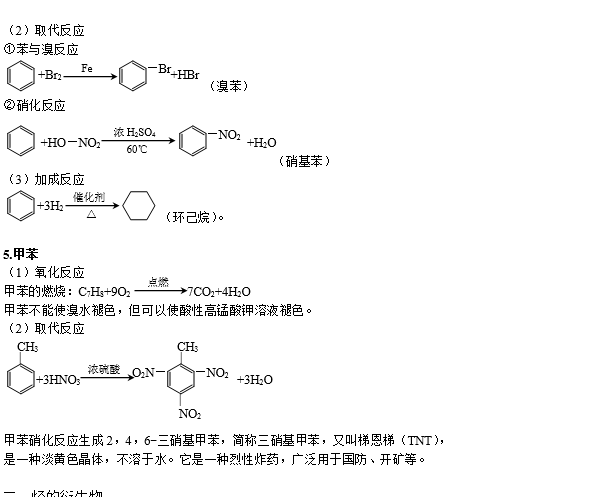
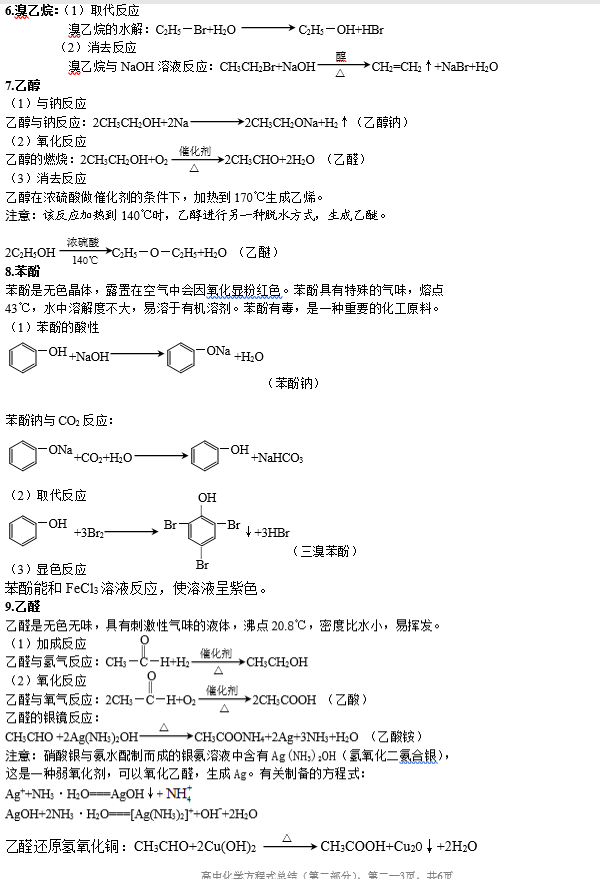
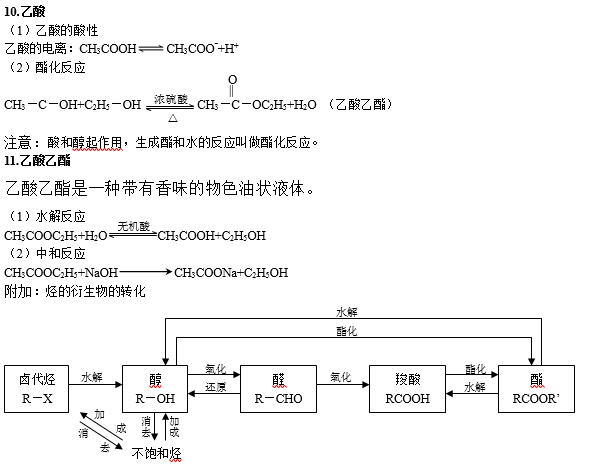
二、烃的衍生物
烃的衍生物的重要类别和主要化学性质:

高中有机化学知识点总结
1.需水浴加热的反应有: (1)、银镜反应(2)、乙酸乙酯的水解(3)苯的硝化(4)糖的水解 (5)、酚醛树脂的制取(6)固体溶解度的测定 凡是在不高于100℃的条件下反应,均可用水浴加热,其优点:温度变化平稳,不会大起大落,有利于反应的进行。
2.需用温度计的实验有: (1)、实验室制乙烯(170℃) (2)、蒸馏 (3)、固体溶解度的测定 (4)、乙酸乙酯的水解(70-80℃) (5)、中和热的测定 (6)制硝基苯(50-60℃) 〔说明〕:(1)凡需要准确控制温度者均需用温度计。(2)注意温度计水银球的位置。
3.能与Na反应的有机物有: 醇、酚、羧酸等——凡含羟基的化合物。
4.能发生银镜反应的物质有: 醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖——凡含醛基的物质。
…… …… 余下全文