乙酰乙酸乙酯

乙酰乙酸乙酯
中文别名:乙酰醋酸乙酯;丁酮酸乙酯;
CAS:141-97-9
EINECS 号:205-516-1
分子式:C6H10O3
分子量:130.14
物化性质:
性 状: 无色液体,具有愉快的水果香气。
熔 点: <-45℃
沸 点: 181℃
相对密度: 1.0282
折光率 : 1.4194
闪 点: 84.4℃
溶解性: 与一般有机溶剂混溶,易溶于水。
产品用途:用于有机合成、香料、染料及医药工业 。
PRODUCT:ETHYL ACETOACETATE
CATEGORY:Acetoacetic ester; EAA; Ethyl 3-oxobutanoate; Ethyl acetoacetate; Ethyl acetylacetate; Ethyl beta-ketobutyrate;
CAS:141-97-9
EINECS NO:205-516-1
MOLECULAR FORMULA:C6H10O3
MOLECULAR WEIGHT:130.14
PHYSICAL AND CHEMICAL PROPERTIES:
TRAITS: A colorless liquid. With pleasant fruit aroma.
MELTING POINT: <-45℃
BOILING POINT: 181℃
RELATIVE DENSITY: 1.0282
REFRACTIVE INDEX: 1.4194
FLASHING POINT: 84.4℃
SOLUTION: With general immiscible organic solvent, and water-soluble.
PURPOSES:Ethyl acetoacetate in organic synthesis of very wide.
第二篇:实验二 乙酰乙酸乙酯的制备
实验二 乙酰乙酸乙酯的制备
一、实验目的
1、学习制备乙酰乙酸乙酯的原理和方法,加深对Claisen酯缩合反应原理的理解和认识;
2、熟悉在酯缩合反应中金属钠的应用和操作;
3、复习无水操作和液体干燥;
4、了解减压蒸馏的原理和应用范围,认识减压蒸馏的主要仪器设备,并初步掌握减压蒸馏仪器的安装和操作方法。
二、实验原理
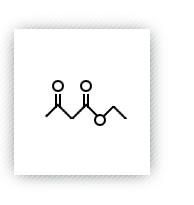
含有α-H的酯在碱性催化剂存在下,能和另一分子酯发生缩合反应生成β-酮酸酯,这类反应称为Claisen酯缩合反应。乙酰乙酸乙酯就是通过这个反应制备的。
反应式:
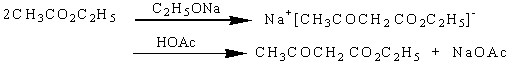
反应机理:
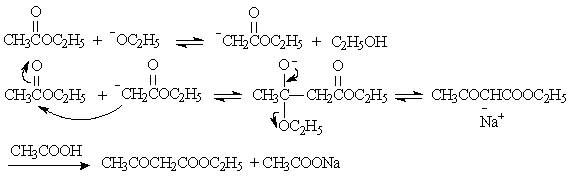
其催化剂是乙醇钠。因为金属钠和残留在乙酸乙酯中少量乙醇(少于3%)作用后就有乙醇钠生成。乙酰乙酸乙酯的生成是经过如下一系列平衡反应:
C2H5OH+Na→C2H5ONa+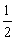 H2
H2
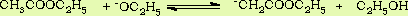

随着反应的进行,也不断地生成了醇,所以反应就能不断地进行下去,直至金属钠消耗。乙酸乙酯中总是含有少量乙醇副产物,所以此对反应有利。但如果作原料的酯中乙醇的含量过大时,对反应也是不利的。因为Claisen酯缩合反应是可逆的,β-酮酯在醇和醇钠的作用下可分解为两分子酯,使产率降低:

三、实验部分
1、实验仪器:圆底烧瓶、分液漏斗、球形冷凝管、直形冷凝管、干燥管、减压蒸馏装置、烧杯、锥形瓶、量筒、滴管、玻璃棒、电热套等
2、实验药品:乙酸乙酯、Na、二甲苯、HOAc(50%)、饱和NaCl、无水Na2SO4、CaCl2
【主要反应试剂及产物的物理常数】
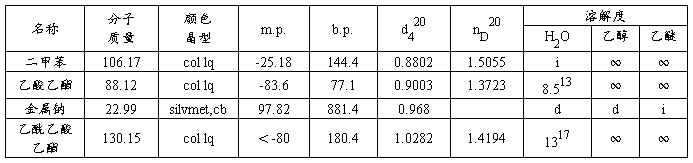
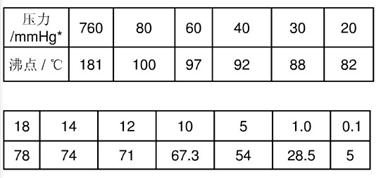
【乙酰乙酸乙酯沸点与压力的关系】
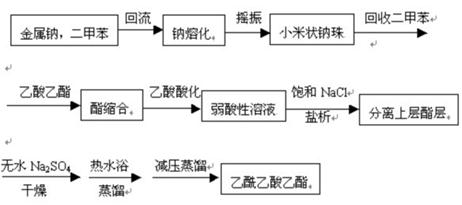
3、操作步骤
1.安装回流反应装置
2.制钠珠:将金属0.9g(39.1 mmol)Na迅速切成薄片,放入50mL的圆底烧瓶中,并加入10mL经过干燥的二甲苯,小火加热回流使熔融,拆去冷凝管,用橡皮塞塞住瓶口,用力振摇即得细粒状钠珠。稍冷后将二甲苯滗入回收瓶。
3.加酯回流:迅速放入10mL(9g,102.2mmol)乙酸乙酯,反应开始。若慢可温热。回流至钠基本消失,得橘红色溶液,有时析出黄白色沉淀(均为烯醇盐)。
4.酸化:加入50%醋酸至反应液呈弱酸性(pH=5~6),固体未溶完可加少量水溶完。
5.分液:反应液转入分液漏斗,加等体积饱和氯化钠溶液,振摇,静置,分液。水层(下层)用8mL乙酸乙酯萃取,萃取液和有机层合并,倒入锥形瓶中,并用适量的无水Na2SO4干燥。
6.蒸馏:将已充分干燥的有机混合液水浴加热蒸馏出未反应的乙酸乙酯,停止蒸馏,冷却。
7.将蒸馏得到的剩余物移至10mL圆底瓶中进行减压蒸馏,收集馏分。
【实验装置图】
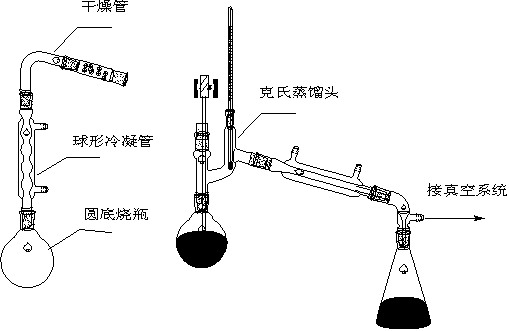
【实验流程】
4、实验注意事项:
(1)仪器干燥,严格无水。金属钠遇水即燃烧爆炸,故使用时应严格防止钠接触水或皮肤。钠的称量和切片要快,以免氧化或被空气中的水气侵蚀。多余的钠片应及时放入装有烃溶剂(通常二甲苯)的瓶中。
(2)本实验的关键:是所用仪器必须是干燥的,所用的乙酸乙酯必须是无水的。水的存在金属钠易与水反应生成放出氢气及大量的热易导致燃烧和爆炸。NaOH的存在易使乙酸乙酯水解成乙酸钠,更重要的是水的存在使金属钠消耗难以形成碳负离子中间体,导致实验失败。
(3)摇钠为本实验关键步骤,因为钠珠的大小决定着反应的快慢。钠珠越细越好,应呈小米状细粒。否则,应重新熔融再摇。钠珠的制作过程中间一定不能停,且要来回振摇,使瓶内温度下降不至于使钠珠结块。
(4)醋酸不能多加,否则会造成乙酰乙酸乙酯的溶解损失。用醋酸中和时,若有少量固体未溶,可加少许水溶解,避免加入过多的酸。
(5)体系压力(mmHg)= 外界大气压力(mmHg)— 水银柱高度差(mmHg)[开口式压力计]
(6)在系统充分抽空后通冷凝水,再加热蒸馏。一旦减压蒸馏开始,就应密切注意蒸馏情况,调整体系内压,经常记录压力和相应的沸点值,根据要求,收集不同馏分。
(7)蒸馏完毕,移去热源,慢慢旋开螺旋夹(防止倒吸),并慢慢打开二通活塞,平衡内外压力,使测压计的水银柱慢慢地回复原状,(若打开得太快,水银柱很快上升,有冲破测压计的可能),然后关闭油泵和冷却水。
(8)液体样品不得超过容器的1/2。
(9)减压蒸馏前先抽真空,真空稳定后再慢慢升温。
(10)装仪器时,首先要求检查磨口仪器是否有裂纹。安装仪器时每一个磨口都必须配合好同时为了提高气密性要求在磨口上涂凡士林。
四、结果与讨论
1、实验步骤及现象
制钠珠 加热后钠成熔融状态,趁热摇匀后得到小钠珠。
回流、酸化 金属钠逐渐消失,溶液呈红棕色透明液体。加入酸后先有黄白色固体生成,继续加酸后固体消失,溶液呈黄棕色。
分液、干燥 分液干燥后得到黄棕色液体。
减压蒸馏 气压为8.2kpa,温度为31℃时有前馏分蒸出,气压为4.6kpa温度为83℃时有馏分蒸出,此时开始收集产物。收集到的产物为淡黄色透明液体。
2、实验思考
(1)为什么使用二甲苯做溶剂,而不用苯或甲苯?
答:因为二甲苯:b.p.140℃,苯:b.p.80.1℃,甲苯:b.p.110.6℃,而钠的熔化温度为97.5℃,所以选用二甲苯比较好。
(2)为什么要做钠珠? 答:增大钠的比表面积,利于反应。
(3)为什么用醋酸酸化,而不用稀盐酸或稀硫酸酸化?
答:因为用稀盐酸或稀硫酸的话,酸性太强,会增大乙酸乙酰乙酯在水中的溶解度,而醋酸的酸性比较适合。
(4)加入饱和食盐水的目的是什么? 答:降低酯在水中的溶解度,提高收率。
(5)中和过程开始析出的少量固体是什么? 答:析出的是烯醇盐。
(6)乙酰乙酸乙酯沸点并不高,为什么要用减压蒸馏的方式?
答:因为乙酰乙酸乙酯在常压蒸馏时易分解,产生去水乙酸。所以为了减少副反应的发生,提高产率,采用减压蒸馏的方式比较好。
(7)在怎样的情况下才用减压蒸馏?
答:沸点高的物质以及在普通蒸馏时还没达到沸点温度就已分解,氧化或聚合的物质才用减压蒸馏。
(8)使用油泵减压时,实有哪些吸收和保护装置?其作用是什么?
答:油泵的结构较精密,工作条件要求较严,蒸馏时如有挥发性的有机溶剂、水、酸蒸气都会损坏泵和改变真空度。所以要有吸收和保护装置。
主要有:①冷阱:使低沸点(易挥发)物质冷凝下来不致进入真空泵;②无水CaCl2干燥塔:吸收水汽;③粒状氢氧化钠塔:吸收酸性气体;④切片石蜡:吸收烃类物质。
(9)在进行减压蒸馏时,为什么必须用热浴加热,而不能用直接火加热?为什么进行减压蒸馏时须先抽气才能加热?
答:用热浴的好处是加热均匀,可防止暴沸,如果直接用火加热的话,情况正好相反。因为系统内充满空气,加热后部分溶液气化,再抽气时,大量气体来不及冷凝和吸收,会直接进入真空泵,损坏泵改变真空度。如先抽气再加热,可以避免或减少之。
(10)当减压蒸完所要的化合物后,应如何停止减压蒸馏?为什么?
答:蒸馏完毕移去热源,慢慢旋开螺旋夹,并慢慢打开二通活塞,(这样可以防止倒吸),平衡内外压力,使测压计的水银柱慢慢地回复原状(若放开得太快,水银柱很快上升,有冲破压力计的可能)然后关闭油泵和冷却水。
-
乙酰乙酸乙酯的制备 实验报告
乙酰乙酸乙酯的制备前言乙酰乙酸乙酯无色至淡黄色的澄清液体微溶于水易溶于乙醚乙醇有刺激性和麻醉性可燃遇明火高热或接触氧化剂有发生燃烧…
-
乙酰乙酸乙酯的制备
理论产量0041301452g产率八问题和讨论1本实验所用仪器未经干燥处理对反应有何影响答一开始要用到纯的金属钠有水会发生局部过热…
-
乙酰乙酸乙酯的制备
乙酰乙酸乙酯的制备实验目的1了解通过Claisen缩合反应由乙酸乙酯制备三乙的基本原理和方法2了解和掌握减压蒸馏装置的原理和作用实…
-
乙酰乙酸乙酯的制备.doc1.
乙酰乙酸乙酯的制备作者化工106程鹏摘要含有a氢的酯在碱性催化剂存在下能和另一份子酯发生克莱森酯缩合反应生成酮酸酯乙酰乙酸乙酯就是…
-
乙酰乙酸乙酯的制备
实验报告课程名称合成化学实验名称乙酰乙酸乙酯的制备二级学院化学化工学院专业化学姓名汪建红实验次数2实验日期3月18日验条件室温相对…
-
20xx-20xx第一学期早教工作总结
20xx-20xx学年度联村早教点第一学期工作总结时间过得真快,转眼间一学期的早教生活又接近尾声,想想过去,尽管我还没有完全走进他…
-
教师个人自修总结
作为教师,既应有高水平的思想政治素质、爱岗敬业的职业道德素质,也应该不断地学习和接受培训。这一学期我要立足岗位,以集体备课、业务学…
-
太仓项目部年度工作总结
20xx年开工以来,在公司领导的关心和同事们支持帮助下,太仓项目部坚持“质量第一,工程精品;安全第一,预防为主;文明施工,保护环境…
-
20xx年汽车运用与维修专业指导委员会工作总结
20xx年学汽车运用与维修专业指导委员会工作总结学校汽车运用与维修专业指导委员会(以下简称专委会)成立后启动工作的第一年,也是专委…
-
身边的发展之路校友访谈交流会活动总结
“身边的发展之路”校友访谈交流会活动总结——郑棣文一、活动主题:“身边的发展之路”二、举办单位:主办:团学新闻中心校友发展处协办:…