乙酰乙酸乙酯的制备

实 验 报 告
课程名称 合成化学 实验名称 乙酰乙酸乙酯的制备
二级学院 化学化工学院 专业 化学 姓名 汪建红 实验次数 2
实验日期: 3 月 18 日
验条件:室温 ℃ 相对湿度 % 大气压 mmHg
一、实验目的
1、学习乙酰乙酸乙酯制备的原理和方法;
2、掌握无水操作及减压蒸馏等操作。
二、实验原理
1、乙酰乙酸乙酯的结构
乙酰乙酸乙酯存在互变异构现象,是酮式和烯醇式混合物,室温下酮式(92%),烯醇式(8%)

异构体表现出各自的性质,一定条件下可分离为纯物质,微量酸碱下呈迅速转化的平衡混合物,溶剂对平衡有明显影响。
2、乙酰乙酸乙酯的作用或者用途
其钠化物可与卤代烷发生亲核取代,生成一烷基或二烷基取代的乙酰乙酸乙酯,
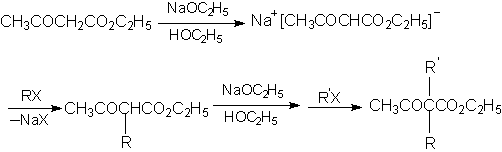
取代的乙酰乙酸乙酯可发生酸式和酮式水解两种水解方式,用冷的稀碱处理,酸化后加热脱羧,即酮式水解,可用来生成酮:
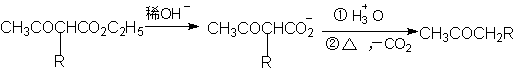
如与浓碱在醇溶液中加热,则发生酸水解,生成取代乙酸
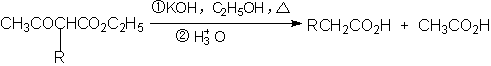
丙二酸酯可得到更高产率的取代乙酸,乙酰乙酸乙酯的酸水解在合成中已很少用
3、乙酰乙酸乙酯的合成方法
含α-活泼氢的酯,在碱性条件下能与另一分子酯发生Claisen酯缩合,生成β-羰基酸酯,乙酰乙酸乙酯就是这样制备的,用金属钠作缩合试剂时,真正的催化剂是钠与乙酸乙酯中少量的乙醇生成的醇钠,一旦反应开始,乙醇可不断产生,反应继续,若无少量乙醇则不能缩合。

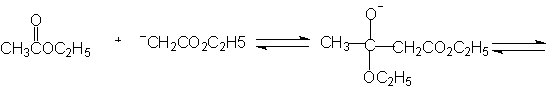

乙酰乙酸乙酯中亚甲基上的氢酸性比乙醇的强得多,最后一步实际上不可逆,生成的是乙酰乙酸乙酯的钠化合物。
反应式:
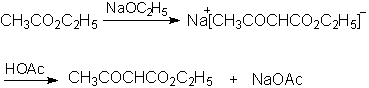
4、合成乙酰乙酸乙酯的主反应


三、仪器与试剂
仪器:圆底烧瓶,直型水冷凝管,干燥管,分液漏斗,温度计(250℃),克氏蒸馏头,三叉燕尾管,锥形瓶,酒精灯,铁架台,
试样:乙酸乙酯(A.R),金属钠(A.R),二甲苯(A.R),无水氯化钙(A.R),饱和氯化钠溶液,无水硫酸钠或无水硫酸镁(A.R)。
四、实验装置图
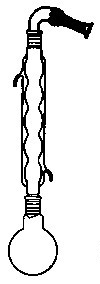
带干燥管的回流装置
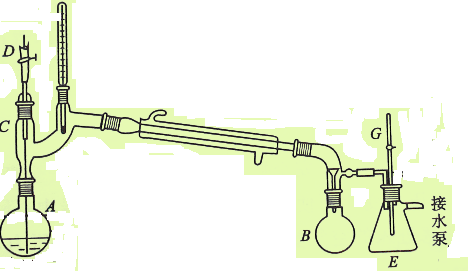
减压蒸馏装置
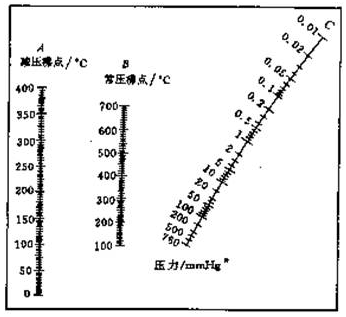
压力-沸点表

乙酰乙酸乙酯沸点-压力关系
五、实验步骤
1、钠珠的制备
50mL圆底烧瓶中加入0.9g金属钠和约5-7mL二甲苯,装上冷凝管。石棉网上小心加热使钠熔融,立即拆去冷凝管,用橡皮塞塞紧圆底烧瓶,用力来回摇振,即得细粒状钠珠。
2、乙酰乙酸乙酯钠盐的制备
稍经放置后钠珠即沉于瓶底,将二甲苯倒入公用回收瓶(切勿倒入水槽或废物缸,以免引起火灾,为什么?因为钠的存在)。迅速向瓶中加入10ml乙酸乙酯,重新装上冷凝管和氯化钙干燥管。
反应随即开始,并有氢气泡逸出。若反应不开始或者很慢,可稍加温热。待激烈反应过后,将反应瓶在石棉网上小心加热,保持微沸状态,直至所有金属钠几乎全部作用完为止,反应约需1.5h,此时生成的乙酰乙酸乙酯钠盐为橘红色透明液体。
3、乙酰乙酸乙酯粗产品的获得和洗涤
待反应物稍冷后,在摇荡下加入50%的醋酸溶液,直至反应液呈弱酸性为止,此时所有固体均已溶解。
将反应物转入分液漏斗,加入等体积的饱和氯化钠溶液,用力摇荡片刻,静置后分层,分出有机相,转入干燥锥形瓶中,加入无水硫酸钠干燥,用少量乙酸乙酯洗涤干燥剂。
4、乙酰乙酸乙酯产品的获得
沸水浴上蒸去未反应的乙酸乙酯,将剩余液减压蒸馏(常压蒸馏,乙酰乙酸乙酯很易分解而降低产量),收集产品乙酰乙酸乙酯,回收,量体积,计算产率。
5、回收废液,洗涤仪器,打扫卫生。
六、数据及现象记录
1、加入药品的量
2、反应过程中的现象
3、洗涤过程中的现象
4、最后产品体积
七、问题讨论
八、思考题
1、Claisen酯缩合反应的催化剂是什么?本实验为什么可用金属钠代替?
答:催化剂是钠与乙酸乙酯中残留的少量乙醇作用产生的乙醇钠。
因为在本实验中提供的乙酸乙酯含有1%-2%的乙醇,反应过程中就可以直接生成醇钠,故可以用金属钠代替。
2、本实验中加入50%醋酸溶液和饱和氯化钠溶液的目的何在?
答:因为乙酰乙酸乙酯分子中亚甲基上的氢比乙醇的酸性强得多(Pka=10.654),反应中生成的乙酰乙酸乙酯的钠盐,必须用醋酸酸化才能使乙酰乙酸乙酯游离出来。用饱和氯化钠溶液是为了降低酯在水中的溶解度,减少对产物的损失,增加产率。
3、什么叫互变异构现象?如何用实验证明乙酰乙酸乙酯是两种异构体的平衡化合物?
答:在一定条件下,两个构造异构体可以迅速地相互转变的现象,叫作互变异构体现象。如:

实验证明方法:
(1)用1%FeCl3溶液,能发生颜色反应,证明有C=C结构的存在。
(2)用Br2/CCl4溶液,能使溴退色证明有C=C存在。
(3)用NaHSO3溶液,有胶状沉淀生成证明有C=O存在(亦可用2,4-二硝基苯肼试验)。
4、写出下列化合物发生Claisen酯缩合反应的产物。
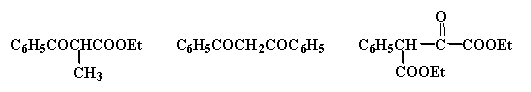
①苯甲酸乙酯和丙酸乙酯②苯甲酸乙酯和苯乙酮③苯乙酸乙酯和草酸乙酯
第二篇:乙酰乙酸乙酯的制备.doc1.
乙酰乙酸乙酯的制备
作者:化工10-6 程鹏
摘要: 含有a-氢的酯在碱性催化剂存在下,能和另一份子酯发生克莱森酯缩合反应,生成β-酮酸酯,乙酰乙酸乙酯就是通过这个反应制备的。其催化剂是乙醇钠,由金属钠和残留在乙酸乙酯中的少量乙醇(少于2%)作用产生的。
关键词: 金属钠;乙酸;乙酸乙酯;饱和NaCl;减压蒸馏
前言: 乙酰乙酸乙酯,无色至淡黄色的澄清液体。微溶于水,易溶于乙醚,乙醇。有刺激性气味。可燃,遇明火、高热或接触氧化剂有发生燃烧的危险。广泛应用于食用香精中,主要用以调配苹果、杏、桃等食用香精。制药工业用于制造氨基比林、维生素B等。染料工业作合成染料的原料和用于电影基片染色。涂料工业用于制造清。有机工业用作溶剂和合成有机化合物的原料。其有关反应如下: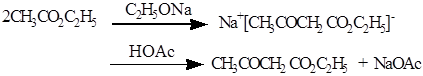
实验部分:
1.仪器和药品
仪器:磁力搅拌电热套,圆底烧瓶,球形冷凝管,直形冷凝管,分液漏斗,磨口锥形瓶,减压蒸馏装置
药品: 乙酸乙酯 25.0ml(22.5g,0.26mol); Na 2.5g(0.11mol); 二甲苯 15ml
乙酸 50% 20ml; 饱和NaCl 40ml; 无水Na2SO4
材料:PH试纸,滤纸
2.装置图:
(1)安装回流反应装置
(2)减压蒸馏装置
3.操作步骤:
1.制钠珠:将金属Na迅速切成薄片,放入100ml的圆底烧瓶中,并加入15ml二甲苯,小火加热回流使熔融,拆去冷凝管,用橡皮塞塞住瓶口,用力振摇即得细粒状钠珠。稍冷后将二甲苯滗入回收瓶。
2.加酯回流:迅速放入25ml乙酸乙酯,反应开始。若慢可温热。回流1.5h至钠反应完全,得橘红色溶液,有时析出黄白色沉淀(均为烯醇盐)。
3.酸化 :加50%醋酸(约20ml),至反应液呈弱酸性(固体溶完)。
4.分液:反应液转入分液漏斗,加等体积饱和氯化钠溶液,振摇,静置。
5.安装减压蒸馏装置。
6.蒸馏 :水浴蒸去乙酸乙酯,剩余物移至 50ml蒸馏瓶中进行减压蒸馏,收集馏分。
结果与讨论
1.实验现象
实验步骤 实验现象
制钠珠 加热后钠成熔融状态,趁热摇匀后得到小钠珠。
回流、酸化 金属钠逐渐消失,溶液呈红棕色透明液体。加入酸后先有黄白色固体生
成,继续加酸后固体消失,溶液呈黄棕色。
分液、干燥 分液干燥后得到黄棕色液体。
减压蒸馏 气压为8.2kp,温度为31℃时有前馏分蒸出,气压为4.6kp,温度为83℃
时有馏分蒸出,此时开始收集产物。收集到的产物为淡黄色透明液体。
2. 产率与产量
产量:产物为无色或淡黄色透明液体 4.7g,易溶于乙醇,乙醚,可燃。有机工业常用作溶剂和合成有机化合物的原料。
产率:4.7/22.5 *100% = 20.9%
3.实验成败的关键:
(1) 用乙酸酸化时,应避免加入过量,不然会增加酯在水中的溶解度而降低收率。
(2)乙酰乙酸乙酯在常温下蒸馏时很容易分解而降低产率,故采取减压蒸馏。
(3)本实验最好连续进行,间隔时间过长会降低收率。
【参考文献】
【1】 古风才、张文勤,基础化学实验教程 【M】 北京:科学出版社,2010
-
实验二 乙酰乙酸乙酯的制备
实验二乙酰乙酸乙酯的制备一实验目的1学习制备乙酰乙酸乙酯的原理和方法加深对Claisen酯缩合反应原理的理解和认识2熟悉在酯缩合反…
-
乙酰乙酸乙酯的制备 实验报告
乙酰乙酸乙酯的制备前言乙酰乙酸乙酯无色至淡黄色的澄清液体微溶于水易溶于乙醚乙醇有刺激性和麻醉性可燃遇明火高热或接触氧化剂有发生燃烧…
-
乙酰乙酸乙酯的制备
理论产量0041301452g产率八问题和讨论1本实验所用仪器未经干燥处理对反应有何影响答一开始要用到纯的金属钠有水会发生局部过热…
-
乙酰乙酸乙酯的制备
乙酰乙酸乙酯的制备实验目的1了解通过Claisen缩合反应由乙酸乙酯制备三乙的基本原理和方法2了解和掌握减压蒸馏装置的原理和作用实…
-
乙酰乙酸乙酯的制备
实验报告课程名称合成化学实验名称乙酰乙酸乙酯的制备二级学院化学化工学院专业化学姓名汪建红实验次数2实验日期3月18日验条件室温相对…
-
乙酰乙酸乙酯的制备 实验报告
乙酰乙酸乙酯的制备前言乙酰乙酸乙酯无色至淡黄色的澄清液体微溶于水易溶于乙醚乙醇有刺激性和麻醉性可燃遇明火高热或接触氧化剂有发生燃烧…
-
乙酰二茂铁的制备及柱色谱分离预习实验报告及思考题
乙酰二茂铁的制备及柱色谱分离一实验目的1通过乙酰二茂铁的制备理解FriedelCrafts酰基化反应原理2掌握机械搅拌等操作3掌握…
-
乙酰水杨酸的制备实验报告
乙酰水杨酸阿司匹林的合成实验报告一教学要求1通过本实验了解乙酰水杨酸阿斯匹林的制备原理和方法2进一步熟悉重结晶熔点测定抽滤等基本操…
-
实验1 乙酰水杨酸的合成实验报告
实验1乙酰水杨酸的合成实验目的掌握由酸酐作为酰基化试剂和醇反应制备酯的方法巩固普通蒸馏抽滤重结晶等基本操作学习应用显微镜熔点仪测定…
-
聚醋酸乙酯乳胶漆制备的实验报告
四川大学化学工程学院本科生专业实验报告海纳百川聚醋酸乙烯酯乳液的合成和乳胶漆的制备实验报告学生姓名毛书林班级10308034学号1…