实验五 醋酸标准离解常数和电离度的测定
实验五 醋酸标准离解常数和电离度的测定
一、实验目的
1.测定醋酸的标准离解常数和电离度,加深对标准离解常数和电离度的理解。
2.学习使用酸度计。
3.巩固移液管的基本操作及容量瓶的使用。
二、实验原理
醋酸是弱电解质,在溶液中存在如下的解离平衡:
HAc = Ac- + H+
其标准离解常数的表达式为
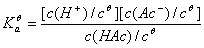 ⑴
⑴
式中c(H+),c(Ac-),c(HAc)分别为H+,Ac-,HAc的平衡浓度,cθ为标准浓度(即1mol·L-1)。
在单纯的HAc溶液中,若以c代表HAc的起始浓度,则c(HAc)=c—c(H+),而c(H+)=
c(Ac-),将此代入式⑴,得
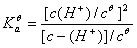 ⑵
⑵
另外,HAc的电离度α可表示为
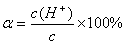 (3)
(3)
本实验用酸度计测定已知浓度HAc的pH值,代人式(2)、(3),即可求得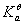 和α。
和α。
三、实验用品
仪器:酸度计,50mL(每组5只)容量瓶,滴定管,50mL烧杯(每组5只)
试剂:HAc(0.20 mol·L-1,准确浓度已标定),NaAc(0.20 mol·L-1),NaOH(0.20 mol·L-1),酚酞指示剂(w为0.001)
四、实验步骤
(一)醋酸标准离解常数和电离度的测定
1.配制不同浓度的醋酸溶液
用滴定管分别放出3.00mL,6.00mL,15.00mL已知浓度的HAc溶液于三只50mL容量瓶中,用蒸馏水稀释至刻度,摇匀。连同未稀释的HAc溶液可得到四种浓度不同的溶液,由稀到浓依次编号为1、2、3、4。
2.HAc溶液的pH测定
用五只干燥的50mL烧杯,分别盛人上述四种溶液各15-20mL,按由稀到浓的次序在酸度计上测定它们的pH值。将数据记录于表1。
(二)醋酸—醋酸钠缓冲溶液的标准离解常数的测定
取10.00mL的0.2mol/L的醋酸稀溶液,用NaOH溶液滴定到终点。然后再加10.00mL该醋酸溶液,混合均匀,测其pH值。将数据记录于表2。
五、数据记录及处理
表1 实验数据和计算结果 测定时温度 ℃

表2 实验数据和计算结果 测定时温度 ℃

1、计算不同摩尔浓度醋酸的标准解离常数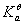 和电离度α。
和电离度α。
2、计算醋酸-醋酸钠缓冲溶液的标准离解常数。
六、通过预习回答下列问题
1.如果改变所测HAc溶液的温度,则电离度和标准离解常数有无变化
2.下列情况能否用近似公式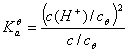 求标准离解常数。
求标准离解常数。
(1)所测HAc溶液浓度极稀;
(2)在HAc溶液中加入一定数量的NaAc(s);
(3)在HAc溶液中加入一定数量的NaCl(s)。
3.在本实验中,测定HAc的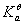 值时,HAc溶液的浓度必须精确测定;而测定未知酸的
值时,HAc溶液的浓度必须精确测定;而测定未知酸的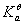 值时,酸和碱的浓度都不必测定,只要正确掌握滴定终点即可,这是为什么?
值时,酸和碱的浓度都不必测定,只要正确掌握滴定终点即可,这是为什么?
七、实验报告要求 写明实验的目的要求、原理、步骤,处理实验数据并对实验结果进行评价
第二篇:物化实验 溶解热的测定和电导法测定醋酸的电离常数
实验一 溶解热的测定
一、目的
1、了解电热补偿法测定热效应的基本原理及仪器使用。
2、测定硝酸钾在水中的积分溶解热,并用作图法求得其微分稀释热、积分稀释热和微分溶解热。
3、初步了解计算机采集处理实验数据、控制化学实验的方法和途径。
二、基本原理
1、物质溶解于溶剂过程的热效应称为溶解热。它有积分(或变浓)溶解热和微分(或定浓)溶解热两种。前者是1 mol溶质溶解在n0 mol溶剂中时所产生的热效应,以Qs表示。后者是1 mol溶质溶解在无限量某一定浓度溶液中时所产生的热效应,即 。
。
溶剂加到溶液中使之稀释时所产生的热效应称为稀释热。它也有积分(或变浓)稀释热和微分(或定浓)稀释热两种。前者是把原含1 mol溶质和n01 mol溶剂的溶液稀释到含溶剂n02 mol时所产生的热效应,以Qd表示,显然,Qd = Qs,n02 – Qs,n01。后者是1 mol溶剂加到无限量某一定浓度溶液中时所产生的热效应,即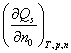 。
。
2、积分溶解热由实验直接测定,其它三种热效应则需通过作图来求:
设纯溶剂、纯溶质的摩尔焓分别为H*m,A和H*m,B,一定浓度溶液中溶剂和溶质的偏摩尔焓分别为Hm,A和Hm,B,若由nA mol溶剂和nB mol溶质混合形成溶液,则
混合前的总焓为 H = nAH*m,A + nBH*m,B
混合后的总焓为 H? = nAHm,A + nBHm,B
此混合(即溶解)过程的焓变为 ΔH = H? – H = nA(Hm,A – H*m,A)+ nB(Hm,B – H*m,B)
= nAΔHm,A + nBΔHm,B
根据定义,ΔHm,A即为该浓度溶液的微分稀释热,ΔHm,B即为该浓度溶液的微分溶解热,积分溶解热则为: 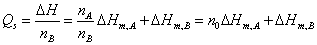
故在Qs ~ n0图上,某点切线的斜率即为该浓度溶液的微分稀释热,截距即为该浓度溶液的微分溶解热。如图所示:

3、本实验系统可视为绝热,硝酸钾在水中溶解是吸热过程,故系统温度下降,通过电加热法使系统恢复至起始温度,根据所耗电能求得其溶解热:Q = IVt = I2Rt 。本实验数据的采集和处理均由计算机自动完成。
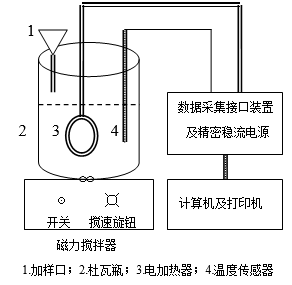
三、仪器和试剂
量热计(包括杜瓦瓶、电加热器、磁力搅拌器)1套,反应热数据采集接口装置1台,精密稳流电源1台,计算机1台,打印机1台,电子天平1台,台天平1台;硝酸钾(A.R.)约25.5g,蒸馏水216.2g。
四、操作步骤
1、按照仪器说明书正确安装连接实验装置,如图。
2、在电子天平上依次称取八份质量分别约为2.5、1.5、2.5、3.0、3.5、4.0、4.0、4.5 g的硝酸钾(应预先研磨并烘干),记下准确数据并编号。
3、在台天平上称取216.2 g蒸馏水于杜瓦瓶内。
4、打开数据采集接口装置电源,温度探头置于空气中预热3 min,电加热器置于盛有自来水的小烧杯中。
5、打开计算机,运行“SV溶解热”程序,点击“开始实验”,并根据提示一步步完成实验(先是测当前室温,此时可打开恒流源及搅拌器电源,调节搅拌速度,调节恒流源电流,使加热器功率在2.25 ~ 2.30 W之间,然后将加热器及温度探头移至已装好蒸馏水的杜瓦瓶中,按回车,开始测水温,等水温升至比室温高0.5℃时按提示及时加入第一份样品,并根据提示依次加完八份样品。实验完成后,退出,进入“数据处理”,输入水及八份样品的质量,点击“按当前数据处理”,打印结果)。
五、数据记录和处理(本实验数据处理由计算机自动完成)
1、 记录水的质量、八份硝酸钾样品的质量及相应的通电时间。
2、 计算n(H2O)。
3、 计算每次加入硝酸钾后的累计质量m(KNO3)和累计通电时间t 。
4、 计算每次溶解过程中的热效应Q:Q = IVt = I2Rt
5、 将算出的Q值进行换算,求出当把1 mol硝酸钾溶于n0 mol水中时的积分溶解热
Qs: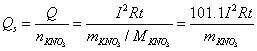
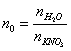
6、将以上数据列表并作Qs ~ n0图,从图中求出n0 = 80,100,200,300,400处的积分溶解热、微分稀释热、微分溶解热,以及n0从80→100,100→200,200→300,300→400的积分稀释热。
六、注意事项
1、 仪器要先预热,以保证系统的稳定性。在实验过程中要求I、V也即加热功率保持稳定。
2、 加样要及时并注意不要碰到杜瓦瓶,加入样品时速度要加以注意,防止样品进入杜瓦瓶过速,致使磁子陷住不能正常搅拌,也要防止样品加得太慢,可用小勺帮助样品从漏斗加入。搅拌速度要适宜,不要太快,以免磁子碰损电加热器、温度探头或杜瓦瓶,但也不能太慢,以免因水的传热性差而导致Qs值偏低,甚至使Qs ~ n0图变形。样品要先研细,以确保其充分溶解,实验结束后,杜瓦瓶中不应有未溶解的硝酸钾固体。
3、 电加热丝不可从其玻璃套管中往外拉,以免功率不稳甚至短路。
4、 配套软件还不够完善,不能在实验过程中随意点击按钮(如不能点击“最小化”)。
5、 先称好蒸馏水和前两份KNO3样品,后几份KNO3样品可边做边称。
七、思考讨论
1、 本实验装置是否适用于放热反应的热效应的测定?
2、 设计由测定溶解热的方法求 CaCl2(s) + 6H2O(l) = CaCl2?6H2O(s) 的反应热。
3、 实验开始时系统的设定温度比环境温度高0.5℃是为了系统在实验过程中能更接近绝热条件,减少热损耗。
4、 本实验装置还可用来测定液体的热容,水化热,生成热及液态有机物的混合热等。
5、 如无磁力搅拌器,亦可用长短两支滴管插入液体中,不断地鼓泡来代替。
实验二 电导的测定及其应用
一、目的
1、 了解溶液的电导、电导率和摩尔电导率的概念。
2、 测量弱电解质溶液的摩尔电导率,并计算其电离度和电离常数。
3、 掌握电导率仪的使用方法。
二、基本原理
电解质溶液是靠正、负离子的迁移来传递电流的。在弱电解质溶液中,只有已电离部分才能承担传递电量的任务。在无限稀溶液中可认为弱电解质已全部电离,此时,溶液的摩尔电导率为极限摩尔电导率Λ∞m ,它可由离子极限摩尔电导率相加而得到。
一定浓度下的摩尔电导率Λ m与无限稀溶液的摩尔电导率Λ∞m是有区别的。这由两个因素造成:一是电解质溶液的不完全离解,二是离子间存在着相互作用力。故Λ m又称为表观摩尔电导率。 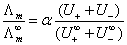
若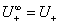 ,
,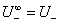 ,则
,则 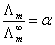
式中,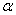 为电离度。
为电离度。
1 ? 1型弱电解质在溶液中电离达到平衡时,电离平衡常数K c,浓度c(以mol?dm –3 为单位),电离度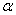 有如下关系:
有如下关系: 
根据离子独立移动定律,Λ∞m可以从离子的极限摩尔电导率计算出来,Λ m则可以从电导率的测定求得,从而求得电离度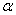 及电离平衡常数K c 。
及电离平衡常数K c 。
三、仪器和试剂
DDS-11A(T)型电导率仪1台,恒温槽1套;0.1000 mol?dm –3醋酸溶液。
四、操作步骤
1、 调整恒温槽温度为25.0 ± 0.3℃。
2、 用洗净、烘干的乂形管1支,加入20 mL、0.1000 mol?dm –3的醋酸溶液,测定其电导率。
3、 用吸取醋酸的移液管从电导池中吸出10 mL溶液弃去,用另一支移液管取10 mL电导水注入电导池,混合均匀,等温度恒定后,测其电导率。如此操作,共稀释4次。
4、 倒去醋酸,洗净电导池,最后用电导水淋洗。注入20 mL电导水,测其电导率。
五、数据记录和处理
1、 记录各浓度醋酸溶液的电导率及电导水的电导率。
2、 已知298.15 K时,无限稀溶液中离子的极限摩尔电导率Λ∞m(H+)= 0.034982 Ω –1 ·
m 2 · mol –1 ,Λ∞m(Ac–)= 0.00409 Ω –1 · m 2 · mol –1 ,计算醋酸的Λ∞m 。
3、 计算各浓度醋酸的摩尔电导率Λ m、电离度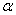 及电离平衡常数K c 。
及电离平衡常数K c 。
六、注意事项
1、 本实验配制溶液时,均需用电导水。
2、 温度对电导有较大影响,所以整个实验必须在同一温度下进行。每次用电导水稀释溶液时,需温度相同,故可预先把电导水装入锥形瓶,置于恒温槽中恒温。
七、思考讨论
1、 本实验为何要测水的电导率?
2、 实验中为何用镀铂黑电极?使用时应注意什么?
3、 温度升高一度,电导平均增加1.9%,即 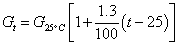
4、 普通蒸馏水中常溶有CO2和氨等杂质而存在一定电导,故实验所测的电导值是欲测电解质和水的电导的总和。作电导实验时需纯度较高的水,称为电导水。其制备方法,通常是在蒸馏水中加入少许高锰酸钾,用石英或硬质玻璃蒸馏器再蒸馏一次。
5、 铂电极镀铂黑的目的在于减少极化现象,且增加电极表面积,使测定电导时有较高灵敏度。铂黑电极不用时,应保存在蒸馏水中,不可使之干燥。
-
无机化学实验六 醋酸电离度和电离常数的测定1
实验六醋酸电离度和电离常数的测定pH法一实验目的1测定醋酸的电离度和电离常数2学习pH计的使用教学重点醋酸的电离度电离常数的测定教…
-
醋酸电离常数和电离度的测定
实验三醋酸电离常数和电离度的测定一实验目的1测定醋酸的电离常数加深对电离度的理解2学习正确使用pH计二实验原理醋酸CH3COOH或…
-
实验十五 醋酸电离度和电离常数的测定
实验十五醋酸电离度和电离常数的测定一教学要求1学习测定醋酸离解度和离解常数的基本原理和方法2学会酸度计的使用方法3巩固溶液的配制及…
-
醋酸电离度和电离常数的测定
实验题目醋酸电离度和电离常数的测定教材p5759一实验目的1测定醋酸的电离度和电离常数2掌握滴定原理滴定操作及正确判断滴定终点3练…
-
醋酸电离度和电离常数的测定—pH计的使用
醋酸电离度和电离常数的测定pH计的使用实验目的测定醋酸的电离度和电离常数进一步掌握滴定原理滴定操作及正确判断滴定终点学习使用pH计…
-
第四版无机化学实验报告实验十三:醋酸解离度和解离常数的测定——pH计的使用
实验名称醋酸解离和解离常数的测定pH计的使用实验日期温度气压一实验目的1测定醋酸的解离度和解离常数2掌握滴定原理滴定操作及正确判断…
-
采用分光光度法测定弱电解质的电离常数实验报告
采用分光光度法测定弱电解质的电离常数实验报告一实验目的1了解一种测定弱电解质电离常数的方法2掌握分光光度计的测试原理和使用方法3进…
-
四川理工实验报告电导法测定乙酸电离平衡常数 (2)
实验六电导法测定乙酸电离平衡常数报告人曾辉实验时间20xx年03月07日一实验目的1掌握电导电导率摩尔电导率的概念以及它们之间的相…
-
实验3 食用白醋的总酸度、电离度和电离常数的测定
实验3食用白醋的总酸度电离度和电离常数的测定教学目的与要求1学习食用白醋的总酸度电离度和电离常数的的原理和方法2学习酸度计的原理和…
-
报告示例:实验三__醋酸解离度和解离常数的测定
山东轻工业学院实验报告成绩课程名称基础化学实验1指导教师周磊实验日期院系专业班级实验地点实验楼A座412学生姓名学号同组人实验项目…
-
实验四 醋酸解离常数的测定
实验四醋酸解离常数的测定一pH法一实验目的1学习溶液的配制方法及有关仪器的使用2学习醋酸解离常数的测定方法3学习酸度计的使用方法二…