实验十五 醋酸电离度和电离常数的测定
实验十五 醋酸电离度和电离常数的测定
一、教学要求:
1. 学习测定醋酸离解度和离解常数的基本原理和方法;
2. 学会酸度计的使用方法;
3. 巩固溶液的配制及容量瓶和移液管的使用,学习溶液浓度的标定。
二、预习内容
1. 复习《无机及分析化学》有关电离度和电离常数部分的知识要点;
2. 容量瓶和移液管的使用;
3. 酸度计的工作原理;
四、实验原理
弱电解质HAc在水溶液中存在下列电离平衡:
HAc (aq)  H+ (aq) + Ac- (aq)
H+ (aq) + Ac- (aq)
其电离常数Kθ的表达式为:
 (1)
(1)
温度一定时,HAc的电离度为α,则cre(H+) = cre(Ac-) = crα,代人式 (1) 得:
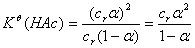 (2)
(2)
在一定温度下,用酸度计测一系列已知浓度的HAc溶液的pH值,根据pH = - lgcre(H+),可求得各浓度HAc溶液对应的cre(H+),利用cre(H+) = crα,求得各对应的电离度α值,将α代入(2)式中,可求得一系列对应的Kθ值。取α及Kθ的平均值,即得该温度下醋酸的电离常数Kθ(HAc)及值α(HAc)。
五、实验步骤
1. 配制不同浓度的醋酸溶液:
1) 取 5 只洗净烘干的 100 cm 3 小烧杯依次编成 1 # ~ 5 # ;
2) 从酸式滴定管中分别向 1 # , 2 # , 3 # , 4 # ,5 # 小烧杯中准确放入 3.00, 6.00,12.00,24.00,48.00 cm 3 已准确标定过的 HAc 溶液;
3) 用碱式滴定管分别向上述烧杯中依次准确放入 45.00, 42.00,36.00,24.00,0.00 cm 3 的蒸馏水,并用玻璃棒将杯中溶液搅混均匀。(思考题1)(思考题2)
2. 醋酸溶液pH的测定:
用酸度计分别依次测量 1 # ~5 # 小烧杯中醋酸溶液的 pH 值,并如实正确记录测定数据 ( 酸度计的使用参见教材P84 )。(思考题3)(思考题4)
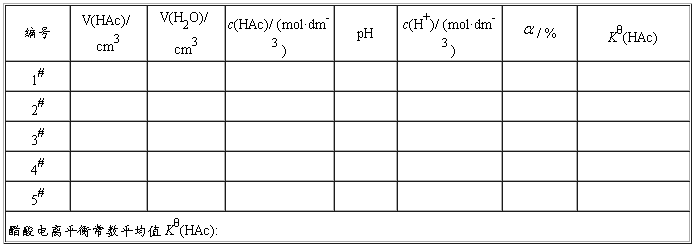
3. 数据记录和处理:
醋酸溶液的原始浓度:cr (HAc)= mol · dm -3 ,室温 = ℃
思考题1:烧杯是否必须烘干?
思考题2:如果搅拌结束后玻璃棒上带出了部分溶液对测定结果有无影响?
思考题3:测量时可否不用按照溶液浓度由低到高进行测量?
思考题4:使用酸度计的主要步骤有哪些?
答案 1:烧杯如果不烘干,残留的水份会影响所配制的溶液浓度,从而带来误差;
答案 2:没有影响,因为溶液浓度并没有发生变化;
答案 3:因该按照由低到高进行测量,这样带来的误差较小;
答案 4:主要步骤有:(1)打开电源开关进行预热;(2)进行温度补偿;(3)使用标准溶液进行定位;(4)使用标准溶液进行斜率校正;(5)测量pH值。
六、存在的问题
1. 烧杯没有洗干净和烘干;
2. 测量时没有从低浓度开始测量;
3. 电极没有清洗干净并吸干;
4. 没有进行温度补偿;
5. 实验结束忘了在电极上塞上盛有饱和氯化钾的塑料帽;
七、深入讨论
酸碱电离常数的常用实验测定方法:在Arrhenius 发现了电离现象后不久,Ostwald 于1888年使用电导率法第一次测量了电离平衡常数。直到1932年之前,电导率法一直是测定电离常数的最常用的方法。1932 年,Harned和Ehler 用实验证明了电势法可以得出和电导率法一样精确的结果,由于电势法快速简便且计算量小,所以很快取代了电导率法。一个1939年的比较严格的电离常数表里只采用了pKa在1.89 到5.15 之间的由电导率法测定的电离平衡常数。随着科技的不断进步,测量的技术手段也在不断提高,除了电导率法,电位法之外,还有紫外-可见分光光度法, 毛细管电泳法,核磁共振法等。每种方法都有各自的特点、适用范围和误差来源。
八、测试题
测试题1:当温度有明显变化时,解离常数也会发生变化( )A. 正确; B. 错误;
测试题2:温度一定时,不同浓度醋酸溶液的解离常数不相同( )A. 正确; B. 错误;
测试题3:玻璃电极下端的玻璃泡为一层极薄和特种玻璃制成,切忌与硬物接触,一旦破裂,则完全失效( )A. 正确; B. 错误;
测试题4:采用酸度计测定一系列同一种电解质溶液的pH值时,测定的顺序按浓度由稀到浓或由浓到稀所得到的结果完全相同( )A. 正确; B. 错误;
测试题5:酸的浓度、酸的强度和酸度三者是同一个概念,都可以用来描述酸溶液酸度的
大小( )A. 正确; B. 错误;
答案:1、A 2、B 3、A 4、B 5、B
第二篇:醋酸电离度和电离常数的实验测定
第25卷第10期20xx年10月赤峰学院学报(自然科学版)JournalofChifengUniversity(NaturalScienceEdition)Vol.25No.10
Oct.2009
醋酸电离度和电离常数的实验测定
马晓光
(赤峰学院
摘
化学系,内蒙古赤峰024000)
要:介绍了测定醋酸电离度和电离常数的实验原理、实验步骤、数据表达与处理等内容,进一步研
究了做好本实验的关键.
关键词:醋酸;电离度;电离常数;PH值中图分类号:O6-3
文献标识码:A
文章编号:1673-260X(2009)10-0015-02
由表1可得出以下结论:
①滴定前:由于HAc是弱电解质,其水溶液中存在以下电离平衡:
HAc=H++Ac-溶液中[H+]不等于HAc的原始浓度,[H+]浓度应根据HAc的电离常数来计算.
[H+]=√Kac=√1.76×10-5×0.1000=1.36×10-3
[HAc]=
(mol/L),PH=2.88而不是1.
⑵滴定开始至化学计量点前:滴定开始就有HAc-生成,由于同离子效应,抑制了HAc的电离,PH值增大较快;继续滴定,由于NaOH不断滴入,生成的NaAc不断增加,从而形成HAc-NaAc缓冲体系.溶液PH值变化较慢;在接近化学计量点时,由于HAc浓度迅速减小,缓冲作用减弱,PH增加较快.
⑶化学计量点时:生成的NaAc水解,溶液呈碱性.此时PH=8.73而不是7.
⑷化学计量点后:过量的碱抑制了NaAc的水解,PH值由过量NaOH决定.
PH2.884.707.748.72
0.020.20
9.7010.70
实验原理:HAC是弱酸,其水溶液中存在以下电离平衡:
HAC=H++Ac-其平衡关系式为Ki=[H+][Ac-]/[HAc]
[H+]、[Ac-]、[HAc]分别为c为HAc的起始浓度,
H+、Ac-、HAc的平衡浓度,α为电离度,Ki为电离平衡常数.
在纯的HAc溶液中,[H+]=[Ac-]=cαc(1-α),则α=[H+]/c×100%
Ki=[H+][Ac-]/[HAc]=[H+]2/c-[H+]当α<5%时,c-[H+]≈c故Ki=[H+]2/c根据以上关系,通过测定已知浓度的HAc溶液的pH,就知道[H+],从而就可以计算出HAc的电离度和电离常数.
实验步骤(一):指示剂的选择:先用强0.1000mol.l-1NaOH溶液滴定弱酸20ml0.1000mol.l-1HAc溶液,记录了滴定过程溶液PH值的变化情况,找出明显的突跃范围.见表1.
表1
加入NaOHHAc被滴定(mcl)0.0010.0019.9820.0020.0220.20
的百分数0.0050.0099.90100.0
剩余HAc过量NaOH(ml)20.0010.000.020.00
(ml)
⑸强碱滴定弱酸的突跃范围小,PH值7.75~9.70,化学计量点PH=8.73时在碱区,必须选择百里酚蓝、酚酞等指示剂.本实验选用酚酞作为化学计量点的指示剂.
实验步骤(二):醋酸溶液浓度的测定:用0.2021mol.l-1的NaOH标准溶液标定HAc的准确浓度.
(1)取25ml的HAc于250ML的锥形瓶中(2)往锥形瓶中的HAc溶液加入4滴酚酞指示剂.(3)用0.2021mol.l-1NaOH标准溶液直至HAc溶液出现淡红色停止滴定,半分钟后,红色不褪去,读数.(4)重复上述操作三次,然后取平均值.数据如下表2.
表2
滴定序号
NaOH溶液的浓度/mol.l-1HAc溶液的用量/mlNaOH溶液的用量/ml
Ⅰ0.20212521.11
Ⅱ0.20212521.090.17020.1701
Ⅲ0.20212521.010.1698
实验步骤(三):配制不同浓度的HAc溶液与PH值的测定:
)用移液管、吸量管分别吸取25.00ml、(1
5.00ml,2.50ml标准浓度的HAc于三个50ML的容量瓶.
(2)用蒸馏水衡释至记得度线、摇匀、计算出三个容量瓶中HAc溶液的浓度.
(3)把以上不同浓度的HAc溶液于4个干净干燥的50ML小烧杯中.
(4)由稀到浓的次序用PH计测定它们的PH值.
(5)填入数据表,见表3.
实验结果K=1.94×10-5符合K值范围。
表3
HAc液的浓度mol.l-1的测定值0.1703平均值
溶液编号
1234
c/mol.l-10.0085050.017010.085050.1701
PH3.343.312.912.72
[H+]/mol.l-14.57×10-44.89×10-41.238×10-31.905×10-3
α5.37%2.88%1.46%1.10%
电离平衡常数测定值
2.41×10-51.41×10-5
电离平衡常数平均值
1.94×10-5
1.80×10-52.10×10-5
(25℃的文献值为1.76×10-5)
实验讨论:
(1)做好本实验的关键是正确规范使用移液管、吸量管及PH计量取吸读数时接读准、量准、看准.
(2)滴定过程要稳要慢,接近化学计量点时应半滴地滴.
(3)测定PH值时,溶液顺序应由稀到浓.———————————————————
参考文献:
〔1〕北师范大学无机化学教研室等.无机化学实验(第三版).
〔2〕李桂馨.分析化学(第三版).
-
-
无机化学实验六 醋酸电离度和电离常数的测定1
实验六醋酸电离度和电离常数的测定pH法一实验目的1测定醋酸的电离度和电离常数2学习pH计的使用教学重点醋酸的电离度电离常数的测定教…
-
醋酸电离常数和电离度的测定
实验三醋酸电离常数和电离度的测定一实验目的1测定醋酸的电离常数加深对电离度的理解2学习正确使用pH计二实验原理醋酸CH3COOH或…
-
实验十五 醋酸电离度和电离常数的测定
实验十五醋酸电离度和电离常数的测定一教学要求1学习测定醋酸离解度和离解常数的基本原理和方法2学会酸度计的使用方法3巩固溶液的配制及…
-
醋酸电离度和电离常数的测定
实验题目醋酸电离度和电离常数的测定教材p5759一实验目的1测定醋酸的电离度和电离常数2掌握滴定原理滴定操作及正确判断滴定终点3练…
-
醋酸电离度和电离常数的测定—pH计的使用
醋酸电离度和电离常数的测定pH计的使用实验目的测定醋酸的电离度和电离常数进一步掌握滴定原理滴定操作及正确判断滴定终点学习使用pH计…
-
第四版无机化学实验报告实验十三:醋酸解离度和解离常数的测定——pH计的使用
实验名称醋酸解离和解离常数的测定pH计的使用实验日期温度气压一实验目的1测定醋酸的解离度和解离常数2掌握滴定原理滴定操作及正确判断…
-
采用分光光度法测定弱电解质的电离常数实验报告
采用分光光度法测定弱电解质的电离常数实验报告一实验目的1了解一种测定弱电解质电离常数的方法2掌握分光光度计的测试原理和使用方法3进…
-
四川理工实验报告电导法测定乙酸电离平衡常数 (2)
实验六电导法测定乙酸电离平衡常数报告人曾辉实验时间20xx年03月07日一实验目的1掌握电导电导率摩尔电导率的概念以及它们之间的相…
-
实验3 食用白醋的总酸度、电离度和电离常数的测定
实验3食用白醋的总酸度电离度和电离常数的测定教学目的与要求1学习食用白醋的总酸度电离度和电离常数的的原理和方法2学习酸度计的原理和…
-
报告示例:实验三__醋酸解离度和解离常数的测定
山东轻工业学院实验报告成绩课程名称基础化学实验1指导教师周磊实验日期院系专业班级实验地点实验楼A座412学生姓名学号同组人实验项目…
-
实验四 醋酸解离常数的测定
实验四醋酸解离常数的测定一pH法一实验目的1学习溶液的配制方法及有关仪器的使用2学习醋酸解离常数的测定方法3学习酸度计的使用方法二…