篇一 :大学物理化学必考公式总结
物理化学期末
重点复习资料
热力学第一定律
功:δW=δWe+δWf
(1)膨胀功 δWe=p外dV 膨胀功为正,压缩功为负。
(2)非膨胀功δWf=xdy
非膨胀功为广义力乘以广义位移。如δW(机械功)=fdL,δW(电功)=EdQ,δW(表面功)=rdA。
热 Q:体系吸热为正,放热为负。
热力学第一定律: △U=Q—W 焓 H=U+pV
理想气体的内能和焓只是温度的单值函数。
热容 C=δQ/dT
(1)等压热容:Cp=δQp/dT= (∂H/∂T)p
(2)等容热容:Cv=δQv/dT= (∂U/∂T)v
常温下单原子分子:Cv,m=Cv,mt=3R/2
…… …… 余下全文
篇二 :大学物理化学公式大全
热力学第一定律
功:δW=δWe+δWf
(1)膨胀功 δWe=p外dV 膨胀功为正,压缩功为负。
(2)非膨胀功δWf=xdy
非膨胀功为广义力乘以广义位移。如δW(机械功)=fdL,δW(电功)=EdQ,δW(表面功)=rdA。
热 Q:体系吸热为正,放热为负。
热力学第一定律: △U=Q—W 焓 H=U+pV
理想气体的内能和焓只是温度的单值函数。
热容 C=δQ/dT
(1)等压热容:Cp=δQp/dT= (∂H/∂T)p
(2)等容热容:Cv=δQv/dT= (∂U/∂T)v
常温下单原子分子:Cv,m=Cv,mt=3R/2
常温下双原子分子:Cv,m=Cv,mt+Cv,mr=5R/2
…… …… 余下全文
篇三 :大学物理化学公式集
大学物理化学公式集
热力学第一定律
功:δW=δWe+δWf
(1)膨胀功 δWe=p外dV 膨胀功为正,压缩功为负。
(2)非膨胀功δWf=xdy
非膨胀功为广义力乘以广义位移。如δW(机械功)=fdL,δW(电功)=EdQ,δW(表面功)=rdA。
热 Q:体系吸热为正,放热为负。
热力学第一定律: △U=Q—W 焓 H=U+pV
理想气体的内能和焓只是温度的单值函数。
热容 C=δQ/dT
(1)等压热容:Cp=δQp/dT= (∂H/∂T)p
(2)等容热容:Cv=δQv/dT= (∂U/∂T)v
常温下单原子分子:Cv,m=Cv,mt=3R/2
…… …… 余下全文
篇五 :大学物理化学下册公式
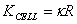 ,
,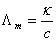 ,
,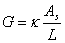 ,k=G
,k=G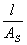 =
=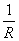
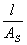
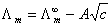 ,
, 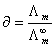 ,
,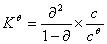
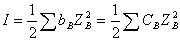

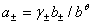 ,
,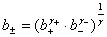 ,
, 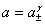 ,Q=
,Q=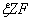
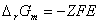 ,
, 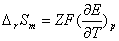 ,
,
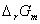 +
+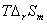
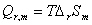 ,
, 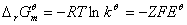
E=E
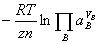 ,平衡时
,平衡时 =
=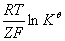
平动: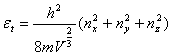 转动:
转动:
振动: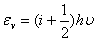
微态数:定域: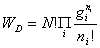 离域:
离域:
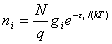 ,
, 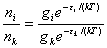
配分函数:平动: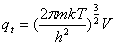 ,
,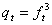
转动: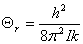 ,
, ,
,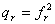
振动: ,
,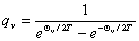 ,
,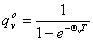
C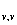 =R(
=R(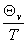 )
)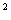
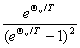 ,
,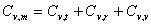
A=V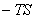 ,V=NKT
,V=NKT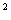
 ,S=NKln
,S=NKln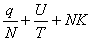
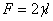


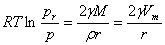
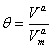

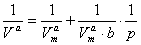
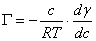 ,W
,W =
= ,
,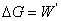 ,
,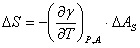
Q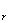 =T
=T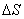 ,
,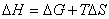 ,ln
,ln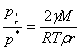
反应速率系数 k=Ae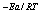 ,K=
,K=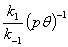 ,求活化能ln
,求活化能ln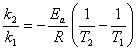
半衰期:零级 t =C
=C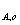
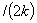 ;一级 t
;一级 t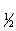 =
=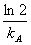 ;二级t
;二级t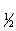 =
=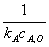
n级t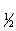 =
=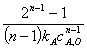
沾湿: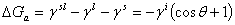
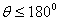
浸湿: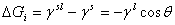


铺展: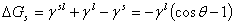
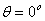 或不存在
或不存在
S=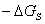 展铺的必要条件S
展铺的必要条件S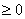
…… …… 余下全文
篇六 :大学物理化学公式集(傅献彩_南京大学第五版)
热力学第一定律
功:δW=δWe+δWf
(1)膨胀功 δWe=p外dV 膨胀功为正,压缩功为负。
(2)非膨胀功δWf=xdy
非膨胀功为广义力乘以广义位移。如δW(机械功)=fdL,δW(电功)=EdQ,δW(表面功)=rdA。
热 Q:体系吸热为正,放热为负。
热力学第一定律: △U=Q—W 焓 H=U+pV
理想气体的内能和焓只是温度的单值函数。
热容 C=δQ/dT
(1)等压热容:Cp=δQp/dT= (∂H/∂T)p
(2)等容热容:Cv=δQv/dT= (∂U/∂T)v
常温下单原子分子:Cv,m=Cv,mt=3R/2
常温下双原子分子:Cv,m=Cv,mt+Cv,mr=5R/2
…… …… 余下全文
篇七 :华东理工大学物理化学填空题总结

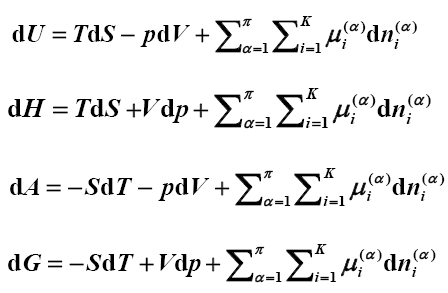
物理化学考研复习资料二(填空题总结)
一:系统处于热力学平衡状态的条件
1. 热平衡条件: T(1)=T(2)=...=T(∏) =T
2. 力平衡条件: P(1)=P(2)=...=P(∏) =P
3. 相平衡条件: μi(1)=μi(2)=...=μi(∏) =μi
4. 化学平衡条件: ΣⅴBμB=0
二:存在弯曲界面时的力平衡条件
P(α)=P(β)+ ζ*dAs /dV(α)
三:对于组成恒定的均相封闭系统,公式dHm=Cp,mdT 的适用条件是 :衡压。
四:阿累尼乌斯方程 适用范围:基元反应或有明确级数且K随温度升高
增大的非基元反应。
阿累尼乌斯活化能定义:Ea=RTdln{k}/dT
甲乙两个不同的化学反应,其活化能之间的关系是Ea(甲)大于Ea(乙)。若将二者的温度都
从T1升至T2,则甲反应的反应速率增加得快。因为Ea越大,温度影响越显著,升高
温度能更显著地加快反应速率。
五:dS≥0作为平衡判据,适用于 绝热或孤立系统。
附: T环dS -δQ≥0 封闭系统,只做体积功;任意过程。
dSU,V,W’=0 ≥0 封闭系统,只做体积功,孤立系统或绝热过程
…… …… 余下全文
篇八 :河北科技大学物理化学考试题总结8
1.
2. 1 mol理想气体经节流膨胀压力自p1降低到p2,此过程的△A 0,△U 0 。(填>,=或<);
3. 系统经可逆循环后,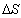 0,经不可逆循环后
0,经不可逆循环后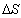 。(填>,=,<)。
。(填>,=,<)。
4. 热力学关系式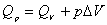 适用于 系统,其中
适用于 系统,其中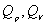 是等压和等容热效应。
是等压和等容热效应。
…… …… 余下全文


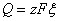 法拉第定律 电导率 摩尔电导率与浓度的关系
法拉第定律 电导率 摩尔电导率与浓度的关系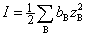
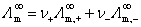 离子独立运动定律 离子强度
离子独立运动定律 离子强度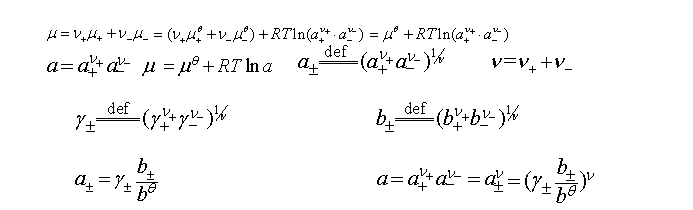
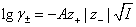 德拜-休克尔极限定律
德拜-休克尔极限定律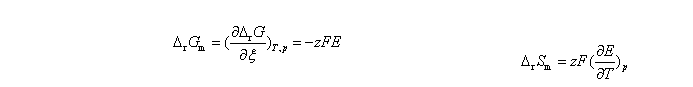
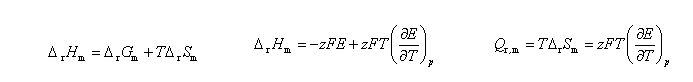
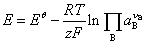
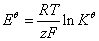 能斯特方程
能斯特方程
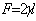 表面张力 表面吉布斯函数
表面张力 表面吉布斯函数