大学物理化学下册公式
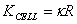 ,
,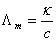 ,
,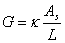 ,k=G
,k=G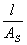 =
=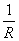
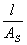
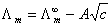 ,
, 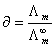 ,
,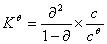
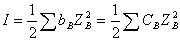

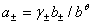 ,
,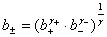 ,
, 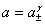 ,Q=
,Q=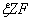
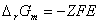 ,
, 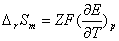 ,
,
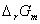 +
+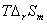
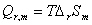 ,
, 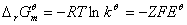
E=E
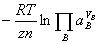 ,平衡时
,平衡时 =
=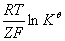
平动: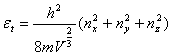 转动:
转动:
振动: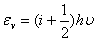
微态数:定域: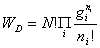 离域:
离域:
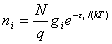 ,
, 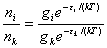
配分函数:平动: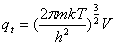 ,
,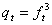
转动: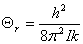 ,
, ,
,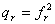
振动: ,
,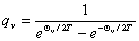 ,
,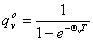
C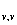 =R(
=R(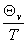 )
)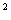
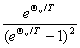 ,
,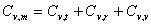
A=V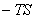 ,V=NKT
,V=NKT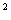
 ,S=NKln
,S=NKln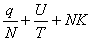
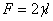


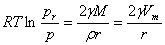
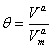

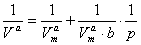
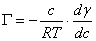 ,W
,W =
= ,
,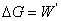 ,
,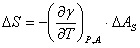
Q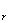 =T
=T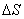 ,
,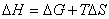 ,ln
,ln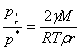
反应速率系数 k=Ae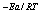 ,K=
,K=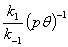 ,求活化能ln
,求活化能ln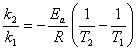
半衰期:零级 t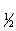 =C
=C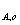
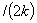 ;一级 t
;一级 t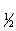 =
=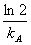 ;二级t
;二级t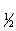 =
=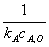
n级t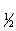 =
=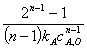
沾湿: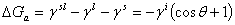
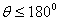
浸湿: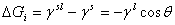


铺展: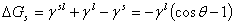
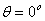 或不存在
或不存在
S=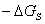 展铺的必要条件S
展铺的必要条件S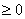
第二篇:大学物理化学必考公式总结
物理化学期末
重点复习资料
热力学第一定律
功:δW=δWe+δWf
(1)膨胀功 δWe=p外dV 膨胀功为正,压缩功为负。
(2)非膨胀功δWf=xdy
非膨胀功为广义力乘以广义位移。如δW(机械功)=fdL,δW(电功)=EdQ,δW(表面功)=rdA。
热 Q:体系吸热为正,放热为负。
热力学第一定律: △U=Q—W 焓 H=U+pV
理想气体的内能和焓只是温度的单值函数。
热容 C=δQ/dT
(1)等压热容:Cp=δQp/dT= (∂H/∂T)p
(2)等容热容:Cv=δQv/dT= (∂U/∂T)v
常温下单原子分子:Cv,m=Cv,mt=3R/2
常温下双原子分子:Cv,m=Cv,mt+Cv,mr=5R/2
等压热容与等容热容之差:
(1)任意体系 Cp —Cv=[p+(∂U/∂V)T](∂V/∂T)p
(2)理想气体 Cp —Cv=nR
理想气体绝热可逆过程方程:
pVγ=常数 TVγ-1=常数 p1-γTγ=常数 γ=Cp/ Cv
理想气体绝热功:W=Cv(T1—T2)=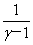 (p1V1—p2V2)
(p1V1—p2V2)
理想气体多方可逆过程:W= (T1—T2)
(T1—T2)
热机效率:η= 冷冻系数:β=-Q1/W
冷冻系数:β=-Q1/W
可逆制冷机冷冻系数:β=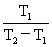
焦汤系数: μJ-T=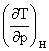 =-
=-
实际气体的ΔH和ΔU:
ΔU= +
+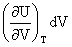 ΔH=
ΔH=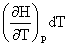 +
+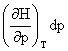
化学反应的等压热效应与等容热效应的关系:Qp=QV+ΔnRT
当反应进度 ξ=1mol时, ΔrHm=ΔrUm+ RT
RT
化学反应热效应与温度的关系: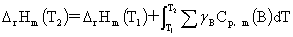
热力学第二定律
Clausius不等式: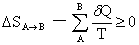
熵函数的定义:dS=δQR/T Boltzman熵定理:S=klnΩ
Helmbolz自由能定义:F=U—TS Gibbs自由能定义:G=H-TS
热力学基本公式:
(1)组成恒定、不作非膨胀功的封闭体系的热力学基本方程:
dU=TdS-pdV dH=TdS+Vdp
dF=-SdT-pdV dG=-SdT+Vdp
(2)Maxwell关系:
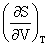 =
=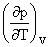
 =-
=-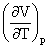
(3)热容与T、S、p、V的关系:
CV=T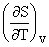 Cp=T
Cp=T
Gibbs自由能与温度的关系:Gibbs-Helmholtz公式 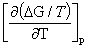 =-
=-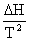
单组分体系的两相平衡:
(1)Clapeyron方程式: =
=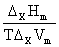 式中x代表vap,fus,sub。
式中x代表vap,fus,sub。
(2)Clausius-Clapeyron方程式(两相平衡中一相为气相):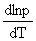 =
=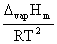
(3)外压对蒸汽压的影响: pg是在惰性气体存在总压为pe时的饱和蒸汽压。
pg是在惰性气体存在总压为pe时的饱和蒸汽压。
吉不斯-杜亥姆公式:SdT-Vdp+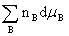 =0
=0
dU=TdS-pdV+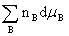 dH=TdS+Vdp+
dH=TdS+Vdp+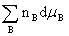
dF=-SdT-pdV+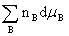 dG=-SdT+Vdp+
dG=-SdT+Vdp+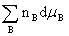
在等温过程中,一个封闭体系所能做的最大功等于其Helmbolz自由能的减少。等温等压下,一个封闭体系所能做的最大非膨胀功等于其Gibbs自由能的减少。
统计热力学
波兹曼公式:S=klnΩ
一种分布的微观状态数:定位体系:ti=N!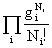 非定位体系:ti=
非定位体系:ti=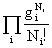 波兹曼分布:
波兹曼分布: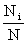 =
=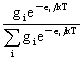
在A、B两个能级上粒子数之比: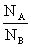 =
=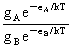
波色-爱因斯坦统计:Ni= 费米-狄拉克统计:Ni=
费米-狄拉克统计:Ni=
分子配分函数定义:q=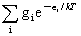 -
-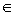 i为能级能量
i为能级能量
q=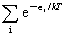 -
-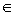 i为量子态能量
i为量子态能量
分子配分函数的分离:q=qnqeqtqrqv
能级能量公式:平动:εt=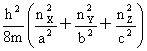
转动:εr=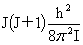 振动:εv=
振动:εv=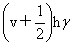
一些基本过程的ΔS、ΔG、ΔF的运算公式(Wf=0)
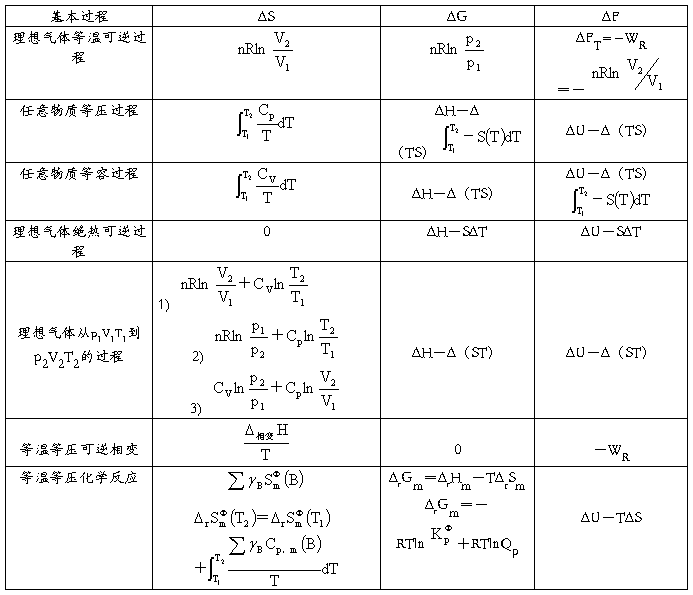
一些基本过程的W、Q、ΔU、ΔH的运算公式(Wf=0)
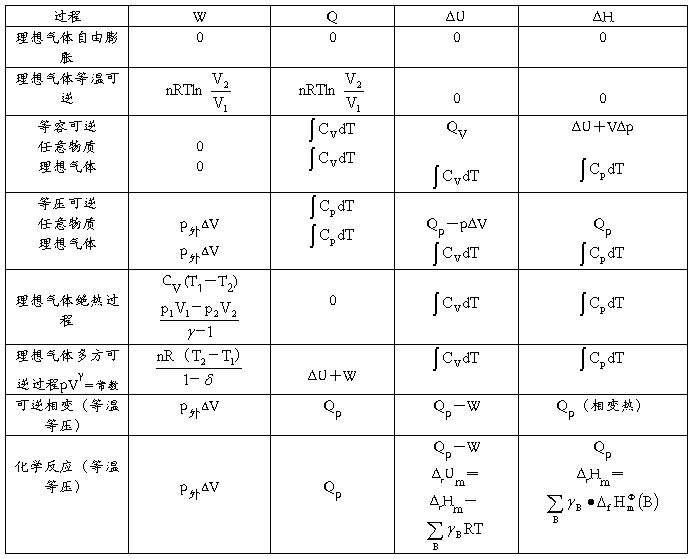
溶液-多组分体系体系热力学在溶液中的应用
溶液组成的表示法:(1)物质的量分数: (2)质量摩尔浓度:
(2)质量摩尔浓度: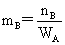 (3)物质的量浓度:
(3)物质的量浓度: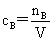 (4)质量浓度
(4)质量浓度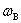
拉乌尔定律  亨利定律:
亨利定律:
化学势的各种表示式和某些符号的物理意义:
气体:
(1)纯理想气体的化学势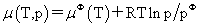 标准态:任意温度,p=pφ=101325Pa。μφ(T)为标准态时的化学势
标准态:任意温度,p=pφ=101325Pa。μφ(T)为标准态时的化学势
(2)纯实际气体的化学势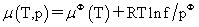 标准态:任意温度,f=pφ且复合理想气体行为的假想态(即p=pφ,γ=1),μφ(T)为标准态时的化学势。
标准态:任意温度,f=pφ且复合理想气体行为的假想态(即p=pφ,γ=1),μφ(T)为标准态时的化学势。
(3)混合理想气体中组分B的化学势 因为
因为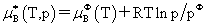 所以
所以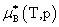 不是标准态时的化学势,是纯B气体在指定T、p时的化学势。
不是标准态时的化学势,是纯B气体在指定T、p时的化学势。
溶液:
(1) 理想溶液组分的化学势

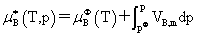
所以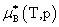 不是标准态时的化学势而是温度为T、溶液上方总压为p时,纯液体B的化学势。
不是标准态时的化学势而是温度为T、溶液上方总压为p时,纯液体B的化学势。
(2) 稀溶液中各组分的化学势
溶剂: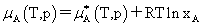
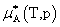 不是标准态时的化学势而是温度为T、溶液上方总压为p时,纯溶剂A的化学势。
不是标准态时的化学势而是温度为T、溶液上方总压为p时,纯溶剂A的化学势。
溶质:
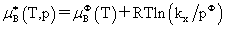
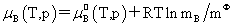
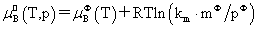
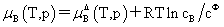
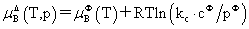
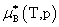 ,
,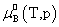 ,
,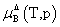 均不是标准态时的化学势,均是T,p的函数,它们分别为:当xB=1,mB=1molkg-1,cB=1moldm-3时且服从亨利定律的那个假想态的化学势。
均不是标准态时的化学势,均是T,p的函数,它们分别为:当xB=1,mB=1molkg-1,cB=1moldm-3时且服从亨利定律的那个假想态的化学势。
(4)非理想溶液中各组分的化学势
溶剂: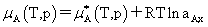
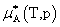 不是标准态的化学势,而是aA,x=1即xA=1,γA=1的纯组分A的化学势。
不是标准态的化学势,而是aA,x=1即xA=1,γA=1的纯组分A的化学势。
溶质:

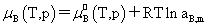
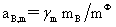
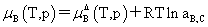

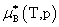 ,
,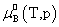 ,
,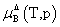 均不是标准态时的化学势,均是T,p的函数,它们分别为:当aB,x=1,aB,m=1,aB,c=1时且服从亨利定律的那个假想态的化学势。
均不是标准态时的化学势,均是T,p的函数,它们分别为:当aB,x=1,aB,m=1,aB,c=1时且服从亨利定律的那个假想态的化学势。
(4)活度a的求算公式:
ü 蒸汽压法:溶剂aA=γAxA=pA /pA * 溶质:aB=γBxB=pA /kc
ü 凝固点下降法:溶剂
ü Gibbs-Duhem公式从溶质(剂)的活度求溶剂(质)的活度。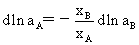
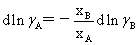
(5)理想溶液与非理想溶液性质:
理想溶液: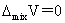

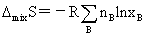

非理想溶液: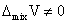

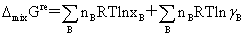
超额函数: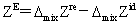
溶液热力学中的重要公式:
(1) Gibbs-Duhem公式
(2) Duhem-Margule公式: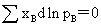 对二组分体系:
对二组分体系:
稀溶液依数性:
(1)凝固点降低:
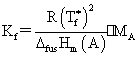
(2)沸点升高: 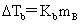
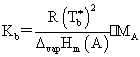
(3)渗透压: 
化平衡学
化学反应亲和势:A=-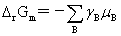
化学反应等温式: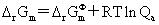
平衡常数的表达式:
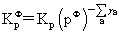
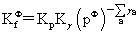


温度,压力及惰性气体对化学平衡的影响:
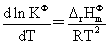
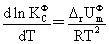
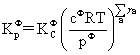
电解质溶液
法拉第定律:Q=nzF m=
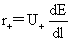
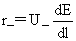
t+= =
=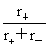 =
=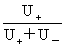 =
=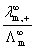 =
=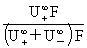
r+为离子移动速率,U+( U-)为正(负)离子的电迁移率(亦称淌度)。
近似: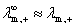
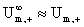
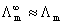 (浓度不太大的强电解质溶液)
(浓度不太大的强电解质溶液)
离子迁移数:tB=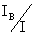 =
=
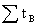 =
=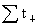 +
+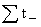 =1
=1
电导:G=1/R=I/U=kA/l
电导率:k=1/ρ 单位:S·m-1 莫尔电导率:Λm=kVm=k/c 单位S·m2·mol-1
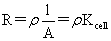

科尔劳乌施经验式:Λm=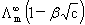
离子独立移动定律: =
=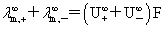
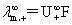
奥斯特瓦儿德稀释定律: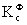 =
=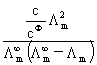
平均质量摩尔浓度: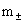 =
=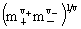
平均活度系数: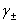 =
= 平均活度:
平均活度: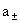 =
=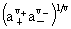 =
=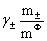
电解质B的活度:aB=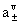 =
=
 m+=v+mB m-=v-mB
m+=v+mB m-=v-mB 
离子强度:I=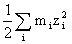
德拜-休克尔公式:lg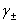 =-A|z+z--|
=-A|z+z--|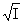
可逆电池的电动势及其应用
(ΔrG)T,p=-Wf,max (ΔrGm)T,p=zEF
Nernst Equation:若电池反应为 cC+dD=gG+hH
E=Eφ-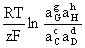
标准电动势Eφ与平衡常数Kφ的关系:Eφ=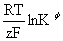
还原电极电势的计算公式: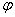 =
=
计算电池反应的有关热力学函数变化值: =
=
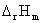 =-zEF+
=-zEF+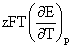 QR=T
QR=T =
=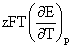
zF zF
zF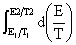 =
=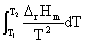
电极书面表示所采用的规则:负极写在左方,进行氧化反应(是阳极),正极写在右方,进行还原反应(是阴极)
电动势测定的应用:
(1)求热力学函数变量ΔrGm、ΔrGmΦ、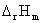 、
、 及电池的可逆热效应QR等。
及电池的可逆热效应QR等。
(2)求氧化还原反应的热力学平衡常数KΦ值:KΦ=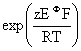 EΦ=
EΦ=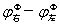 E=
E=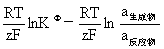
(3)求难溶盐的溶度积Ksp、水的离子积Kw及弱酸弱碱的电离常数等。
(4)求电解质溶液的平均活度系数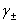 和电极的
和电极的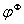 值。
值。
(5)从液接电势求离子的迁移数。Pt,H2(p)|HCl(m)|HCl(m’)| H2(p),Pt
1-1价型:Ej=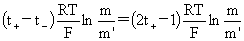 E=Ec+Ej=
E=Ec+Ej=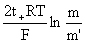
高价型:Mz+Az-(m1)|Mz+Az-(m2) Ej=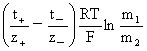
(6)利用醌氢醌电极或玻璃电极测定溶液的pH
电解与极化作用
E分解=E可逆+ΔE不可逆+IR
ΔE不可逆=η阴+η阳
η阴=(φ可逆-φ不可逆)阴 η阳=(φ不可逆-φ可逆)阳
φ阳,析出=φ阳,可逆+η阳 φ阴,析出=φ阴,可逆-η阴
η=a+blnj
E(实际分解)=E(理论分解)+η(阴)+η(阳)+IR
对电解池,由于超电势的存在,总是使外加电压增加而多消耗电能;对原电池,由于超电势的存在,使电池电动势变小而降低了对外作功的能力。
在阴极上,(还原)电势愈正者,其氧化态愈先还原而析出;同理,在阳机上,则(还原)电势愈负者其还原态愈先氧化而析出。(需外加电压小)
化学反应动力学
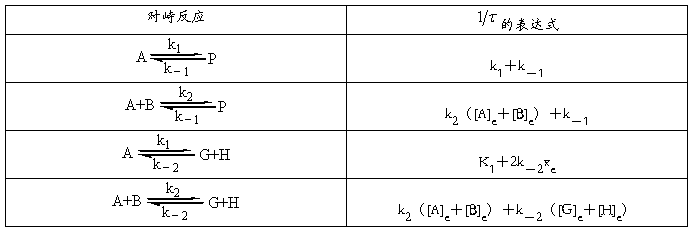
半衰期法计算反应级数:
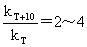

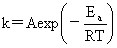

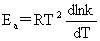
 kp=kc(RT)1-n Ea-Ea’=Q
kp=kc(RT)1-n Ea-Ea’=Q
化学反应动力学基础二:
ZAB=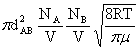 =
=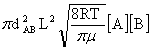 μ=
μ=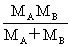
若体系只有一种分子:
ZAA=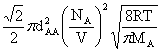 =
=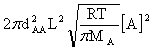
碰撞参数:b=dABsinθ
碰撞截面: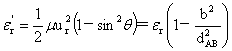
反应截面: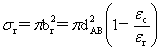
kSCT(T)=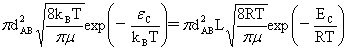
kSCT(T)=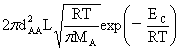
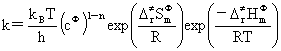 =
=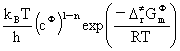
几个能量之间的关系:Ea=Ec+RT/2=E0+mRT=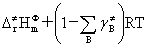
式中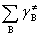 是反应物形成活化络合物时气态物质的代数和,对凝聚相反应,
是反应物形成活化络合物时气态物质的代数和,对凝聚相反应,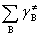 =0。对气相反应也可表示为:Ea=
=0。对气相反应也可表示为:Ea=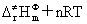 (式中n为气相反应的系数之和)
(式中n为气相反应的系数之和)
原盐效应: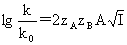
弛豫法:36.79%
界面现象
 与T的关系:
与T的关系: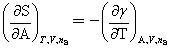
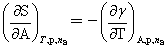
两边均乘以T,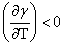 ,即
,即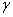 的值将随温度升高而下降,所以若以绝热方式扩大表面积,体系的温度必将下降。
的值将随温度升高而下降,所以若以绝热方式扩大表面积,体系的温度必将下降。
杨-拉普拉斯公式:ps
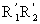 为曲率半径,若为球面
为曲率半径,若为球面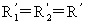
ps=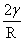 ,平面
,平面 ps
ps 。液滴愈小,所受附加压力愈大;液滴呈凹形,R‘为负值,ps为负值,即凹形面下液体所受压力比平面下要小。
。液滴愈小,所受附加压力愈大;液滴呈凹形,R‘为负值,ps为负值,即凹形面下液体所受压力比平面下要小。
毛细管:ps=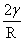 =Δρgh Δρgh=
=Δρgh Δρgh=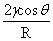 (R为毛细管半径)
(R为毛细管半径)
开尔文公式:p0和p分别为平面与小液滴时所受的压力
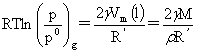
对于液滴(凸面R‘>0),半径愈小,蒸汽压愈大。
对于蒸汽泡(凹面R‘<0),半径愈小,蒸汽压愈小。
两个不同液滴的蒸汽压: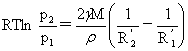
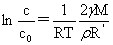 溶液越稀,颗粒越大。
溶液越稀,颗粒越大。
液体的铺展: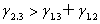
非表面活性物质使表面张力升高,表面活性物质使表面张力降低。
吉不斯吸附公式: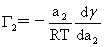
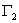 为表面超额
为表面超额
若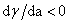 ,
,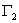 >0,正吸附;
>0,正吸附; ,
,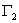 <0,负吸附。
<0,负吸附。
表面活性物质的横截面积:Am=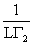
粘附功: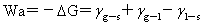 Wa值愈大,液体愈容易润湿固体,液固界面愈牢。
Wa值愈大,液体愈容易润湿固体,液固界面愈牢。
内聚功: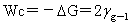 浸湿功:
浸湿功: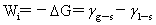
铺展系数: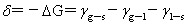
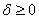 ,液体可在固体表面自动铺展。
,液体可在固体表面自动铺展。
接触角: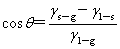
Langmuir等温式: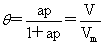 θ:表面被覆盖的百分数。
θ:表面被覆盖的百分数。
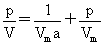 离解为两个分子:
离解为两个分子: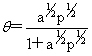
混合吸附: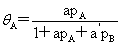
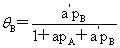 即:
即: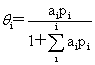
BET公式: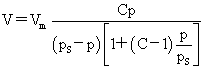
弗伦德利希等温式: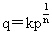 乔姆金吸附等温式:
乔姆金吸附等温式: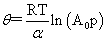
吸附剂的总表面积:S=AmLn n=Vm/22400cm3mol-1
气固相表面催化反应速率:单分子反应: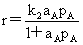 (产物吸附很弱)
(产物吸附很弱)
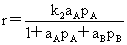 (产物也能吸附)
(产物也能吸附)
双分子反应: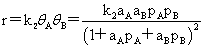 (AB都吸附)
(AB都吸附)
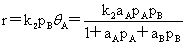 (AB均吸附,但吸附的B不与吸附的A反应)
(AB均吸附,但吸附的B不与吸附的A反应)
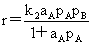 (B不吸附)
(B不吸附)
胶体分散体系和大分子溶液
布朗运动公式: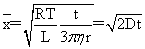 (D为扩散系数)
(D为扩散系数)
球形粒子的扩散系数: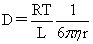
渗透压: 渗透力:F=
渗透力:F=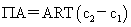 扩散力=-F
扩散力=-F
沉降平衡时粒子随高度分布公式: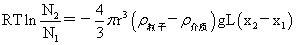
瑞利公式: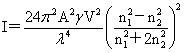
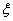 电势 表面电势
电势 表面电势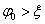 Stern电势
Stern电势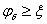 电解质浓度增加
电解质浓度增加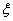 电势减小。
电势减小。
电泳速度: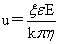 k=6时为电泳,k=4时为电渗。
k=6时为电泳,k=4时为电渗。
大分子稀溶液渗透压公式: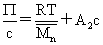
-
大学物理化学公式大全
1热力学第一定律功WWeWf1膨胀功Wep外dV膨胀功为正压缩功为负2非膨胀功Wfxdy非膨胀功为广义力乘以广义位移如W机械功fd…
-
大学物理化学公式集
1大学物理化学公式集热力学第一定律功WWeWf1膨胀功Wep外dV膨胀功为正压缩功为负2非膨胀功Wfxdy非膨胀功为广义力乘以广义…
-
大学物理化学下册复习公式
物理化学公式QzFKcellRx法拉第定律电导率摩尔电导率与浓度的关系离子独立运动定律离子强度电解质溶液的活度德拜休克尔极限定律原…
-
大学物理化学下册公式
,,,k=G=,,,,,Q=,,+,E=E,平衡时=平动:转动:振动:微态数:定域:离域:,配分函数:平动:,转动:,,振动:,,…
-
大学物理化学公式集(傅献彩_南京大学第五版)
1热力学第一定律功WWeWf1膨胀功Wep外dV膨胀功为正压缩功为负2非膨胀功Wfxdy非膨胀功为广义力乘以广义位移如W机械功fd…
-
河北科技大学物理化学考试题总结8
1.2.1mol理想气体经节流膨胀压力自p1降低到p2,此过程的△A0,△U0。(填,=或);3.系统经可逆循环后,?S0,经不可…
-
大学物理化学实验思考题答案总结
液体饱和蒸气压的测定1.测定液测量体饱和蒸气压的方法有哪些?我院物理化学实验室采用的是什么方法?答:(1)静态法:在某一温度下直接…
-
20xx兰州大学物理化学考研专业课复习方法总结.doc
20xx兰州大学物理化学考研专业课复习方法总结物理化学作为一门物理与化学的交叉学科,其内容涉及物理、化学知识及两者知识的综合应用,…
-
华东理工大学物理化学填空题总结
物理化学考研复习资料二填空题总结一系统处于热力学平衡状态的条件1热平衡条件T1T2TT2力平衡条件123相平衡条件124化学平衡条…
-
华东理工大学物理化学填空题总结
一系统处于热力学平衡状态的条件热平衡条件T1T2TT力平衡条件12相平衡条件12化学平衡条件BB二存在弯曲界面时的力平衡条件dV三…