篇一 :手持技术测定补钙剂中钙的含量实验报告


《化学实验教学研究》实验报告
实验设计项目 手持技术测定补钙剂中钙的含量 实验时间 星期 二 上午 下午 晚上

姓 名 方胜敏 学号 222009316011185 同组人 李媛(142) 指导老师:_______________
…… …… 余下全文
篇三 :钙制剂中钙含量的测定
钙制剂中钙含量的测定
——EDTA法和KMnO4的比较
一、实验原理
钙制剂中主要成份为碳酸钙、淀粉等,用(I+I)HCl将其溶解即可。而含钙乳钦料、奶粉等 样品处理则需用马福炉高温灼烧后.再用(1+1)HCl溶解.
本实验中EDTA滴定法测定钙含量时.在pH=lO条件下,以铬蓝黑R为指示剂,并加入少 量三乙酵胺来掩蔽样品中的Fe3+等干扰离子,用EDTA标准溶液来滴定Ca2+.
KMnO4滴定法:先向待测的含Ca2+酸性试液中加入过量的(NH4)2C2O4,再用稀氨水中和至试液 的pH为4-5,放置陈化,将Ca2+以CaC2O4.形成沉淀.将沉淀用酸溶解后,用KMn04标准溶液与C2O42- 发生下列氧化还原反应:
2MnO42-+5C2O42-+16H+=2Mn2++10CO2+8H2O
…… …… 余下全文
篇四 :补钙剂中钙含量的测定 - 高锰酸钾间接滴定法
高锰酸钾间接滴定法
测补钙制剂中钙含量
一、实验目的
1.了解沉淀分离的基本要求及操作。
2.掌握氧化还原法间接测定钙含量的原理及方法。
二、实验原理
利用某些金属离了(如碱土金属、Pb2+、Cd2+等)与草酸根能形成难溶的草酸盐沉淀的反应,可以用高锰酸钾法间接测定它们的含量。反应如下: Ca2++C2O42-=CaC2O4↓ CaC2O4+H2SO4 =CaSO4+H2C2O4
5H2C2O4+2MnO42- +6H+= 2Mn2++10CO2↑ +8H2O
用该法可测定某些补钙制剂(如葡萄糖酸钙、钙立得、盖天力等)中的钙含量,分析结果与标示量吻合。
三、试剂仪器
试剂:KMnO4溶液 0.02 mol·L;草酸胺(NH4C2O4)5 g·L;氨水 10%;HCl (1+1),浓H2SO4 1 mol·L-1;甲基橙 2 g·L-1;硝酸银 0.1 mol·L-1。 仪器:分析天平、干燥器、称量瓶、烧杯、水浴锅、漏斗、量杯、酸式滴定管、洗瓶。
-1-1
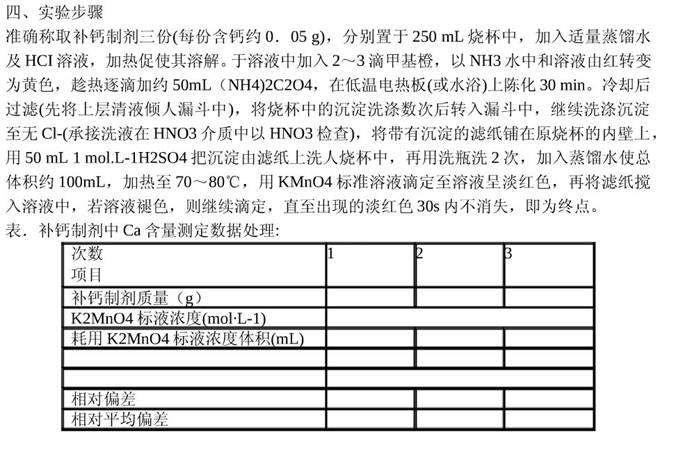
四、实验步骤
准确称取补钙制剂三份(每份含钙约0.05 g),分别置于250 mL烧杯中,加入适量蒸馏水及HCl溶液,加热促使其溶解。于溶液中加入2~3滴甲基橙,以NH3水中和溶液由红转变为黄色,趁热逐滴加约50 mL (NH4)2C2O4,在低温电热板(或水浴)上陈化30 min。
…… …… 余下全文
篇五 :补钙剂中钙含量的测定123
补钙制剂中钙含量的测定
(高锰酸钾间接滴定法)
一、实验目的
1.了解沉淀分离的基本要求及操作。
2.掌握氧化还原法间接测定钙含量的基本原理及方法。
二、实验原理
利用某些金属离子(如碱土金属、Pb2+、Cd2+等)与C2O42-能形成难溶的草酸盐沉淀的反应,可以用高锰酸钾法间接测定它们的含量。即先将Ca2+全部沉淀为CaC2O4,沉淀经过滤洗涤后溶于稀H2SO4中。
反应方程式:
Ca2++C2O42-=CaC2O4↓
CaC2O4+H2SO4 =CaSO4+H2C2O4
5H2C2O4+2MnO42- +6H+= 2Mn2++10CO2↑ +8H2O
在酸性条件下,用Na2C2O4作基准物质标定KMnO4溶液的反应为:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2+8H2O
滴定时利用MnO4-本身的紫红色指示终点。
计算公式:
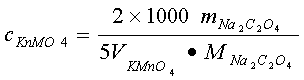
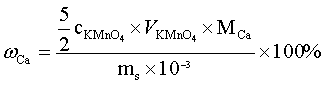
三、试剂仪器
试剂:KMnO4(s)分析纯;Na2C2O4(s)分析纯;H2SO4溶液1 mol·L-1,3 mol·L-1、草酸胺(NH4C2O4)5 g·L-1、氨水 10%、HCl (1:1)、甲基橙 2 g·L-1、硝酸2 mol·L-1、硝酸银 0.1 mol·L-1。
…… …… 余下全文
篇六 :钙制剂中钙含量的测定
可溶性氯化物中氯含量的测定 (佛尔哈德Volhard返滴定法)
一、 实验目的
1. 学习NH4SCN标准溶液的配制和标定。
2. 掌握用佛尔哈德返滴定法测定可溶性氯化物中氯含量的原理和方法。
二、 实验原理
在含Cl-的酸性试液中,加入一定量过量的Ag+标准溶液,定量生成AgCl沉淀后,过量Ag+以铁铵矾作指示剂,用NH4SCN标准溶液回滴,由Fe(SCN)2+络离子的红色来指示滴定终点。主要包括下列沉淀反应和络合反应:
Ag++Cl-= AgCl↓(白色) Ksp= 1.8×10-10
Ag++SCN-= AgSCN↓(白色) Ksp= 1.0×10-12
Fe3++SCN-= Fe(SCN)2+(白色) K1= 138
指示剂用量大小对滴定有影响,一般控制Fe3+浓度为0.015mol·L-1为宜。
滴定时,控制氢离子浓度为0.1~1mol·L-1,剧烈摇动溶液,并加入硝基苯(有毒)或石油醚保护AgCl沉淀,使其与溶液隔开,防止AgCl沉淀与SCN-发生交换反应而消耗滴定剂。
测定时,能与SCN-生成沉淀或生成络合物,或能氧化SCN-的物质均有干扰。PO43-,AsO3-4,CrO42-等离子,由于酸效应的作用而不影响测定。
…… …… 余下全文
篇七 :钙制剂中钙含量的测定——EDTA法
钙制剂中钙含量的测定
——EDTA法
一、实验原理
钙制剂中主要成份为碳酸钙、淀粉等,用(I+I)HCl将其溶解即可。而含钙乳钦料、奶粉等 样品处理则需用马福炉高温灼烧后.再用(1+1)HCl溶解.
本实验中EDTA滴定法测定钙含量时.在pH=lO条件下,以铬蓝黑R为指示剂,并加入少 量三乙醇胺来掩蔽样品中的Fe3+等干扰离子,用EDTA标准溶液来滴定Ca2+.
二、试剂仪器
仪器:滴定管,2.OmL移液管, 25mL锥形瓶,漏斗, 电炉,电子天平
试剂 :
l EDTA滴定法
NaOH,20%三乙醇胺,20%NaOH.钙指示剂,0.002mol/L EDTA,蒸馏水
三. 实验步骤
1.样品处理
钙制剂处理方法:准确称取1克左右钙制剂,加蒸馏水定容至100mL容量瓶中,摇匀。
2.EDTA滴定法操作步骤
常量法:准确移取上述试液5.OOmL,加入20%三乙醇胺5mL,蒸馏水30mL,20%NaOH 5ml,适量的钙指示剂,用EDTA标准溶液滴至溶液由粉红色变为蓝色即为终点。
…… …… 余下全文
篇八 :高锰酸钾滴定法测定补钙制品中的钙含量.doc
目前, 我国居民摄入钙量严重不足, 尤其是儿童青少年
和老年人缺钙比例很高[1]。为了补充钙, 补钙类保健食品及 补钙制品在国内外发展很快。因此, 钙是保健食品、钙剂制 品及乳品中常规营养分析必须检测的质量指标, 而准确提 供钙制品中钙的含量, 也是衡量钙制品质量的主要依据。 食品中钙含量的测定通常采用火焰原子吸收光谱法或
EDTA 滴定法测定[2- 4]。火焰原子吸收光谱法适宜测定钙含 量较低( 以mg/kg 计) 的含钙食品。该法虽干扰小, 速度快, 效果好, 但因仪器昂贵、操作技术难掌握, 普通实验室难以 普及应用。对于含量较高的( 以g/100 g 计) 食品, 国家标准 方法为EDTA 容量滴定法, 该法虽操作简单, 但存在着干扰 现象严重、终点变化不明显、指示剂水溶液不稳定( 固体指 示剂用量不易掌握) 且易封闭等问题, 使得测定结果的准确 度不高[5]; 并且, 使用剧毒的KCN 易导致环境污染。关于应 用草酸盐沉淀分离、高锰酸钾滴定法测定钙剂制品中的钙 含量的研究未见有相关报道。为此, 笔者进行了高锰酸钾容 量滴定法测定补钙制品中钙含量的方法的研究。
1 材料与方法
…… …… 余下全文