钙制剂中钙含量的测定
钙制剂中钙含量的测定
——EDTA法和KMnO4的比较
一、实验原理
钙制剂中主要成份为碳酸钙、淀粉等,用(I+I)HCl将其溶解即可。而含钙乳钦料、奶粉等 样品处理则需用马福炉高温灼烧后.再用(1+1)HCl溶解.
本实验中EDTA滴定法测定钙含量时.在pH=lO条件下,以铬蓝黑R为指示剂,并加入少 量三乙酵胺来掩蔽样品中的Fe3+等干扰离子,用EDTA标准溶液来滴定Ca2+.
KMnO4滴定法:先向待测的含Ca2+酸性试液中加入过量的(NH4)2C2O4,再用稀氨水中和至试液 的pH为4-5,放置陈化,将Ca2+以CaC2O4.形成沉淀.将沉淀用酸溶解后,用KMn04标准溶液与C2O42- 发生下列氧化还原反应:
2MnO42-+5C2O42-+16H+=2Mn2++10CO2+8H2O
由此,可间接测定钙含量。
二、试剂仪器
仪器:3.OOOmLWD—COII微型滴定管(专利号:00230756.1),2.OmL移液管, 25mL锥形瓶,漏斗, 电炉,电子天平
试剂 :
l EDTA滴定法
NaOH,20%三乙醇胺,20%NaOH.钙指示剂,0.002mol/L EDTA,蒸馏水
2 KMnO4滴定法
0.02mol/LKMnO4., 5%(NH4)2C2O4, (1+1)氨水,浓HCl,(1+1)HCl,1mol/LH2SO3, 0.2%百里酚蓝,0.1mol/L硝酸银浓液
三. 实验步骤
1.样品处理
钙制剂处理方法:准确称取1克左右钙制剂,加蒸馏水定容至100mL容量瓶中,摇匀。
2.EDTA滴定法操作步骤
常量法:准确移取上述试液5.OOmL,加入20%三乙醇胺5mL,蒸馏水30mL,20%NaOH 5ml,适量的钙指示剂,用EDTA标准溶液滴至溶液由粉红色变为蓝色即为终点。
微量法:用移液管准确移取上述试液2.OmL,加入lmL 20%三乙醇胺,5mL 蒸馏水,1ml 20%NaOH溶液,5滴0.5%铬蓝黑R,用0.01mol/L EDTA标准溶液滴至溶液粉红变为蓝色即为终点(3.000mL微型滴定管及2.00mL移液管等仪器均己校正)。
计算钙含量:

3.高锰酸钾滴定法
准确称取钙制剂1克左右两份,分别置于250mL干燥烧杯中,加入适量蒸馏水及(1+1)HCl加热使之完全溶解(奶粉或含钙饮品则分取上述处理的试液25.OOmL两份,置于250mL烧杯中),加入百里酚蓝指示剂3-4滴。
用(1+1)氨水调至溶液由红色变为黄色,边搅拌边慢慢加入5%(NH4)2C2O4溶液50mL,在低温电热板(或水浴上)加热陈化30分钟,冷却后用中速定性滤纸过滤(注意应将上层清液先过滤),用蒸馏水洗涤沉淀至无C1-(用硝酸将滤液酸化后以AgNO3来检查) 后,将带有沉淀的滤纸铺在原烧杯的内壁上,用50mL 1mol/L H2SO4把沉淀由滤纸上溶入烧杯中,再用洗瓶吹洗滤纸2次,并加入蒸馏水使总体积约为lOOmL,于电热板上加热至70-80°C,加MnSO4 3~4滴,用KMnO4标准溶液滴至溶液呈浅红色,再将滤纸捣碎搅入溶液中,若溶液褪色,则继续滴定,直至出现浅红色,30秒内不消失,即为终点,记下消耗KMnO4溶液体积。
计算钙含量:

四、实验结果与教据处理
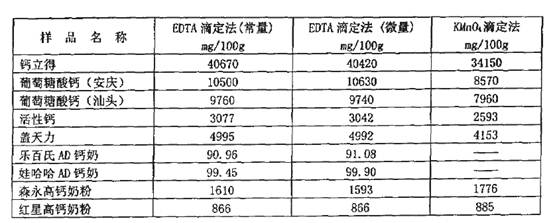
1.三种滴定法潮定的结果对照
用叭滴定法(包括常量法和微量法)及高锰酸钾滴定法测定了一批钙制剂及加钙钦品中的钙含量,三种方法的所得结果见表1.
表EDTA滴定法(常量法和微量法)和KMnO4滴定法测定钙含量的结果
2.三种滴定法的回收率
选取了葡萄糖酸钙(安庆)和红星高钙奶粉测定了三种滴定法的回收率,EDTA法(常量)的回收率为98.4%-99%,EDTA滴定法(微量)的回收率为95.9%-98.7%.KMnO4法的回收率为99%-100.5%,符台分析方法的要求。(表2)
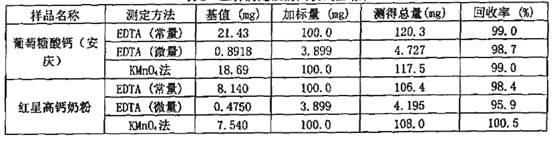 表2 三种滴定法的回收试验结果
表2 三种滴定法的回收试验结果
五、结果与讨论
由三种测定钙含量的方法实验结果表明:
(1)我们实验室自行研制的WD-COIII微型滴定管(专利号:002307561)操作方便,结构简单,滴定误差在允许范围内,可读数精度高,可读至0.001mL.
(2)在EDTA法中采用了三乙醇胺掩蔽样品中的Fe2+等离子,避免使用剧毒的KCN,减少了环境污染,便于学生实验.选用铬蓝墨R为指示剂终点颜色变化明显,易于观察.
(3)在KMnO4滴定法中采用间接滴定法.其中涉及多种操作(如沉淀、陈化、过滤等).使学生的操作技能得到了全面的训练。
第二篇:钙制剂中钙含量的测定——EDTA法
钙制剂中钙含量的测定
——EDTA法
一、实验原理
钙制剂中主要成份为碳酸钙、淀粉等,用(I+I)HCl将其溶解即可。而含钙乳钦料、奶粉等 样品处理则需用马福炉高温灼烧后.再用(1+1)HCl溶解.
本实验中EDTA滴定法测定钙含量时.在pH=lO条件下,以铬蓝黑R为指示剂,并加入少 量三乙醇胺来掩蔽样品中的Fe3+等干扰离子,用EDTA标准溶液来滴定Ca2+.
二、试剂仪器
仪器:滴定管,2.OmL移液管, 25mL锥形瓶,漏斗, 电炉,电子天平
试剂 :
l EDTA滴定法
NaOH,20%三乙醇胺,20%NaOH.钙指示剂,0.002mol/L EDTA,蒸馏水
三. 实验步骤
1.样品处理
钙制剂处理方法:准确称取1克左右钙制剂,加蒸馏水定容至100mL容量瓶中,摇匀。
2.EDTA滴定法操作步骤
常量法:准确移取上述试液5.OOmL,加入20%三乙醇胺5mL,蒸馏水30mL,20%NaOH 5ml,适量的钙指示剂,用EDTA标准溶液滴至溶液由粉红色变为蓝色即为终点。
微量法:用移液管准确移取上述试液2.OmL,加入lmL 20%三乙醇胺,5mL 蒸馏水,1ml 20%NaOH溶液,5滴0.5%铬蓝黑R,用0.01mol/L EDTA标准溶液滴至溶液粉红变为蓝色即为终点(3.000mL微型滴定管及2.00mL移液管等仪器均己校正)。
计算钙含量:
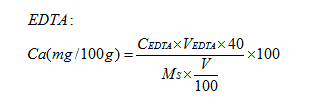
四、实验结果与教据处理
1.二种滴定法潮定的结果对照
用叭滴定法(包括常量法和微量法)测定了一批钙制剂及加钙钦品中的钙含量,二种方法的所得结果见表1.
表EDTA滴定法(常量法和微量法)测定钙含量的结果
2.二种滴定法的回收率
选取了CAO和CACO3测定了二种滴定法的回收率,EDTA法(常量)的回收率为98.4%-99%,EDTA滴定法(微量)的回收率为95.9%-98.7%.符台分析方法的要求。(表2)
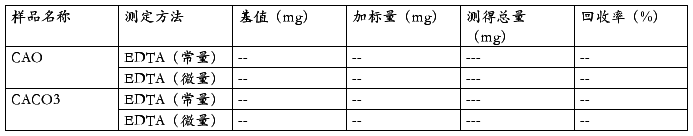
表2 二种滴定法的回收试验结果
五、结果与讨论
由二种测定钙含量的方法实验结果表明:
(1)此法操作方便,结构简单,滴定误差在允许范围内,可读数精度高,可读至0.001mL.
(2)在EDTA法中采用了三乙醇胺掩蔽样品中的Fe2+等离子,避免使用剧毒的KCN,减少了环境污染,便于学生实验.选用铬蓝墨R为指示剂终点颜色变化明显,易于观察.
-
手持技术测定补钙剂中钙的含量实验报告
化学实验教学研究实验报告实验设计项目手持技术测定补钙剂中钙的含量实验时间星期二上午下午晚上姓名方胜敏学号2220xx3160111…
- 补钙制剂中钙含量的测定
-
钙制剂中钙含量的测定
钙制剂中钙含量的测定EDTA法和KMnO4的比较一实验原理钙制剂中主要成份为碳酸钙淀粉等用IIHCl将其溶解即可而含钙乳钦料奶粉等…
-
补钙剂中钙含量的测定 - 高锰酸钾间接滴定法
高锰酸钾间接滴定法测补钙制剂中钙含量一实验目的1了解沉淀分离的基本要求及操作2掌握氧化还原法间接测定钙含量的原理及方法二实验原理利…
-
补钙剂中钙含量的测定123
补钙制剂中钙含量的测定高锰酸钾间接滴定法一实验目的1了解沉淀分离的基本要求及操作2掌握氧化还原法间接测定钙含量的基本原理及方法二实…
-
手持技术测定补钙剂中钙的含量实验报告
化学实验教学研究实验报告实验设计项目手持技术测定补钙剂中钙的含量实验时间星期二上午下午晚上姓名方胜敏学号2220xx3160111…
- 补钙制剂中钙含量的测定
-
补钙剂中钙含量的测定 - 高锰酸钾间接滴定法
高锰酸钾间接滴定法测补钙制剂中钙含量一实验目的1了解沉淀分离的基本要求及操作2掌握氧化还原法间接测定钙含量的原理及方法二实验原理利…
-
补钙剂中钙含量的测定123
补钙制剂中钙含量的测定高锰酸钾间接滴定法一实验目的1了解沉淀分离的基本要求及操作2掌握氧化还原法间接测定钙含量的基本原理及方法二实…
-
钙制剂中钙含量的测定
可溶性氯化物中氯含量的测定佛尔哈德Volhard返滴定法一实验目的1学习NH4SCN标准溶液的配制和标定2掌握用佛尔哈德返滴定法测…