篇一 :金属及其化合物总结知识点
第三章金属及其化合物
一、金属的物理通性:常温下,金属一般为银白色晶体(汞常温下为液体),具有良好的导电性、导热性、延展性。
二、金属的化学性质:
多数金属的化学性质比较活泼,具有较强的还原性,在自然界多数以化合态形式存在。

三、金属化合物的性质:
1、氧化物

2、氢氧化物

3、盐
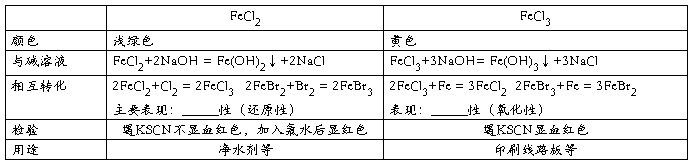
四、金属及其化合物之间的相互转化
1、铝及其重要化合物之间的转化关系,写出相应的化学反应方程式。⑩NaAlO2+HCl+H2O=Al(OH)3↓+NaCl
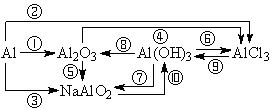
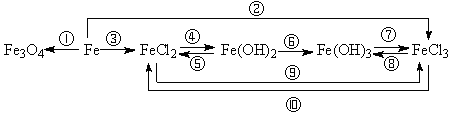
2、铁及其重要化合物之间的转化关系,写出相应的化学反应方程式。
附:1、焰色反应:用于在火焰上呈现特殊颜色的金属或它们的化合物的检验。

注:观察钾焰色反应时,应透过蓝色钴玻璃,以便滤去杂质钠的黄光。
3、氧化铝、氢氧化铝
(1)Al2O3俗名矾土,是一种难熔又不溶于水的白色粉末。它的熔点、沸点都高于2000度。(2)氢氧化铝是典型的两性氢氧化物,它既能溶于强酸生成铝盐溶液,又能溶于强碱生成偏铝酸盐溶液。氢氧化铝可用来制备铝盐,作吸附剂等的原料。氢氧化铝凝胶有中和胃酸和保护溃疡面的作用,可用于治疗胃和十二指肠溃疡、胃酸过多等。
…… …… 余下全文
篇三 :金属及其化合物知识点总结
金属单质及其化合物
考点聚焦
1.《考试大纲》中对金属元素及化合物这块内容可分成二部分来理解。第一部分是钠、镁等典型的金属元素的化合物;第二部分是其他金属(如铁和铝)元素的化合物。每年的化学高考试题中往往都要考查到典型金属。
2.《考试大纲》中有多条类似于“以××为例,了解(或理解、掌握)××××”的内容叙述,如:以过氧化钠为例,了解过氧化物的性质;以Fe(Ⅱ)、Fe(Ⅲ)的相互转化为例,了解变价金属元素的氧化还原性。对这些内容的要注意理解实质,达到“举一反三”的要求。在这些内容往往是高考命题的重点。
3.金属元素及其化合物跟化学实验的综合。近几年的实验试题中比较多地出现了以金属元素及其化合物为落点的实验试题和元素推断题,请大家加以重视。
4. 常见金属元素(如Na、Al、Fe、Cu等)
⑴了解常见金属的活动顺序。
⑵了解常见金属及其重要化合物的主要性质及其应用。
⑶了解合金的概念及其重要应用。
知识梳理
1、钠及其化合物
2、镁及其化合物
3、铝及其化合物
4、铁、铜及其化合物
一、钠及其化合物
1、钠
(1)钠的物理性质:钠是银白色金属,密度小(0.97g/cm3),熔点低(97℃),硬度小,质软,可用刀切割。钠通常保存在煤油中。是电和热的良导体。
…… …… 余下全文
篇四 :金属及其化合物总结
普通高中课程标准实验教科书-[人教版]
第三章 金属及其化合物
归纳与整理
(第一课时)
教学目的:
1、巩固常见金属钠及铝的单质、化合物性质。
2、培养归纳、概括、抽象思维能力,培养形成规律性认识的能力。
3、在发现总结规律的过程中启发学生分析、探究,激发学习兴趣。
重点、难点: 将具体物质的性质抽象、概括,形成知识网络。
教学过程:
[导课]请同学们回顾我们刚学过的金属及其化合物的主要内容:
[投影]第一节:金属化学性质: 一、金属与氧气反应(钠、镁、铝)二、金属与水反应(钠与水、铁与水)三、铝与氢氧化钠反应;
第二节:几种重要的金属化合物:一、氧化物(MgO、CuO、Fe2O3、Al2O3)二、氢氧化物(Fe(OH)3、Fe(OH)2、Al(OH)3、)三、盐(NaCO3与NaHCO3、Fe3+的氧化性)四、焰色反应
第三节:用途广泛的金属材料 :一、常见合金的重要应用(铜合金、钢)二、正确选用金属材料。
[讲述]我们采用Na、Al、Fe为主线纵向对金属性质进行归纳。
[板书] 第三章 金属及其化合物
归纳与整理
[填写下表
…… …… 余下全文
篇五 :金属及其化合物重要知识点总结
祝你学习愉快
金属及其化合物重要知识点总结
一、钠、镁及其化合物
1、金属钠的性质与应用
(1)物理性质:
(2)化学性质
① 与H2O反应:
现象:
② 与非金属反应(O2): 、
③ 与非氧化性(H+)反应:
④ 与盐溶液反应(如FeCl3溶液):
⑤ 钠置于空气中的变化:
(3)钠在自然界里的存在和主要用途
①制钠的化合物(如NaOH) ②强还原剂 ③钠关灯(黄光) ④钠和钾的合金(钾的质量分数为50%~80%),在室温下呈液态,是原子反应堆的导热剂 ⑤在自然界中以化合态存在。
(4)钠的制取:
2、钠的化合物
过氧化钠:
碳酸钠:
碳酸氢钠:
Na2O2与H2O反应(标出电子转移):Na2O2与CO2反应:
Na2CO3与HCl(少量)反应:
Na2CO3与HCl(过量)反应:
NaHCO3受热分解:
向Na2CO3中通入过量的CO2:
离子方程式:
足量NaOH与CO2反应:
离子方程式:
NaOH与过量CO2反应:
4、焰色反应(物理变化):
5、镁的提取及应用
①步骤与反应原理:
…… …… 余下全文
篇六 :高一化学金属及其化合物知识点总结
高一化学金属及其化合物知识点总结
1.元素的存在形式有两种:游离态和化合态。
(1)钠镁铝只以化合态形式存在:钠元素的主要存在形式是氯化钠,镁元素的存在形式有菱镁矿,铝元素的存在形式有铝土矿。
(2)铁元素有两种存在形式:游离态的陨铁和化合态的铁矿石。
2.金属单质的用途:
(1)利用钠元素的特征焰色(黄色)制高压钠灯,高压钠灯的透雾力强,可以做航标灯;利用钠单质的熔点低,钠钾合金常温下呈液态,做原子反应堆的导热剂;利用钠单质制备过氧化钠,利用钠单质还原熔融态的四氯化钛制备金属钛。
(2)镁条燃烧发出耀眼的白光,用来做照明弹。
(3)利用铝的良好导电性,做导线。利用铝块和铝粉的颜色都是银白色,铝粉制成银粉(白色涂料)。
3.金属化合物的用途:
(1)过氧化钠做漂白剂,过氧化钠做水下作业、坑道下作业的供氧剂;氯化钠、碳酸钠、碳酸氢钠做食品添加剂;氯化钠做为制备单质钠和氯气的原料,氯化钠做为制备氢氧化钠、氢气、氯气的原料。
(2)氧化镁的熔点高,做耐高温的材料:耐火管、耐火坩埚、耐高温的实验仪器。
(3)明矾做净水剂。
4.金属的分类:
(1)根据冶金工业标准分类:铁(铬、锰)为黑色金属,其余金属(钠镁铝等)为有色金属。
…… …… 余下全文
篇七 :金属及其化合物性质总结
金属及其化合物性质总结
问题举例:
① 金属都有光泽吗?铁块上的灰色是光泽吗?
答:金属都有光泽,铁块上的灰色是氧化膜
② 观察铁粉为什么看不见银白色光泽?
答:铁粉:尺寸小于1mm的铁的颗粒集合体,表面积小,形状复杂,会对光进行吸收或漫反射,导致有很少的光进入我们眼睛。任何固体颗粒直径小到一定量,颜色都是黑色的
③ 哪些金属在自然界中以游离态存在?实验室有单质金属钠,可以说钠在自然界以游离态存在吗?
答:极少数金属以单质(游离态)存在,如金、银、铂等。大多数以化合物形式存在。钠的化学性质活泼,极易与空气中的氧气发生化学反应。
实验室的钠都需要密封保存,同时不与水接触
④ 为什么有的金属只有一种化合价,而有的金属有多种化合价?
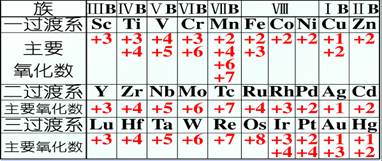
答:这与金属的价电子构型有关。在化学反应中,有的金属只能失去最外层电子,有的还能失去次外层和倒数第三层的部分电子。一般过渡金属会有多种价态。
⑤ 铁有银白色光泽,为什么铁又称为黑色金属?
答:它们或它们的合金的表面常有呈灰黑色的氧化物,所以称这类金属为黑色金属。通常情况下铁中含杂质碳等元素而呈黑色
…… …… 余下全文
篇八 :20xx高中化学基础知识总结金属及其化合物部分
20xx高中化学基础知识总结
《金属及其化合物部分》考点揭秘
钠及其化合物:
(一)、钠
1. Na与水反应的离子方程式:命题角度为是否违反电荷守恒定律。
2. Na的保存:放于煤油中而不能放于水中,也不能放于汽油中;实验完毕后,要放回原瓶,不要放到指定的容器内。
3. Na、K失火的处理:不能用水灭火,必须用干燥的沙土灭火。
4. Na、K的焰色反应:颜色分别黄色、紫色,易作为推断题的推破口。注意做钾的焰色反应实验时,要透过蓝色的钴玻璃,避免钠黄光的干扰。
5. Na与熔融氯化钾反应的原理:因钾的沸点比钠低,钾蒸气从体系中脱离出来,导致平衡能向正反应移动。(Na+KCl(熔融)=NaCl+K
(二)、氢氧化钠
1. 俗名:火碱、烧碱、苛性钠
2. 溶解时放热:涉及到实验室制取氨气时,将浓氨水滴加到氢氧化钠固体上,其反应原理为:一是NaOH溶解放出大量的热,促进了氨水的分解,二是提供的大量的OH-,使平衡朝着生成NH3的方向移动。与之相似的还有:将浓氨水或铵盐滴加到生石灰上。涉及到的方程式为NH4+OH+-
NH3·H2O
NH3↑+ H2O
3. 与CO2的反应:主要是离子方程式的书写(CO2少量和过量时,产物不同)
…… …… 余下全文