篇一 :高考化学方程式总结
高考常见化学方程式总结
非金属单质及其化合物
一、氯气及卤素的性质
1、F2、 Cl2的化学性质
F2 + H2 = 2HF (冷暗处 爆炸)
2F2 +2H2O=4HF+O2 (F2能置换O2 为较强的氧化剂)
(ClF+H2O==HF+HClO ClF属于类卤素,非氧化还原反应)
Cl2 + H2 2HCl (纯净H2在Cl2安静燃烧产物,遇空气形成酸雾,
混合点燃、加热、光照发生爆炸) 点燃 Cl2 + 2Na 2NaCl (白色的烟,溶于水为无色溶液) 点燃 3Cl2 + 2Fe
2FeCl3 (棕黄色的烟,溶于水呈黄色)
Cl2 + 2FeCl2 =2FeCl3 Cl2+2Fe2+===2Fe3++2Cl? 点燃 Cl2 + Cu
CuCl2 (棕黄色的烟,溶于水呈蓝绿色)
2Cl2+2NaBr=2NaCl+Br2 Cl2+2Br?=2Cl?+Br2
Cl2 +2NaI =2NaCl+I2 Cl2+2I?=2Cl?+I2
…… …… 余下全文
篇二 :高考化学方程式总结精编版
高考总复习之高中化学方程式总结
(有下划线的方程式在信息题中会出现,不用死记,理解即可)
氯气

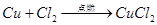
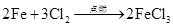

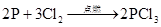
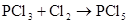
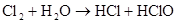

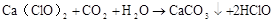
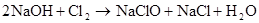
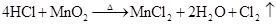 (制CI2)
(制CI2)
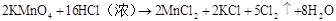

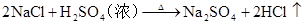
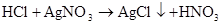
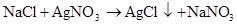

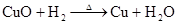
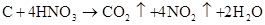
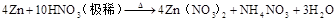

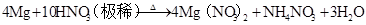
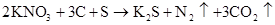
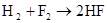
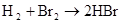
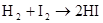
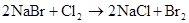
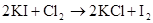
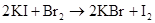
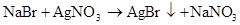
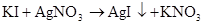

硫 硫酸
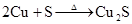
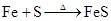

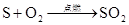
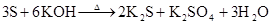
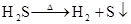
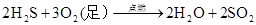



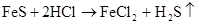 (制H2S)
(制H2S)
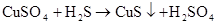
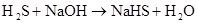
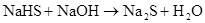
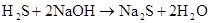 (前两个结合)
(前两个结合)
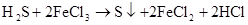
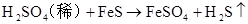 (制H2S)
(制H2S)

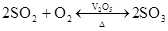
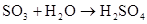
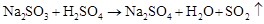 (制SO2)
(制SO2)
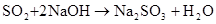
 (煤的脱硫)
(煤的脱硫)


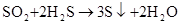

 (空气吹出法提溴)
(空气吹出法提溴)
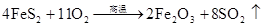
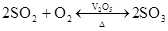
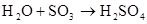 硫酸的工业制法(三步法)
硫酸的工业制法(三步法)
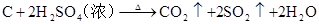
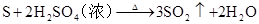

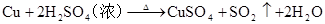
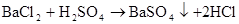
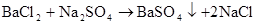
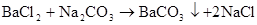

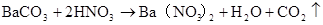
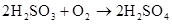

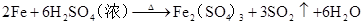
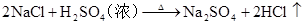
碱金属
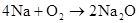
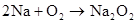

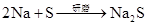
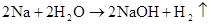
 (可分开写)
(可分开写)
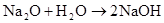
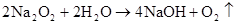
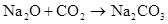
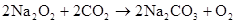

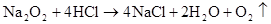

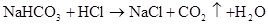

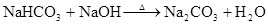

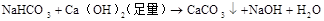
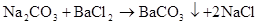

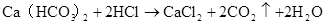
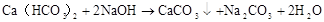

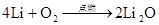
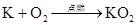
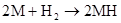 (M代表碱金属)
(M代表碱金属)
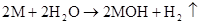
第六章 氮和磷
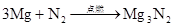
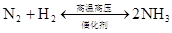
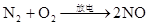
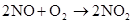
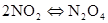 放热反应
放热反应

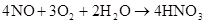
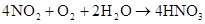

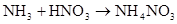
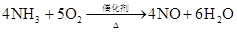
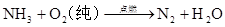
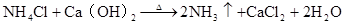
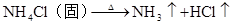

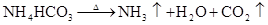

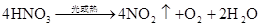


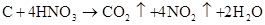
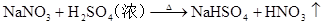
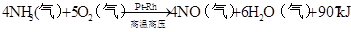
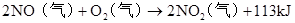
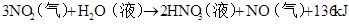
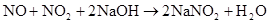
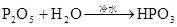
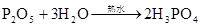
硅及其重要的化合物
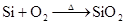
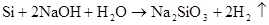
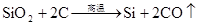
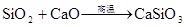
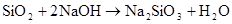
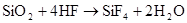 (HF酸腐蚀玻璃)
(HF酸腐蚀玻璃)
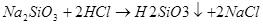

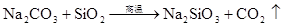
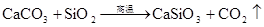
第二节 镁和铝的性质

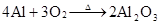

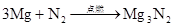
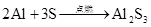
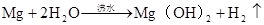
…… …… 余下全文
篇三 :高考化学方程式总结
高一至高三化学方程式总结
20xx-07-21 12:28
1.碳与氧气(不足)的反应2C+O2==== 2CO
碳与氧气(充足)的反应C+O2==== CO2
2.一氧化碳与氧气的反应2CO+O2==== 2CO2
3.二氧化碳与碳的反应CO2+C==== 2CO
4.碳酸氢钠与盐酸的反应NaHCO3+HCl==== NaCl+H2O+CO2↑
5.碳酸钠与盐酸的反应Na2CO3+ 2HCl==== 2NaCl+ H2O+ CO2↑
6.碳酸钙与盐酸的反应CaCO3+2HCl==== CaCl2+ H2O+ CO2↑
7.碳酸氢钠与氢氧化钠的反应NaHCO3+NaOH==== Na2CO3 +H2O
8.碳酸钠与氢氧化钙的反应Na2CO3+Ca(OH)2==== CaCO3↓+ 2NaOH
9.碳酸氢钠(少量)与氢氧化钙的反应NaHCO3+ Ca(OH)2==== CaCO3↓+NaOH+ H2O 碳酸氢钠(过量)与氢氧化钙的反应2NaHCO3+ Ca(OH)2====
CaCO3↓+Na2CO3+2H2O
10.碳酸氢钠加热的反应2NaHCO3==== Na2CO3+ H2O+CO2↑
…… …… 余下全文
篇四 :高中化学方程式总结_高考必备
氯元素
一:氯气的化学性质
1.氯气和金属单质反应(K、Ca、Na、Mg、
Al、Zn、Fe、Cu……)生成高价金属氯化物
 2Fe+3Cl2 2FeCl3
2Fe+3Cl2 2FeCl3
 Cu+Cl2 CuCl2
Cu+Cl2 CuCl2
 2Na+Cl2 2NaCl
2Na+Cl2 2NaCl
2.氯气与非金属单质反应
 H2+Cl2 2HCl
H2+Cl2 2HCl
3.氯气与水反应
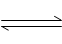 Cl2+H2O HCl+HClO
Cl2+H2O HCl+HClO
…… …… 余下全文
篇五 :高考重要化学方程式归纳总结
一、按要求书写化学方程式
1、铁/铜在氯气中燃烧(方程式及现象) 2Fe+3Cl Cu+Cl
3(产生棕黄色的烟,加水振荡,溶液呈黄色) 2(产生棕色的烟,加水振荡,溶液呈蓝绿色)
2、漂白粉在空气中变质 / 在工业上应用
Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO (在空气中变质) Ca(ClO)2+2HCl==CaCl2+2HClO (工业上应用) 3、实验室制氢氟酸 / 氢氟酸腐蚀玻璃
NaF+H2SO4==Na2SO4+2HF↑ (反应须在铅皿或塑料制品中进行) 4HF+SiO2==SiF4↑+2H2O 4、铜粉/铁粉与硫粉共热
Cu2S(黑色)(S的氧化性不强,只能将变价金属氧化成低价态
)
2Cu+S
Fe+SFeS(黑色)
5、将硫粉/碳粉/铜粉与浓硫酸/硝酸共热 S+2H2SO
4(浓 C+2H2SO
4(浓 Cu+2H2SO
4(浓 S+6HNO
3(浓3SO2↑+2H2O CO2↑+2SO2↑+2H2O CuSO4+SO2↑+2H2O H2SO4+6NO2↑+2H2O
C+4HNO
3(浓CO2↑+4NO2↑+2H2O Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O
…… …… 余下全文
篇六 :高考重要化学方程式归纳总结
高考重要化学方程式归纳总结(部分)
一、按要求书写化学方程式。
1.铁/铜在氯气中燃烧(方程式及现象)
2Fe+3Cl22FeCl3(产生棕黄色的烟,加水振荡,溶液呈黄色)
Cu+Cl2CuCl2(产生棕色的烟,加水振荡,溶液呈蓝绿色)
2. 漂白粉在空气中变质 / 在工业上应用
Ca(ClO)2+CO2+H2O==CaCO3↓+2HClO (在空气中变质)
Ca(ClO)2+2HCl==CaCl2+2HClO (工业上应用)
3.实验室制氢氟酸 / 氢氟酸腐蚀玻璃
NaF+H2SO4==Na2SO4+2HF↑ (反应须在铅皿或塑料制品中进行)
4HF+SiO2==SiF4↑+2H2O
4. 铜粉/铁粉与硫粉共热
2Cu+SCu2S(黑色)(S的氧化性不强,只能将变价金属氧化成低价态)
Fe+SFeS(黑色)
5.将硫粉/碳粉/铜粉与浓硫酸/硝酸共热
S+2H2SO4(浓)△3SO2↑+2H2O
C+2H2SO4(浓)△ CO2↑+2SO2↑+2H2O
Cu+2H2SO4(浓)△ CuSO4+SO2↑+2H2O
S+6HNO3(浓)△ H2SO4+6NO2↑+2H2O
…… …… 余下全文
篇七 :高一至高三化学方程式总结
高一至高三化学方程式总结
1.碳与氧气(不足)的反应2C+O2==== 2CO
碳与氧气(充足)的反应C+O2==== CO2
2.一氧化碳与氧气的反应2CO+O2==== 2CO2
3.二氧化碳与碳的反应CO2+C==== 2CO
4.碳酸氢钠与盐酸的反应NaHCO3+HCl==== NaCl+H2O+CO2↑
5.碳酸钠与盐酸的反应Na2CO3+ 2HCl==== 2NaCl+ H2O+ CO2↑
6.碳酸钙与盐酸的反应CaCO3+2HCl==== CaCl2+ H2O+ CO2↑
7.碳酸氢钠与氢氧化钠的反应NaHCO3+NaOH==== Na2CO3 +H2O
8.碳酸钠与氢氧化钙的反应Na2CO3+Ca(OH)2==== CaCO3↓+ 2NaOH
9.碳酸氢钠(少量)与氢氧化钙的反应NaHCO3+ Ca(OH)2==== CaCO3↓+NaOH+ H2O 碳酸氢钠(过量)与氢氧化钙的反应2NaHCO3+ Ca(OH)2==== CaCO3↓+Na2CO3+2H2O
10.碳酸氢钠加热的反应2NaHCO3==== Na2CO3+ H2O+CO2↑
11.碳酸氢钙加热的反应Ca(HCO3)2==== CaCO3↓+H2O+CO2↑
…… …… 余下全文
篇八 :高中化学方程式总结_邱威严
高中化学方程式总结
邱威严
注:由于反应条件不方便打出,因此在后面括号标出(未标表示没有条件)
第一部分 无机方程式
1、钠与空气常温下反应
4Na+O2==2Na2O
2、钠再空气中加热(过氧化钠为黄色固体)
2Na+O2==Na2O2(加热或点燃)
3、钠与水反应(现象浮、游、熔、响、红)
2Na+2H2O==2NaOH+H2↑
4、铁与水蒸气反应
3Fe+4H2O(g)==Fe3O4+4H2(加热)
5、铝与氢氧化钠溶液反应
2Al+2NaOH+2H2O==2NaAlO2+3H2↑
2Al+2OH-+2H2O==2AlO-+3H2↑
6、氧化钠与水反应
Na2O+H2O==2NaOH
…… …… 余下全文