篇一 :大学无机化学重要方程式总结

不含全部配位反应、鉴定反应、要从同类反应(未全包括)中找出规律
1.XeF6 + 3H2O == XeO3 + 6HF
2.NaBrO3 + XeF2 + H2O == NaBrO4 + 2HF + Xe
3.2F2 + 2H2O == 4HF + O2
4.2F2 + 2OH— (2%)== 2F— + OF2+ H2O
5. 2KHF2 电解 2KF + H2↑ + F2↑
6. 2NaCl + 2H2O 电解 2NaOH + H2↑(阴极区)+ Cl2↑
7. 2IO3― +5HSO3— == 5SO42— + I2 +3H+ + H2O
8. CaF2 + H2SO4 (浓) == CaSO4 + 2HF
9. NaCl + H2SO4 (浓) == NaHSO4 + HCl↑
10.Rb[ICl2] ==(加热) RbCl + ICl
11. 2HIO3 ==(加热) I2O5 + H2O↑
12. I2O5 + 5CO == I2 + 5CO2
…… …… 余下全文
篇二 :无机化学 知识点总结
第一章物质存在的状态………………………………………………………………2
一、气体... 2
二、液体... 3
①溶液与蒸汽压... 3
②溶液的沸点升高和凝固点的下降... 3
③渗透压... 4
④非电解质稀溶液的依数性... 4
三、胶体... 4
第二章 化学动力学初步……………………………………………………………5
…… …… 余下全文
篇三 :东华大学无机化学总结
第一章
1.理想气体状态方程应用范围:温度不太低,压力不太高的真实气体。
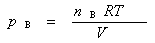 2.组分气体B在相同温度下占有与混合气体相同体积时所产生的压力,叫做组分气体B的分压。
2.组分气体B在相同温度下占有与混合气体相同体积时所产生的压力,叫做组分气体B的分压。
3.分压定律:混合气体的总压等于混合气体中各组分气体分压之和。
 第二章:
第二章:
1.体积功:
2.热力学第一定律:对体系加热,体系吸收热量Q,并对环境作功W,则体系内能变化:△U = Q + W = U2—U1
内能的变化只与体系的始态与终态有关,而与过程的具体途径无关。
 3.焓:
3.焓:
结论:恒压过程的反应热QP在数值上就等于体系的焓变△H也等于体系在恒压过程中内能的变化△U加上体系所作的膨胀功P△V。
并且:△H = △U + P△V = △U + △ngRT
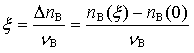 4.反应进度:
4.反应进度: 。分母为化学计量数。在左边取负数。
。分母为化学计量数。在左边取负数。
5.反应的标准摩尔焓变:在等温等压条件下,化学反应热效应Qp在数值上等于反应的标准摩尔焓变△rHmø,单位kj/mol标准摩尔生成焓:化学反应在标准状态下进行时的反应热
△fHmø
标准摩尔燃烧焓:在一定的温度和压力下,1mol物质完全燃烧生成指定产物时的反应热或焓变,就称为该物质的摩尔燃烧热或摩尔燃烧焓,单位kJ/mol 。△cHm
…… …… 余下全文
篇四 :大学无机化学重要方程式总结
不含全部配位反应、鉴定反应、要从同类反应(未全包括)中找出规律
1.XeF6 + 3H2O == XeO3 + 6HF
2.NaBrO3 + XeF2 + H2O == NaBrO4 + 2HF + Xe
3.2F2 + 2H2O == 4HF + O2
4.2F2 + 2OH—(2%)== 2F— + OF2+ H2O
5. 2KHF2 电解 2KF + H2↑ + F2↑
6. 2NaCl + 2H2O 电解 2NaOH + H2↑(阴极区)+ Cl2↑
7. 2IO3― +5HSO3— == 5SO42— + I2 +3H+ + H2O
8. CaF2 + H2SO4 (浓) == CaSO4 + 2HF
9. NaCl + H2SO4 (浓) == NaHSO4 + HCl↑
10.Rb[ICl2] ==(加热) RbCl + ICl
11. 2HIO3 ==(加热) I2O5 + H2O↑
12. I2O5 + 5CO == I2 + 5CO2
…… …… 余下全文
篇五 :北京理工大学524-无机化学考研心得
理硕教育—专注于北理考研
本资料由理硕教育整理,理硕教育是全国唯一专注于北理工考研辅导的学校,相对于其它机构理硕教育有得天独厚的优势。丰富的理工内部资料资源与人力资源确保每个学员都受益匪浅,确保理硕教育的学员初试通过率89%以上,复试通过率接近100%,理硕教育现开设初试专业课VIP一对一,假期集训营,复试VIP一对一辅导,满足学员不同的需求。因为专一所以专业,理硕教育助您圆北理之梦。详情请查阅理硕教育官网
无机化学学习心得
对于每一位立志考上北京理工大学的化学专业考生来说,无机化学还是比较简单的,和有机化学相比,那简直是太幸福了,可是呢,简单归简单,但是我们在学习的时候,总是希望有前辈们可以在前面指点迷津,少走一些弯路,这里,我就冒昧当一次前辈吧。
我想大家最关心的第一个问题就是时间问题,因为无机化学比较简单,所以你不需要复习的太早,一般暑假开始就可以,暑假之前,你可以把大部分的时间投入考研数学和英语,一旦你开始复习考研无机化学,那么每天3个小时左右的学习时间是必不可少的,且需要养成固定的生物钟,你可以根据自己的喜好,在每一天的一个固定时间段来重点学习无机化学,一旦好习惯养成,高分数也就是水到渠成的事情。还是重点把时间放在考试内容上面来吧。
…… …… 余下全文
篇六 :大学 无机化学 方程式 整理
大学 无机化学 方程式 整理
阅读人数:30人页数:28页最开始总是美好
第一章 氢及稀有气体 1.氢气的制备
实验室:Zn+2HCl=ZnCl2+H2↑
军事上:CaH2 +2H2O → Ca(OH)2 + 2H2↑ 2.稀有气体化合物
①第一个稀有气体化合物:Xe + PtF6 → Xe+* PtF6+ ?
(无色) (红色 ) (橙
黄色)
②氙的氟化物水解:
2XeF2+2H2O →2Xe↑+4HF+ O2↑
6XeF4 + 12H2O == 2XeO3 + 4Xe↑ +3O2↑ +24HF
XeF6+3H2O →XeO3+6HF
③氙的氟化物为强氧化剂: XeF2 + H2 ─→ Xe + 2HF
XeF2 + H2O2 ─→ Xe + 2HF + O2↑
第二章 碱金属与碱土金属元素
一、 碱金属与碱土金属(铍、镁除外)元素溶于液氨,生成溶剂合电子和阳离子成具有导电性的深蓝色溶液。 碱金属 M(S) + (x+y)NH3
e-(NH3)y
M+(NH3)x +
重磅推荐:百度阅读APP,免费看书神器!
1/28
碱土金属 M(S) + (x+2y)NH3
…… …… 余下全文
篇七 :大学无机化学
0无机化学期末试题(A)
专业 姓名 学号 成绩
一、 单项选择题(每小题2分,共20分)
1、重晶石的化学式是 ( )
A BaCO3 , B BaSO4 , C Na2SO4 , D Na2CO3
2、在B12的单元中有多少等边三角形的面。 ( )
A 12 , B 24 , C 20 , D 40
3、BCl3分子中,除了B-Clσ键外,还有大Л键是 ( )
A П44, B П36 , C П46 D П35
4、原子序数为40的元素的元素符号是 ( )
A Ti , B Zr , C Hf , D Nb
5、将过量的KCN加入CuSO4溶液中,其生成物是 ( )
…… …… 余下全文


