中考总结化学方程式
中考总结·化学方程式
沙林祥
一、中考透视
1. 规律总结
(1)化学方程式的意义(以 为例)
为例)
①宏观方面:表示硫和氧气在点燃条件下反应生成二氧化硫。
②微观方面:表示1个硫原子和1个氧分子反应生成1个二氧化硫分子。
③量变方面:表示32份质量的硫和32份质量的氧气完全反应生成64份质量的二氧化硫。
(2)化学方程式的书写
①书写原则
a. 必须以客观事实为依据。
b.要遵守质量守恒定律。
②书写步骤
a. 写:根据事实写出反应物(左边)和生成物(右边)的化学式,并在反应物和生成物之间画一条短线(或标出一个指向生成物的箭头)。
b. 配:配平化学方程式,并加以检查。
c. 注:注明化学反应发生的条件[点燃、加热(常用“△”表示)、催化剂等],标出生成物的状态[气体用“↑”表示,沉淀用“↓”表示,如果反应物中有气体(或沉淀),生成物中就不要标“↑”(或“↓”)],把短线改成等号。
(3)化学方程式的配平
这里介绍一种很通用的化学方程式的配平方法——设1法,其基本步骤是:(1)找出反应式两边组成较复杂(原子数目多)的化学式,设该化学式的化学计量数为1;(2)依次确定其他化学式的化学计量数(可以是分数),最后在反应式两边各乘以某数,使各化学计量数变为最简整数。
例如:
3Fe + 2H3PO4 = Fe3(PO4)2+3H2↑
第二步 第二步 第一步 第三步
2. 考点分析
正确书写化学方程式是中考的热点。围绕这一考点,命题的重点往往放在根据书写原则判断化学方程式的正误,尤其强调给定信息、按一定规律书写化学方程式,并运用化学方程式解释一些生产、生活中的实际现象。
二、中考精讲
例1(2005·南京)下面四位同学正在讨论某一个化学方程式表示的意义,他们所描述的化学方程式是( )
A. 
B. 
C. 
 D.
D. 
【解析】本题考查同学们对化学方程式表示的意义的理解,要求从宏观、微观和量变角度去理解化学方程式所表示的意义。观察图像可知,是化合反应,排除D项;各物质的分子个数比为2:1:2,排除A项;各物质的质量比为1:8:9,只能选C。
例2(2005·四川)我国每年都有大量的过期粮食——陈化粮,不能作为人畜的食用粮。人们常将陈化粮用来生产酒精。其过程为:
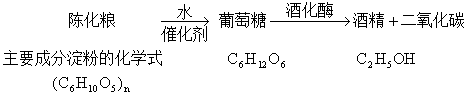
(1)写出陈化粮制酒精的化学方程式:___________________________;
(2)写出酒精燃烧的化学方程式:_______________________________;
(3)生产的酒精可以添加到汽油中得到乙醇汽油。使用乙醇汽油有很多优点。根据你的思考,请写出一条使用乙醇汽油的优点。
_______________________________________________________________________。
【解析】本题为信息给予题,考查同学们阅读信息和分析、解决问题的能力。解题的关键在于通过阅读分析信息,弄清反应物是什么?生成物是什么?反应需要什么条件?由题意知,陈化粮制酒精分为两步:第一步,反应物 和
和 在催化剂的作用下,生成
在催化剂的作用下,生成 ;第二步,反应物
;第二步,反应物 在酒化酶的作用下,生成了
在酒化酶的作用下,生成了 和
和 。确定了反应物、反应条件、生成物后,书写化学方程式就水到渠成了。
。确定了反应物、反应条件、生成物后,书写化学方程式就水到渠成了。
【答案】(1) ,
,

(2)
(3)污染小;成本低(其他答案合理均可)
三、中考链接
1. (2005·天津)下列化学方程式符合题意,且书写正确的是( )
A. Fe和稀盐酸反应:
B. 熟石灰和盐酸反应:
C. 洗去试管壁上附着的铜:
D. 通电分解水:
2. (2005·南京)单晶硅是制作电子集成电路的基础材料。工业上通过以下反应将自然界的二氧化硅( )转化为硅:
)转化为硅: 。下列分析正确的是( )
。下列分析正确的是( )
A. 二氧化硅发生了氧化反应
B. 碳发生了还原反应
C. 该反应属于复分解反应
D. 该反应属于置换反应
3. (2005·雅安)对知识的整理和归纳是学习化学的一种重要方法。现有三个化学反应如下:
① ②
②
③
(1)通过比较可以发现:它们有许多相似之处,其一是反应物中都有氧气;其二是_______________;其三是_______________;请你再写出一个符合上述三点的化学方程式:_______________;它们之间也存在不同之处,其中一个反应与另外两个反应不同,其不同之处是______________________________。
(2)在绪言中学过的反应 ,也与上述三个反应有相似之处,其相似之处是______________________________。
,也与上述三个反应有相似之处,其相似之处是______________________________。
【参考答案】
1. D
2. D
3. (1)从反应类型上看都是化合反应(或都是氧化反应);从反应条件上看都是点燃;生成物都是氧化物。(任答其中两点即可,其他合理答案也可) 
2MgO或 (其他合理化学方程式也可)①中的生成物是有毒物质,其他生成物是无毒物质;②是有毒物质燃烧生成无毒物质,其他不是;③中的燃烧产物是固体,其他不是。(任答一点即可,其他合理答案也可)
(其他合理化学方程式也可)①中的生成物是有毒物质,其他生成物是无毒物质;②是有毒物质燃烧生成无毒物质,其他不是;③中的燃烧产物是固体,其他不是。(任答一点即可,其他合理答案也可)
(2)生成物都是氧化物
第二篇:中考重要的化学方程式汇总
初三化学复习资料
<重 要 化 学 方 程 式 汇 总>
石灰石(或大理石)与稀盐酸反应(实验室制CO2):CaCO3 + 2HCl === CaCl2 + H2O+ CO2↑ 二氧化碳通过澄清石灰水(检验CO2):Ca(OH)2 + CO2 =CaCO3↓+ H2O
MnO2
氯酸钾与二氧化锰的混合物共热:2KClO3 2KCl + 3O2↑ 加热高锰酸钾:2KMnO4
△
K2MnO4
2
2
↑
MnO2 HO + O↑ 过氧化氢:H
2O2
=========22
一、 与氧气的反应
(1)化合反应
1、木炭在氧气中燃烧:C + O2
点燃
CO2 (在氧气中:产生使石灰水变浑浊的无色气体) 点燃
2、木炭在空气中不充分燃烧:2C + O2 3、一氧化碳在氧气中燃烧:2CO + O2 4、硫粉在氧气中燃烧: S + O2 5、磷在氧气中燃烧:4P + 5O26、铁在氧气中燃烧:3Fe + 2O2
点燃
2CO
2CO2 (产生蓝色火焰)
点燃
SO2 (在空气中:呈淡蓝色火焰;在氧气中:呈明亮的蓝紫色火焰,产生有刺激
性气味的气体)
点燃
2P2O5 (产生浓厚的白烟)
Fe3O4 (剧烈燃烧,火星四射,生成黑色固体) 瓶底留少量 2MgO (发出耀眼的白光,生成白色固体) 2CuO (红色固体变为黑色固体)
水或细沙
点燃
7、镁在空气中燃烧:2Mg + O2 8、铜在空气中加热;2Cu + O2
点燃 9、氢气在空气中燃烧:2H2 + O2
点燃
2H2O (产生淡蓝色火焰,干冷烧杯壁有小水珠。或产生爆鸣声)
(2)有机物质与氧气的反应[不属于四大反应类型中的任何一种]
10、甲烷在空气中燃烧:CH4 + 2O2
点燃
CO2 + 2H2O
11、酒精在空气中燃烧:C2H5OH + 3O2
点燃
2CO2 + 3H2O
二、制取气体
MnO2
1、实验室过氧化氢与二氧化锰的混合物制氧气:2H2O2 加热高锰酸钾制氧气:2KMmO4
2H2O+ O2↑
K2MnO4 + MnO↑ 2 + O 2 加热氯酸钾(白色)和二氧化锰混合制氧气:2KClO3 2KCl + 3O2↑(黑色固体与白固体末混合)
2
2、石灰石(或大理石)与稀盐酸反应(实验室制CO2):CaCO3 + 2HCl === CaCl2 + H2O+ CO2↑ 3、高温煅烧石灰石(工业上制二氧化碳的方法):CaCO3
高温
CaO + CO2↑
常见的金属锌、铁、镁、铝与稀盐酸或
稀硫酸反应的模式:
M + H2SO4 = MSO4 +H2↑ M+ 2HCl = MCl2 + H2↑
注意:铝与酸反应生成氢气的反应方程式在
4、锌和稀硫酸反应(实验室制H2):Zn + H2SO4 = ZnSO4 + H2↑ 5、锌和稀盐酸反应:Zn + 2HCl = ZnCl2 + H2↑ 6、镁和稀盐酸反应:Mg + 2HCl = MgCl2 + H2↑
二、 还原反应
(1)置换反应
1、木炭还原氧化铜:C+2CuO
高温
2Cu + CO2↑(黑色固体变为红色、产生使澄清石灰水变浑浊的气体)
2、焦炭还原氧化铁:3C+ 2Fe2O3 3、氢气还原氧化铜:H2 + CuO
高温
4Fe + 3CO2↑
△
2O(黑色固体变为红色,试管内壁有无色液滴产生)
(2)以下反应不属于四大反应类型中的任何一种 4、一氧化碳还原氧化铜:CO+CuO
高温
Cu + CO2↑(黑色固体变红色,产生使澄清石灰水变浑浊的气体)
2Fe + 3CO2
5、一氧化碳还原氧化铁:3CO+ Fe2O3
(以上物质反应的特点是:反应前为某金属的氧化物反应之后为此金属氧化物对应的金属单质)
四、其他
1、水在直流电的作用下分解:2H2O
通电
2、二氧化碳通过灼热碳层: C + CO2
高温
2H2↑+O2 ↑(电极:正氧负氢;体积比:2CO
VH:VO = 2:1)
2
2
3、二氧化碳和水反应 :CO2 + H2O =H2CO3(CO2通入紫色石蕊试液,试液由紫色变为红色): 4、碳酸不稳定而分解:H2CO3 =H2O + CO2↑(石蕊试液由红色变紫色)
P.S. 四个基本反应类型(特点): 化合反应:多变一 分解反应:一变多
置换反应:反应前后都有单质 复分解反应:反应物生成物都为化合物
-
20xx年中考化学方程式总结
一、化合反应:由两种或两种以上的物质生成一种新物质的反应(combinationreaction)。(一)金属单质和氧气反应:某些…
-
中考化学方程式总结现象
化学方程式汇总一.物质与氧气的反应:(1)单质与氧气的反应:1.镁在空气中燃烧:2Mg+O2点燃====2MgO现象:燃烧、放出大…
-
20xx年中考化学方程式总结(恩思教育)
物质与氧气的反应:(1)单质与氧气的反应:(掌握反应现象和注意事项)1.镁在氧气中燃烧:2Mg+O2=点燃=2MgO(剧烈燃烧.耀…
-
中考化学方程式总结
初三化学方程式总结及现象与氧有关的化学方程式:2Mg+O2====2MgO现象:燃烧、放出大量的热、同时放出耀眼的白光S+O2==…
-
中考化学方程式总结
初三化学方程式总结及现象与氧有关的化学方程式:2Mg+O2点燃====2MgO现象:燃烧、放出大量的热、同时放出耀眼的白光S+O2…
-
中考总结
精心构思设计,协作共铸成功秦皇岛市第十六中学20xx年的中考工作顺利结束了。我校今年的毕业生在小学升初中时入学平均分位居全区第七位…
-
中考总结
(陶圩初中)成绩喜人,再创辉煌。20xx年中考工作结束了,我校在上级主管部门的领导下,在全体师生的努力下,中考再创辉煌,20xx年…
-
中考总结
20xx中考总结教育教学工作是一个学校的中心工作,而九年级毕业班的教育教学工作又是中心工作中的“重点”。因此,毕业班的教育教学工作…
-
中考总结会交流材料
**中中考总结会交流材料尊敬的各位领导、各位同仁:大家好!我们汉中十分珍视这次全旗中考总结会的学习机会,感谢教育局组织这样让我们学…
-
中考总结
中考结束,作为教师又经历了一次中考,在此对初中数学复习时的方法,进行一些总结。中考的复习,一般情况,分为两个轮次,首先是知识点的掌…
-
出纳岗位年终总结
20xx年年终总结20xx年过去了,有些不舍,因为这一年对我来说有很多难以忘怀的事情:这一年,意义重大。回首过去一年的工作,发现有…