药化总结
课件中的思考题
第十四章心脏疾病药物和血脂调节药
1. 抗心律失常药可分为哪几大类?各举一例
答:I类:钠通道阻滞剂——IA类:奎尼丁,
IB类:美西律,利多卡因,苯妥英
IC类:普罗帕酮,醋酸氟卡尼
Ⅱ类:β受体阻断剂——普萘洛尔,美托洛尔
III类:钾通道阻滞剂——胺碘酮
Ⅳ类:钙通道阻滞剂——地尔硫卓,盐酸维拉帕米
2. 降血脂药可分为哪几类?举例说明
答:(1)烟酸类——烟酸
(2)苯氧乙酸类——氯贝丁酯,吉非贝齐
(3)羟甲戊二酰辅酶A还原酶抑制剂——洛伐他汀,辛伐他汀,氟伐他汀
(4)其它类——右旋甲状腺素
3. 何谓HMG-CoA 还原酶抑制剂?其临床主要用途是什么?
答:即羟甲戊二酰辅酶A还原酶抑制剂,现临床使用的HMG-CoA 还原酶抑制剂为他汀类药物,包括洛伐他汀,辛伐他汀,氟伐他汀等6类。此类药物能明显降低血浆总胆固醇,低密度脂蛋白胆固醇,VLDL和甘油三酯水平,而是高密度脂蛋白胆固醇含量增加,临床用于血脂调节药。(他汀类药物对HMG-CoA 还原酶具有高亲和力,可竞争性抑制HMG-CoA 还原酶活性,阻断HMG-CoA向甲羟戊酸的转化,是肝脏合成胆固醇明显减少,使LDL受体基因脱抑制,LDL受体表达增加,使血浆中的IDL及LDL被大量摄入肝脏,降低LDL及IDL的血浆浓度。另一方面,肝脏合成载脂量B100减少,也使VLDL合成下降。)
4.简述他汀类降血脂药物的构效关系
答:
(1)3, 5-二羟基羧酸是产生活性的必需结构,含有内酯的化合物须经水解才能起效,
可看作前体药物。
(2)改变C5与环系之间两个碳的距离会使活性减弱或消失。
(3)3,5-二羟基的绝对构型必须与美伐他汀和洛伐他汀中3, 5-二羟基的构型一致。
(4)在C6和C7间引入双键会使活性增加或减弱。
(5)环B中引入了4-氟苯基和异丙基,有助于产生较好的活性, 4-氟苯基与中心芳
环不能共平面。
第十五章甾体激素药
1、举例说明雌激素、雄激素、同化激素、孕激素及糖皮质激素的结构特征。
答:雌甾烷(雌激素)雄甾烷(雄激素)
孕甾烷(孕激素、肾上腺皮质激素)
苯丙酸诺龙(同化激素)——睾酮的4位及9α位引入卤
素,或除去19-甲基
羟甲烯龙(同化激素)——甲睾酮的A环进行改造,引入SP2
杂化原子,使A环的结构趋于平面化
3、试比较反式己烯雌酚和天然雌二醇结构的相似之处,解释反式己烯雌酚具有雌激素活性的原因。
答:反式己烯雌酚(左)雌二醇(右)
反式已烯雌酚等非甾体雌激素之所以有雌激素样作用是因为它们的结构和天然甾体雌激素的结构(尤其是立体结构)非常相似:
(1)都具有一个大体积的刚性而惰性的母环
(2)母环的两端都有两个能形成氢键的基团,和受体结合
(3)两个形成氢键的基团间的距离为14.5?
(4)空间长度和宽度均为8.55 ?和3.88 ?。
4、同化激素的临床用途及主要副作用是什么?
答:临床用途——主要用于蛋白质同化或吸收不足,以及蛋白质分解亢进或损失过多等情况,
如严重烧伤,手术后慢性消化性疾病,老年骨质疏松和肿瘤恶液质等
病人。
不良反应——长期饮用引起水钠潴留及女性轻微男性化现象。有时引起黄絙,肾炎,心力衰
竭。
5、半合成孕激素有几种结构类型?各自的先导化合物分别是什么?试述其结构改造方法。 答:(1)孕酮类孕激素--以黄体酮为先导化合物
改造方法:①在17α位引入OH,则活性降低。但是再将OH酯化则活性强而持久。
②由于6位羟基化,16位和17位氧化是黄体酮失活的主要途径,因此C6位引入双键、Cl
原子或CH3,均可阻止其代谢,提高孕激素活性,而且可以口服。
(2)19-去甲睾酮类孕激素--以睾酮为先导化合物
改造方法:①在睾酮的17α位引入乙炔基,不呈现雄激素活性,而具有孕激素样活性,称
之为妊娠素。
②将妊娠素结构中的19-甲基去掉,得到炔诺酮,孕激素活性为妊娠素的5倍,雄性活性下
降,可口服;主要与炔雌醇合用作为短效口服避孕药。
6、简述肾上腺糖皮质激素的结构改造方法。
答:(1)引入C1,C2双键——△1、2衍生物:氢化泼尼松
(2)甾体激素中引入氟原子——6α-氟及9α-氟衍生物:
6α-氟代氢化泼尼松、9α-氟代氢化泼尼松、氟轻松
(3)皮质激素中引入16位甲基——16-甲基衍生物:地塞米松
(4)做成前药——21位酯化衍生物:地塞米松磷酸钠
7、肾上腺糖皮质激素类药物有哪些临床用途?它们有哪些主要副作用?
答:临床用途——治疗类风湿、类风湿性关节炎,变态反应性疾病,过敏性疾病,白血
病,哮喘等。外用用于湿疹,皮炎等皮肤病。
主要副作用——钠潴留作用。
第十六章降血糖药物和骨质疏松药物
1、简述糖尿病的类型以及相应的降血糖药物的类型,各举一例
答:糖尿病类型——Ⅰ型糖尿病(胰岛素依赖型,占10%,严重,胰岛细胞受损) Ⅱ型糖尿病(非胰岛素依赖型,占90%,与肥胖、营养过剩有关)
降血糖药物的类型:
胰岛素分泌促进剂—磺酰脲类降糖药:甲苯磺丁脲、格列吡嗪
非磺酰脲类降糖药:瑞格列奈
胰岛素增敏剂—双胍类:二甲双胍
噻唑烷二酮类:马来酸罗格列酮
α-葡萄糖苷酶抑制剂—阿卡波糖、伏格列波糖、米格列醇
第十七章合成抗菌药
1、试理解代谢拮抗的概念。磺胺类药物是如何通过拮抗细菌的正常代谢而发挥作用的? 答:代谢拮抗——设计与生物体内基本代谢物的结构有某种程度相似的化合物,使之竞争性
地和特定的酶相作用,干扰基本代谢物的被利用,从而干扰生物大分
子的合成;或以伪代谢物的身分掺入生物大分子的合成中,形成伪生
物大分子,导致致死合成,从而影响细胞的生长。
磺胺类药物作用机制——磺胺类药物和PABA竞争性地和二氢叶酸合成酶结合,占据二氢叶
酸结构中PABA的位置,生成无功能的伪二氢叶酸,妨碍了二氢叶酸
的生物合成,最终抑制生物大分子的生物合成,致使细菌生长繁殖受
到阻碍。
2、什么是抗菌增效剂?简述各类抗菌增效剂的作用原理,说明SMZ常和TMP组成复方制 剂使用的原因。
答:抗菌增效剂——是指抗菌药物和其他药物配伍使用时,所产生的治疗作用大于两个
药物分别给药的作用总和。
各类抗菌增效剂的作用原理:
二氢叶酸还原酶抑制剂----甲氧苄啶
抑制使药物分解的酶----克拉维酸
降低药物的排泄速度----丙磺舒
作用于同一个靶点----异烟肼和利福平
复方新诺明——SMZ(磺胺甲恶唑)和TMP(甲氧苄啶)复方剂作用原理:
甲氧苄啶是二氢叶酸还原酶抑制剂,可阻止二氢叶酸还原为四氢叶酸,当磺胺
类药物与甲氧苄啶合用时,使细菌体内的四氢叶酸合成受到双重阻断,产生协
同抗菌作用,作用增强数倍至数十倍,并使磺胺类药物具有杀菌作用。
3、简述磺胺类药物的构效关系。
答:
(1)对氨基苯磺酰胺基是必需的基本结构,即苯环上的氨基与磺酰胺基必须处于对位,而
邻位或间位异构体无抑菌活性。
(2)芳伯氨基上的取代基对抑菌活性有较大的影响,多数磺胺药没有取代基,如有
取代基者,必须在体内易被酶分解或还原为游离的氨基才有效。
(3)磺酰胺基的N原子上单取代可使抑菌作用增强,而以杂环取代时抑菌作用明显
增强,而N, N-双取代化合物一般活性丧失。
(4)苯环被其它芳环取代或在苯环上引入其它基团,抑菌活性降低或丧失。
(5)磺胺类药物的抗菌活性和解离常数Pka值有密切关系,当Pka值为6~7.4时抗
菌作用最强。
4、什么是致死合成(Lethal Synthesis)?
答:致死合成——指与细胞正常代谢物结构相似的外来化合物,参与代谢过程,生成高毒性
的、可致细胞死亡的毒作用。是一种特殊类型的化学损伤。
5、简述喹诺酮药物的构效关系。
答:
(1)A环是抗菌作用必需的基本结构,变化较小;其中3位COOH和4位C=O是抗菌活性
不可缺少的部分。而B环可作较大改变,可以是苯环、吡啶环和嘧啶
环等。
(2)1位取代基对抗菌活性的影响较大。若为脂肪烃基,以乙基或与乙基体积相近的取代
基(如氟乙基)取代活性较好;若为脂环烃基,以环丙基取代活性最
好;若为芳烃基,以2,4-二氟苯基和4-羟基苯基为佳。
(3)2位引入取代基,其活性减弱或消失;2位为氮原子时(如西诺沙星),药代动力学性能
有改善,但其体外活性低于相应的药物(如奥索利酸)。
(4)5位取代基中以氨基为最好,可提高吸收或组织分布,其它基团取代则活性下降。
(5)6位引入氟原子,可使活性显著增强,原因是6位氟原子的引入可使药物增加对DNA
旋转酶的结合力,而且对细菌细胞壁的穿透性也增加。
(6)7位引入五元或六元杂环,抗菌活性明显增强,以哌嗪基为最好。
(7)8位以氟原子取代为最佳,可以增加口服吸收,体内活性增强。
6、试述异烟肼引起肝脏毒性的主要原因。
答:异烟肼的其中一个代谢产物为乙酰肼,乙酰肼被认为是微粒体CYP450的底物,乙 酰肼被CYP450氧化形成乙酰肼中间体,它可衍生出酰基自由基或酰基阳离子,而这均可导 致肝蛋白的酰化,引起肝坏死。
第十八章抗病毒药
1、按作用机制分类,抗非逆转录病毒药物主要分为几类?各举一例药物。
答:(1)抑制病毒复制初始时期(吸附、穿入)的药物—盐酸金刚烷胺、磷酸奥塞米韦
(2)干扰病毒核酸复制的药物——核苷类:碘苷(嘧啶类)、阿糖腺苷(嘌呤类)
糖基修饰的核苷类(即开环核苷类):阿昔洛韦、
更昔洛韦、法昔洛韦
非核苷类:利巴韦林
(3)影响核糖体翻译的药物——美替沙腙
2、核苷类抗病毒药物是如何设计出来的?试举出一例药物说明。
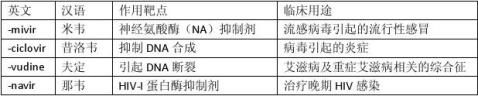
3、试说明药名中含有“-mivir”、“-ciclovir”、“-vudine”、“-navir”词尾的药物的作用靶点及主要临床用途。
4、简述抗艾滋病药物的发展,有哪些代表性药物?
答:艾滋病(AIDS)是由人免疫缺陷病毒I型(HIV-I)感染引起的严重疾病。尽管人们在艾
滋病药物的研究上花费了大量人力,财力,但对此病目前仍无治愈的可能。
代表药物:(1)逆转录酶抑制剂——核苷类:齐多夫定,拉米夫定
非核苷类:奈韦拉平
(2)HIV蛋白酶抑制剂——沙喹那韦
第十九章抗生素
1、抗生素按化学结构可分为哪几大类?各举一例药物。
答:(1)β-内酰胺类——青霉素
(2)四环素类——四环素、盐酸多西环素
(3)氨基糖甙类——链霉素
(4)大环内酯类——红霉素
(5)其它类——氯霉素
2、简述青霉素对酸、碱、酶的不稳定性,试以反应式表示。
答:反应式表示见白仁仁资料第十章抗生素第3题。
(1)对酸不稳定:——
强酸:在强酸条件下或氯化高汞的作用下,β-内酰胺环发生裂解,生成青霉酸,青
霉酸与水生成青霉醛酸,青霉醛酸不稳定,释放出二氧化碳,生成青霉醛。另
一途径为青霉酸脱二氧化碳生成青霉噻唑酸,再分解为D-青霉胺和青霉醛。
弱酸:在弱酸(pH=4)的室温条件下,侧链上羰基氧原子上的孤对电子作为亲核试剂
进攻β-内酰胺环,再经重排生成青霉二酸,青霉二酸可进一步分解生成青霉
胺和青霉醛。
(2)对碱不稳定——在碱性条件下,碱性基团向β-内酰胺环进攻,生成青霉酸,青
霉酸加热时易失去二氧化碳,生成青霉噻唑酸,遇氯化高汞青霉噻唑酸进一
步分解生成青霉胺和青霉醛。
(3)对酶不稳定——在β-内酰胺酶的作用下,酶中亲核性基团向β-内酰胺环进攻,
生成青霉酸。
3、简述寻找耐酸、耐酶、广谱青霉素的研究方法。
答:耐酸——在6位酰胺基的α位引入O、N、X等电负性原子。天然青霉素V。
耐酶——通过改变6位侧链,引入立体障碍大的基团,可以阻止青霉素和β-内酰胺酶的活
性中心作用,同时可以限制侧链和酰胺C=O之间的单键旋转,迫使青霉素
分子变成一种与酶活性中心不易适应的构型,降低了青霉素与酶活性中心
作用的适应性,从而保护了分子中的β-内酰胺环。苯唑西林。
广谱——合成一系列含有NH2,COOH,SO3H的侧链的半合成青霉素。阿莫西林。
4、为什么青霉素G不能口服?而青霉素V却可以口服?为什么青霉素G的钠盐或钾盐必须做成粉针剂型?
答:青霉素G——胃酸的酸性很强,可导致侧链酰胺键的水解和β-内酰胺环开环,而使青
霉素失活。青霉素G的钠盐或钾盐水溶液显碱性,而青霉素G在碱性
条件下不稳定,易失活,所以必须做成粉针剂型
青霉素V——原因是其6位酰胺侧链上连有吸电子基,可阻碍电子转移,避免分子
内重排,增加了对酸的稳定性。
5、奥格门汀是由哪两种药物组成?说明两者合用起增效作用的原理。
答:奥格门汀——将克拉维酸和阿莫西林组成复方制剂。
增效作用原理——有阿莫西林和克拉维酸组成。阿莫西林为广谱β-内酰胺类抗生素,对多
种细菌感染有效,但有些细菌能产生一种叫β-内酰胺酶的物质,使得阿
莫西林的结构被破坏导致失效,而克拉维酸正好可抑制此酶的产生,使
得阿莫西林不受此酶的影响而发挥更好的作用。
6.试比较头孢菌素与青霉素的结构特点和作用特点。
答:(1)头孢菌素的母核是由β-内酰胺环与氢化噻嗪环拼合而成,与青霉素的四元并五元
环稠和系统相比,其β-内酰胺环分子内张力较小,因此比青霉素稳定。
(2)头孢菌素的β-内酰胺环上的孤对电子与氢化噻嗪环中的双键形成共轭,β-内酰
胺环趋于稳定,因此多数头孢菌素类抗生素具有耐酸的性质。
(3)头孢菌素的过敏反应发生率较低,且彼此不引起交叉过敏反应。
7、简述天然四环素类抗生素的不稳定性,并说明四环素类抗生素不能和牛奶等富含金属离子的食物一起使用的原因。
答:(1)四环素在干燥条件下比较稳定,但在碱性及酸性条件下易水解。
(2)四环素含有许多羟基、烯醇羟基及羰基,在近中性条件下能与Ca+等多种金属离子形
成不溶性螯合物。沉积在骨骼和牙齿上,可能发生牙齿变色、骨骼生长抑制。
8、氨基糖苷类抗生素有哪些共性?为什么氨基糖甙类抗生素易产生耐药性?
答:共性——都呈碱性,多为极性化合物,很稳定,毒性大,抗菌谱广,抗菌机制为抑制细
菌蛋白质的生物合成而呈现杀菌作用。
耐药机制——通过产生灭活酶改变氨基糖苷类结构,使其失去抗菌活性,或通过改变细菌膜
通透性而发生非特异性耐药。
9、为什么红霉素口服后生物利用度极低?
答:红霉素水溶性小,只能口服,但在胃酸中不稳定,易分解迅速失去活性。
见白仁仁资料第十七章抗生素第9题。
10、试从红霉素的不稳定性说明半合成红霉素药物的设计原理,并举出两例药物。 答:见白仁仁资料第十七章抗生素第10题。
第二十章抗肿瘤药物
1、试述抗肿瘤药物的主要类别,每类举出两个常用药物。
答:(1)直接作用于DNA的药物——环磷酰胺,卡莫司汀,顺铂类
(2)干扰DNA合成的药物——氟尿嘧啶,硫嘌呤,甲氨蝶呤,
(3)抗有丝分裂的药物——长春碱,长春新碱
(4)基于肿瘤生物学机制的药物——吉非替尼
2、什么是烷化剂?写出其主要结构类型,各举一例药物。
答:烷化剂——在体内能转化为缺电子的活泼中间体或其它具有活泼的亲电性基团的化合物,
进而与生物大分子中含有丰富电子的基团(发生共价结合,使DNA等丧
失活性或使DNA分子发生断裂。
分类——氮芥类:盐酸氮芥,美法仑,氮甲,环磷酰胺
乙撑亚胺类:替哌,塞替哌
磺酸酯类:白消安
亚硝基脲类:卡莫司汀,洛莫司汀
3、试从氮芥类药物的结构和作用机制解释为什么芳香氮芥比脂肪氮芥的抗肿瘤活性弱而毒 性较低。
答:见白仁仁资料第十八章抗肿瘤第3题。
4、为什么环磷酰胺比其它氮芥类药物的毒性小?
答:见白仁仁资料第十八章抗肿瘤第4题。
5、抗代谢抗肿瘤药物的设计原理是什么?试举一例药物说明。
答:见白仁仁资料第十八章抗肿瘤第6题。
6、抗肿瘤抗代谢物有哪些种类?各举一例药物。
答:见白仁仁资料第十八章抗肿瘤第5题。
第二十二章非甾体抗炎药
1、解热镇痛药和非甾体抗炎药各有哪些结构类型?举例说明。
答:解热镇痛药——水杨酸类:阿司匹林
苯胺类:对乙酰氨基酚
吡唑酮类:安乃近
非甾体抗炎药——3, 5-吡唑烷二酮类:保泰松
邻氨基苯甲酸类:甲芬那酸
芳基烷酸类:双氯芬酸钠、布洛芬
1, 2-苯并噻嗪类:吡罗昔康
2、简述非甾体抗炎药的作用机理及发展方向。
答:大部分非甾体抗炎药是通过抑制花生四烯酸环氧合酶。某些新型药物还可以选择性
抑制COX-2或对脂氧酶和环氧合酶进行双重作用,阻断前列腺素、白三烯的生物合成而达到消炎、解热、镇痛作用。
3、长期大剂量服用扑热息痛引起肝损伤的原因是什么?以反应式表示。
答:对乙酰氨基酚的体内代谢主要受CYP450酶系催化,主要的代谢途径是羟基酚基与葡萄
糖醛酸结合和与硫酸结合,还有少量生成对肝细胞有害的N-羟基乙酰氨基酚,进一步转化成具有毒性的N-乙酰基亚胺醌。正常情况下该代谢产物可与内源性的谷胱甘肽结合而解毒,但在大量或过量服用扑热息痛后,肝脏内的谷胱甘肽会被耗竭,N-乙酰亚胺醌会进一步与肝脏蛋白的亲和基团结合而引起肝坏死。
5、为什么长期服用阿司匹林会产生胃出血?
答:(1)由于它是环氧化酶不可逆抑制剂,抑制了胃粘膜内PGI2的生物合成,而PGI2有抗
胃酸分泌、保护胃粘膜和防止溃疡形成的作用,从而造成胃溃疡甚至胃出血。
(2)其酸性较强,易造成对胃肠道刺激副作用。
6、试述阿司匹林的不稳定性,应如何保管?
答:在干燥空气中较稳定,遇湿气即缓缓水解生成水杨酸和醋酸,遇碱或加热时水解更快。
故应置于密闭容器中于干燥处保存
7、什么是前药原理和拼合原理?并举例说明。
答:详见白仁仁资料总结补充部分。将两个相同或不同的先导化合物或前药经共价键连接成一个新分子,产生协同作用,以增强其在体内的活性或提高选择性。拼合所得的药物是一种在体内分解为两个原药,另一种在体内不裂解。举例:阿司匹林和乙酰氨基酚均有解热镇痛活性,拼合成“贝诺酯”,具有相同作用,及解决了阿司匹林对胃的刺激,又增强了药效。
-
药物化学总结
第一章麻醉药分类:苯甲酸酯类、酰基苯胺类等局麻药的构效关系(1)亲脂性部分1苯环的邻对位引入给电子取代基,如氨基、羟基、烷氧基时,…
-
药物化学总结
?抗过敏药分类及代表药物一.组胺H1受体拮抗剂和抗过敏药1.经典H1受体拮抗剂:乙二胺类:芬苯扎胺,曲吡那敏。氨基醚类:苯海拉明,…
-
药化总结
课件中的思考题第十四章心脏疾病药物和血脂调节药1抗心律失常药可分为哪几大类各举一例答I类钠通道阻滞剂IA类奎尼丁IB类美西律利多卡…
-
药物化学总结
药物化学总结第一章麻醉药第一节全身麻醉药1吸入麻醉药氟烷2溴2氯111三氟乙烷起效苏醒快作用弱全麻及诱导麻醉性质1氧瓶燃烧2加入硫…
-
药物化学知识点总结
药物化学知识点总结不含结构式师兄只能帮你们到这里了需要的自己粘贴来源田牧的日志前言这是本人总结的药物化学知识点请仔细核对一下是否正…
-
药物化学总结
第一章麻醉药分类:苯甲酸酯类、酰基苯胺类等局麻药的构效关系(1)亲脂性部分1苯环的邻对位引入给电子取代基,如氨基、羟基、烷氧基时,…