离子反应规律及离子方程式书写知识点总结及习题
离子反应规律和离子方程式书写
1 基本概念
1.1 离子反应
在溶液(或熔化态)中有离子参与或有离子生成的化学反应统称离子反应。它包括有离子参与或有离子生成的氧化还原反应和非氧化还原反应两大类。
1.2 强电解质和弱电解质
在溶液中(或熔化状态)本身能发生电离的化合物叫电解质,不能发生电离的化合物叫非电解质。在溶液中能全部电离成离子的电解质叫强电解质,它包括大多数的盐类、强酸和强碱。;在溶液中只有部分电离为离子的电解质叫弱电解质,它包括弱酸(H2SO3、HF、HClO)以及弱碱(NH3•H2O)等。
2 离子反应规律
2.1 复分解反应发生的条件
对于复分解反应而言,有下列三种物质之一生成的反应就能进行完全:①更难溶物质;②更难电离的物质;③气态物质。简言之,复分解反应的方向总是朝着有利于某种离子浓度减少的一方进行。
(1)沉淀的生成及转化
常见难溶物有:①酸:H2SiO3 ;②碱:Mg(OH)2 、Al(OH)3、Cu(OH)2、Fe(OH)3等;③盐:AgCl、 AgBr、AgI、BaCO3、BaSO4、Ca3(PO4)2等。
[练2-1] 向一支盛有食盐水的试管中加入硝酸银,使之恰好反应完全,再加入一些碘化钾晶体后沉淀转化黄色,再加入一些硫化钾溶液,沉淀又转为黑色。由此实验判断这三种沉淀的溶解度(S)大小关系(B)
A.S(AgCl)=S(AgI)=S(Ag2S) B. S(AgCl)> S(AgI) > S(Ag2S)
C. S(AgCl)< S(AgI)< S(Ag2S) D. 无法判断
(2)更弱电解质的生成
常见弱电解质有:①弱酸:HF、H2CO3、HClO、CH3COOH等; ②弱碱:NH3•H2O;③其它:H2O、C6H5OH 等
[练2-2] 用化学方程式表示:漂白粉溶液漂白织物时要露置于空气中:
Ca(ClO)2 + CO2 +H2O = CaCO3↓+ 2HClO
[练2-3] 已知硫酸铅难溶于水,也难溶于硝酸中,但却可溶于醋酸铵溶液,其化学反应方程式是:PbSO4 + 2CH3COONH4 = Pb(CH3COO)2 + (NH4)2SO4 [根据离子反应规律可推断生成的可溶性盐Pb(CH3COO)2应该是难电离的弱电解质才对]
当在上述生成的醋酸铅溶液中通入弱电解质硫化氢时,立即出现黑色沉淀(PbS)。写出表示这个反应的离子方程式:Pb(CH3COO)2 + H2S = PbS↓+ 2CH3COOH
(3) 气态物质生成
常见气态物有:SO2、CO2、NH3、H2S 等
[练2-4] 用化学反应方程式表示:
① 大理石与盐酸反应: CaCO3 +2HCl = CaCl2 + CO2↑ +H2O
② 实验室制硫化氢气体 FeS + 2HCl = FeCl2 + H2S↑
[想想] ①CuSO4 + H2S = CuS↓ + H2SO4 反应能发生,而 FeCl2 + H2S =FeS↓ + 2HCl却不能发生,为什么?
②将KCl溶液与 NaNO3 溶液混合是否发生化学反应?若把该混合溶液蒸发干后得到的晶体是什么?
2.2 强酸制弱酸(强强生弱)规律及应用
根据酸碱质子理论,凡能提供质子(H+)的粒子(离子或分子)都是酸(如 HCl、HNO3、及酸式根离子 HCO3-等),酸失去质子后生成的粒子则为该酸的共轭碱;凡能接受质子(H+)的粒子(离子或分子)都是碱(如NH3、NaOH、Ca(OH)2、及弱酸根离子CO32- 等),碱得到质子后生成的粒子则为该碱的共轭酸。
酸和碱反应的实质是质子(H+)的转移。反应的方向总是朝着生成更难电离的更弱的酸碱的一方进行的, 即要符合“强酸制弱酸”或 谓“强强生弱”规律,可简记为”左强右弱”。

[例] 已知下列反应能进行完全:
① Na2CO3 + 2CH3COOH = 2CH3COONa + CO2↑ + H2O
② CO2 + H2O + C6H5ONa = C6H5OH + NaHCO3
③ CH3COONa + HCl = NaCl + CH3COOH
④ C6H5OH + Na2CO3 = C6H5ONa + NaHCO3
则根据“左强右弱”规律可得:
失 H+ 减弱,酸性减弱
 酸 ( H+ ) HCl CH3COOH H2CO3 C6H5OH HCO3-
酸 ( H+ ) HCl CH3COOH H2CO3 C6H5OH HCO3-

碱 Cl- CH3COO- HCO3- C6H5O- CO32- (OH-)
 得 H+ 增强,碱性增强
得 H+ 增强,碱性增强
[例2-5 ] 已知多元弱酸在水溶液中电离是分步的,且第一步电离远大于第二步电离,第二步电离远大于第三步电离。今有 HA、H2B、H3C 三种弱酸,且已知下列各反应能发生:
① HA + HC2- (少量)= A- + H2C-
② H2B (少量)+ 2A- = B2- + 2HA
③ H2B (少量)+ H2C- = HB- + H3C 试回答:
(1)相同条件下,HA、H2B、H3C 三种酸中,酸性由强到弱的顺序为 H2B> H3C HA>;
(2)在A-、B2-、C3-、HB-、H2C-、HC2- 离子中最易结合质子的是C3- ,最难结合质子的是HB- .
(3)完成下列反应的离子方程式:
①H3C + 3OH- (过量)= C3- + 3H2O ; ② 2HA (过量)+ C3- = 2A- + H2C-.
[解] 由已知①式得 HA>H2C-, 由②式得 H2B>HA,由③式得H2B>H3C,又依分步电离,电离度逐级锐减,可得相关微粒酸碱性强弱顺序表:

根据顺序表中上行酸的位置可得第(1)题答案为H2B> H3C HA>; 由表中下行碱的位置可得第(2)题答案为C3- ; HB- .
在表中H3C位于OH-左上,据”左上右下可反应”得(3)①式的反应可以进行完全.据”强强优先”原则可知随OH-用量的增加,H3C 反应的产物依次是H2C-、HC2-、C3-,因题给OH-为过量,所以H3C反应最后产物是C3-,故第(3)①题答案是C3- + 3H2O;同理第(3)②题答案是 2A- + H2C-.
[练2-6] 等物质的量浓度的两种一元弱酸(HA,HB)的钠盐溶液中,分别通入少量 CO2 后可发生如下反应: ① NaA + CO2 +H2O = HA + NaHCO3 ② 2NaB + CO2 + H2O = 2HB + Na2CO3
试比较HB与HA酸性强弱。 答:HB的酸性比 HA 弱
[解法提示] 从①式得: A- 只能使H2CO3 失去一个H+ 形成HCO3-, 从②式得 B- 则可使H2CO3失去两个H+ 形成CO32-.换句话, B- 结合H+的能力比 A- 强,HB电离出H+能力则比HA 弱,即HB酸性比HA弱。酸性强弱顺序为:H2CO3 > HA > HCO3- > HB
3 离子方程式的书写
3.1.1 离子方程式书写方法步骤—“写拆删查“
以次氯酸钠溶液中通入二氧化碳为例
第一步“写“ 2NaClO + CO2 + H2O = 2HClO + Na2CO3
第二步“拆“ 2Na+ + 2ClO- + CO2 + H2O = 2HClO + 2Na+ + CO32-
第三步“删“ 2ClO- + CO2 + H2O = 2HClO + CO32-
第四步“查“ 查原子个数、离子电荷是否配平
[说明] ①原则上说,电解质要不要拆分改写为离子形式,应以物质客观存在的形式为依据。若化合物主要以离子形式存在,则应“拆”为离子形式表示;若化合物主要以“分子”形式存在,则不能“拆”,而仍应以“分子”形式表示。如浓H2SO4应以分子式表示,稀H2SO4则应“拆”为离子式(2H+ 和SO42- )表示。
②牢记掌握:氧化物、弱电解质、(弱酸、弱碱、水)、气体、难溶性物质(难溶盐)等,不能拆为离子式,要用化学式表示。
③弱酸根离子,如 HCO3-、HSO3-等不能再拆(HSO42-除外)
④强酸强碱及大部分可溶性盐应拆为离子式表示。
⑤对于微溶物的处理分三种情况:微溶物作为生成物析出的不拆,仍写其化学式,(如Ca(OH)2、CaSO4、Ag2SO4);微溶物作为反应物,若呈混浊液或固态则写其化学式,若呈澄清溶液则拆为离子式表示。
3.1.2 离子方程式表示的意义
离子方程式表示的是同一类型的离子反应。如:CO32- + 2H+ = CO2↑+ H2O 它表示的是可溶性的碳酸盐与强酸反应。因此,Na2CO3与盐酸或K2CO3与 HNO3都可实现上述的离子反应。
[练3- 1]下列各组反应中,能用同一个离子方程式表示的(A)
A.硫酸溶液和硫酸钠溶液分别与氯化钡溶液反应
B.硫酸溶液分别与氢氧化钠溶液和氢氧化钡溶液反应
C.硫酸溶液分别与烧碱溶液和纯碱溶液反应
D.铁分别与稀硫酸和硫酸铜溶液反应
3.2 解说几类离子方程式的写法
(1)与反应条例有关
铵盐与强碱反应 常温下: NH4+ + OH- = NH3•H2O
铵盐与强碱反应 加热: NH4+ + OH- △NH3↑ + H2O
(2) 与反应用量比有关
(ⅰ)过量反应物能与生成物继续反应 如:
若过量的NaOH溶液中通入 CO2 2OH- + CO2= CO32- + H2O
若少量的NaOH溶液中通入过量 CO2 OH- + CO2= HCO3-
[练3- 2] 写出下列反应的离子方程式:
① 向Na2CO3溶液中滴入少量HCl溶液 CO32- + H+= HCO3-
② 向HCl溶液中滴入少量Na2CO3溶液 CO32- + 2H+= CO2↑ + H2O
(ⅱ)酸式盐与量有关的反应
如 Ca(OH)2溶液和 NaHCO3溶液混合,反应量的关系有两种情况:
第一种情况,若NaHCO3 过量,Ca(OH)2不足量。这时Ca(OH)2电离出的两种离子全部参加反应了。 写该反应的离子方程式要领是:将不足量的反应物Ca(OH)2设定为按1mol的量参与反应来进行配平书写离子方程式。因1mol Ca(OH)2电离出的2molOH-要消耗2mol HCO3- ,故对应的离子方程式为:
Ca2+ + 2OH- + 2HCO3- = 2H2O + CaCO3↓ + CO32-
第二种情况,若Ca(OH)2 过量, NaHCO3不足量。则设定不足量的NaHCO3为1mol,因其电离出的HCO3-仅需消耗1mol OH- 和1mol Ca2+ 故对应的离子方程式为
Ca2+ + OH- + HCO3- = H2O + CaCO3↓
从上例可知:不足量的某反应物是完全参与反应了,配平时就设定该反应物在化学方程式中的计量数为1, 然后按1mol该反应物电离出的阴阳离子数进行配平书写离子方程式。因该反应物中阴阳离子全部参与了离子反应而被耗尽,所以在离子方程式中这两种离子的计量数之比应符合原化合物中的组成之比。
[练3-3]写出下列各个离子方程式
(1)FeBr2溶液中通入过量的Cl2 2Fe2+ + 4Br- +3Cl2= 2Fe3+ + 2Br2 +6Cl-
(2)NaHSO4 溶液和Ba(HCO3)2溶液混合
① NaHSO4 溶液不足量: H+ + SO42- + Ba2+ +HCO3-= BaSO4↓+ H2O + CO2↑
② Ba(HCO3)2溶液不足量 2H+ + SO42- + Ba2+ + 2HCO3-= BaSO4↓ + 2H2O + 2CO2 ↑
(ⅲ)按指定量关系进行的离子反应
[例] 等体积等物质的量浓度的Ba(OH)2溶液与NH4HCO3溶液混合。
解:依题意设两种反应物的物质的量各1 mol 则反应的离子方程式为:
Ba2+ + 2OH- + NH4+ + HCO3- = BaCO3 + NH3•H2O + H2O
[例] 向含等物质的量的NH4Cl 和 AlCl3 的混合溶液中遂滴加入NaOH溶液,写出滴加过程中发生的各步反应的离子方程式
解析:开始加入的3molOH-只与其中的1molAl3+反应 3OH-+ Al3+ = Al(OH)3 ↓
接着再加入的1molOH-才与其中的1molNH4+反应 OH- + NH4+ = NH3•H2O
最后加入的1molOH-将与前生成的1molAl(OH)3反应 OH- + Al(OH)3=AlO2-+2H2O
理解了上例有关离子反应先后顺序规律后,请试完成下列反应的离子方程式:将0.2mol/L NH4Al(SO4)2溶液与0.3mol/L的Ba(OH)2溶液等体积混合, 写出离子方程式 2Al3+ + 3SO42- + 3Ba2+ + 6OH- = 2Al(OH)3↓+ 3BaSO4↓
[练3-4] ①向硫酸氢钠溶液逐滴加入氢氧化钡溶液至中性,写出离子方程式:
2H+ + SO42- + Ba2+ + 2OH- = BaSO4↓ + 2H2O
②在以上中性溶液中继续滴加氢氧化钡溶液,试写出此步反应的离子方程式:
Ba2+ + SO42- = BaSO4↓
(3)隐含反应易被忽视的离子反应
①[例] Mg(HCO3)2 与过量的NaOH溶液反应(不可忽视Mg(OH)2比MgCO3难溶)
(正) Mg2+ + 2HCO3- + 4OH- = Mg(OH)2 + 2CO32- + 2H2O
②[例] 明矾[KAl(SO4)2]与足量Ba(OH)2溶液反应 (不可忽视Al(OH)3的两性 )
(正) Al3+ + 2SO42- + 2Ba 2+ + 4OH- = AlO2- + 2H2O + 2BaSO4↓
③[例] 少量SO2通入漂白粉溶液中
(错)SO2 + H2O + Ca2+ + 2ClO- = CaSO3 + 2HClO 错在忽视了可发生的氧化还原反应:CaSO3 + HClO = CaSO4 + 2H+ + Cl- 故
(正)SO2 + H2O + Ca2+ + ClO- = CaSO4 + 2H+ + Cl-
3.3 离子方程式正误判断
离子方程式常见错误有:
① 违背客观事实,反应产物错;
② 违背守恒原则,如原子个数、离子电荷不配平;
③ 违背拆分规则,该拆没拆,不该拆却拆成离子式;
④ 违背定组成法则,若化合物中阴阳两种离子都参与了离子反应,则在离子方程式中其离子计量数之比应符合原化合物相应离子的组成之比;
⑤ 反应物间的计量数之比不符题意要求。
[练3-5]判断下列各离子方程式是否正确,并想一想错在哪里?
①向饱和碳酸氢钙溶液中加入饱和氢氧化钙溶液
Ca2+ + HCO3- + OH- = CaCO3↓ + H2O (√)
②过量的硫酸氢钠和氢氧化钡溶液反应
Ba2+ + 2OH- + 2H+ + SO42- = BaSO4↓ + 2H2O (√)
③碳酸氢铵溶液与过量的氢氧化钠溶液反应
NH4+ + OH- = NH3↑ + H2O (х)[产物还应有 CO32-]
正为 NH4+ +HCO3- + 2OH- = NH3H2O + H2O + CO32-
④向氢氧化钡溶液中逐滴加入硫酸氢铵溶液至刚好深浅沉淀完全
Ba2+ + 2OH- + NH4+ +H+ + SO42- = NH3•H2O + H2O + BaSO4↓ (√)
⑤明矾溶液中与氢氧化钡溶液,使SO42- 恰好沉淀完全
Al3+ + 2SO42- + 2Ba2+ + 4OH- = 2BaSO4↓+ AlO2- + 2H2O (√)
⑥氧化铁粉未投入氢碘酸溶液
Fe2O3 + 6HI = 2Fe3+ + 6I- + 3H2O (х)[一错HI应拆为离子;二错HI有氧化性产物应为Fe2+,不是Fe3+ ] 正为 Fe2O3 + 6 H+ + 2I- = 2Fe2+ + I2 + 3H2O
⑦在硫酸铁的酸性溶液中通入足量硫化氢
Fe3+ + H2S =Fe2+ + S↓+ 2H+ (х)[离子电荷不配平]
⑧FeS固体投入稀硝酸溶液中
FeS + 2H+ = Fe3+ + H2S↑ (х)[电荷不配平;违背客观事实,产物不是H2S ]
⑨硫酸亚铁溶液中加入过氧化氢
Fe2+ + 2H2O2 + 4H+ = Fe3+ + 4H2O (х)[电荷不配平]
⑩氯化铝溶液中加入过量氨水
Al3+ + 4NH3•H2O = AlO2- + 4NH4+ + 2H2O (х)[违背客观事实,产物应是Al(OH)3 ]
⑾在溶液中将亚硫酸氢铵与氢氧化钠等物质的量混合
NH4+ + HSO3- + 2OH- =SO32-+ NH3↑ + 2H2O (х)[两反应物用量之比与题意不符]
⑿碳酸钙溶于醋酸中
CaCO3 + 2H+ = Ca2+ + 2H2O + CO2↑ (х)[醋酸是弱电解质不能拆为离子表示]
⒀向100ml 0.1mol/L FeBr2溶液中通入 0.025mol Cl2
2Fe2+ + 4Br- + 3Cl2 = 2Fe3+ + 2Br2 + 6Cl- (√)
⒁碳酸钠溶液中加入过量苯酚 C6H5OH + CO32- = C6H5O- + HCO3- (√)
⒂澄清石灰水加入盐酸 Ca(OH)2 + 2H+ = Ca2+ + 2H2O (х)[微溶反应物应改写为离子]
⒃偏铝酸钠溶液中通入过量的二氧化碳 AlO2- + CO2 + H2O = Al(OH)3↓+ HCO3-(√)
⒄醋酸滴到碳酸钙上 CaCO3 + 2CH3COOH = Ca2+ + 2CH3COO- + H2O + CO2↑ (√)
⒅用碳酸钠溶液吸收少量二氧化硫 2CO32- + SO2 + H2O = 2HCO3- + SO32- (√)
4 离子共存问题
所谓几种离子在溶液中能大量共存,就是指这些离子之间不发生任何化学反应。若离子之间能发生反应则不能大量共存。这里指的反应不仅包括诸如生成沉淀、生成气体、生成弱电解质等的非氧化还原反应,也包括能发生的氧化还原反应。
判断离子是否共存,要注意附加隐含条件的限制。如:
若溶液为无色透明,则肯定不存在有色离子(Cu2+蓝色、Fe3+ 棕黄色、Fe2+ 浅绿、MnO4-紫色) ;
若为强碱溶液,则一定不存在能与OH?反应的离子,如 Al3+、Fe3+、Cu2+及酸式根离子等;
若为强酸性溶液,则一定不存在能与H+反应的离子,如弱酸根离子、酸式弱酸根离子。
[练4-1] 某学生欲配制下列含较多不同阴阳离子的四种水溶液,其中能配的成是 ( )
A.Na+、K+、OH-、HCO3- B. Ca2+、NH4+、NO3-、SO42-
C.NH4+、K+、SO42-、H2PO4- D. H3O+ 、K+、NO3-、I-
[练4-2] 在PH=1的无色溶液中能大量时共存的离子组是 ( )
A.NH4+、Mg2+、SO42-、Cl- B. Ba2+、K+、OH-、Ca2+
C.Al3+、Cu2+、SO42-、Cl- D. Na+、Ca2+、Cl-、AlO2-
[练4-3] 下列各组离子在溶液中因发生氧化还原反应而不能大量共存的是( )
A.H3O+、NO3-、Fe2+、Na+ B. Ag+、NO3-、Cl-、K+
C.K+、Ba 2+、OH-、SO42- D. Cu2+、NH4+、Br-、OH-
[练4-4] 下列各组离子在溶液中即可以大量存在,且加入氨水后也不产生沉淀的是( )
A.Na+、Ba2+、Cl-、SO42- B. K+、AlO2-、NO3-、OH-
C.H+、NH4+、Al3+、SO42- D. H+、Cl-、CH3COO-、NO3-
[练4-5] 若溶液中由水电离产生的C(OH-)=1╳10-14 mol/L,满足此条件的溶液中一定可以大量存在的离子组是 ( )
A.Al3+、Na+、K+、Cl- B. K+、Na+、Cl-、NO3-
C.K+、Na+、Cl-、AlO2- D. K+、NH4+、SO42-、NO3-
[练4-6] 室温下,在强酸性和强碱性溶液中都不能大量共存的离子组是 ( )
A. NH4+、Cu2+、CI-、NO3- B. K+、Na+、SO32-、S2-
C. K+、Na+、AIO2-、SO42- D. Ba2+、Fe2+、NO3-、Br-
经典习题
1、下列各组离子中,能在溶液中大量共存的是( )
A.H+、Ca2+、Cl-、OH- B.I-、ClO-、K+、H+
C.Na+、Fe3+、SO42-、OH- D.Na+、Cu2+、Cl-、SO42-
2、在透明的酸性溶液中,能大量共存的离子组是( )
A. Mg2+、CO32- 、HCO3 - 、NO3- B. Na+ 、CH3COO - 、HCO3 - 、Cl–
C.Fe3+ 、CO32- 、OH- 、SO4 2- D. NH4+ 、Cl–、Cu2+ 、SO4 2-
3、下列各组离子,在所给条件下能够大量共存的是( )
A.pH=0的溶液中: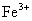 ,
,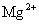 ,
,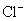 ,
,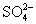
B.水电离出的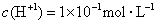 的溶液中:
的溶液中: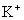 ,
,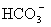 ,
,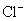 ,
,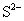
C.使pH试纸显深蓝色的溶液中: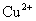 ,
,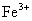 ,
,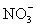 ,
,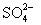
D.在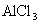 溶液中:
溶液中: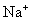 ,
,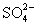 ,〔Al(OH)4〕-,
,〔Al(OH)4〕-,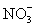
4、下列各组离子在水溶液中能大量共存并且溶液为无色透明的离子组是
A.K+、HCO3-、CO32-、Br- B.Cr3+、HCO3-、OH-、K+
C.Fe3+、Cu2+、NO3-、SO42- D.H+、Cl-、Na+、SO32-
5、下列澄清透明的溶液中,可能大量共存的离子组是( )
A.[Ag(NH3)2]+、K+、OH-、NO3- B.Fe3+、NH4+、Cl-、I-
C.H+、Al3+、SO42-、F- D.NH4+、Ca2+、Cl-、OH-
6、在某无色透明酸性溶液中,能共存的离子组是( )
(A)NH4+ NO3- Al3+ Cl- (B)Na+ AlO2- K+ NO3-
(C)MnO4- K+ SO42- Na+ (D)K+ SO42- HCO3- Na+
7、下列各组离子在溶液中能大量共存的一组是( )
A . PO43- K+ CO32- H2PO4- B Fe2+ Fe3+ NO3- Cl-
C Ca2+ Na+ NO3- OH- D NH4+ HCO3- Mg2+ Fe3+
8、常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C.pH=12的溶液:K+、Na+、CH3COO-、Br-
D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
9、在水溶液中能大量共存的一组是
A 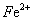
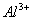
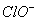
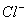 B
B 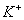
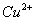
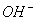
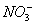
C 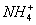
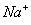
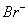
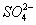 D
D 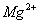
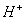
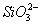
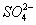
10、下列各种情况下,溶液中可能大量存在的离子组是
A.使pH试纸呈红色的溶液中:I-、Cl-、NO3-、Na+
B.澄清透明的无色溶液中:K+、Mg2+、NO3-、MnO4-
C.在c(H+)/c(OH-)=1×1013的溶液中:NH4+、Ca2+、C1-、K+
D.含有较多的Al3+的溶液中:K+、Ca2+、ClO-、Cl-
11、在下列指定条件下一定能大量共存的一组离子是( )
A 可使甲基橙溶液变黄的溶液中:S2- Na+ Cl- SO42-
B PH=7的溶液中: Fe3+ NH4+ NO3- Cl-
C 能和金属铝反应产生氢气的溶液中:Na+ Ba2+ SO42- NO3-
D PH=13的透明溶液中:NO3- MnO4- SO42- Na+
12、用pH大小表示溶液的酸碱性相对强弱有许多不足之处。因此,荷兰科学家HenkVan Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,酸度的计算公式表示为AG=lg [c(H+)/c(OH)]。常温下,在AG=1的溶液中能大量共存的离子是。
A.Ca2+、K+、Cl- 、NO3- B.NH4+、Fe3+、I一、SO42-
C.Na+ 、K+、ClO-、S2- D.Na+、S2O32-、AlO2—、K+
13、某溶液中可能含有Na+、NH4+、Ba2+、SO42-、I-、S2-。分别取样:①用pH计测试,溶液显弱酸性;②加氯水和淀粉无明显现象。为确定该溶液的组成,还需检验的离子是
A. Na+ B.SO42- C. Ba2+ D.NH4+
14、常温下,下列各组离子在指定溶液中能大量共存的是( )
A.PH=1的溶液中: Fe2+、Na+、SO42-、NO3-、
B.由水电离的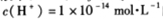 的溶液中:Ca2+、K+、Cl-、HCO3-、、
的溶液中:Ca2+、K+、Cl-、HCO3-、、
C.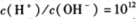 的溶液中: Al3+、 NO3-、NH4+4+、Cl-
的溶液中: Al3+、 NO3-、NH4+4+、Cl-
D.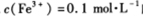 的溶液中: K+、ClO-、SO42-、SCN-
的溶液中: K+、ClO-、SO42-、SCN-
15、因发生氧化还原反应在水溶液中不能大量共存的离子组是 ( )
(A)Ca2+ Br- Fe3+ CO32- (B)Fe2+ Cl- NO3- SO42-
(C)Fe3+ S2- H+ NO3- (D)NO3- OH- Cl- Ba2+
16、下列离子组一定能大量共存的是( )
A.甲基橙呈黄色的溶液中:Na+、NO3-、I-、 Cl-
B.石蕊呈蓝色的溶液中:Na+、NO3-、AlO2-、HCO3-
C.含大量Al3+的溶液中:K+、Na+、NO3-、ClO-
D.含大量OH-的溶液中:CO32-、Cl- 、F-、K+
17、在由水电离出C(H+)=1×10-13 mol·L-1的溶液中,一定不能大量共存的离子组是( )
(A)Cl-— AlO2— Na+ K+ (B)Fe3+ NO3— MnO4— K+
(C)Fe2+ NO3— Ba2+ Cl— (D)CO3— Na+ Cl— K+
18、某溶液中水电离产生的C(H+)=1×10-13mol∕L,则溶液中一定可以大量共存的离子组是
A、NO3-、Na+、SO42-、Cl- B、K+、Na+、SO42-、S2O32-
C、Ca2+、NH4+、NO3-、Cl- D、Fe2+、Fe3+、NO3-、Cl-
19、在溶液中加入中量Na2O2后仍能大量共存的离子组是( )
A.NH4、Ba2+、Cl-、NO-3 B.K+、AlO-2、Cl-、SO2-4
C.Ca2+、Mg2+、NO-3、HCO-3 D. Na+、Cl-、CO2-3、SO2-3
20、在室温下,某无色透明溶液中由水电离出来的H+和OH-浓度的乘积为1×10-24,则此溶液中可能大量共存的离子组为
A.HCO3-、Al3+、Na+、SO42- B.I-、NO3-、K+、NH4+
C.Cu2+、Cl-、SO42- 、K+ D.SiO32-、SO32-、Na+、Cl-
21、下列各组离子能够大量共存的是 ( )
(A) Ca2+ HCO3- Cl- K+
(B) Al3+ AlO2— HCO3— Na+
(C) Fe2+ NH4+ SO42- S2-
(D) Fe3+ SCN— Na+ CO32-
22、下列各组离子能够大量共存的是 ( )
A. Ca2+、NH4+、SO42--、Cl- B . HCO3-、Mg2+、Na+、SO42-
C. H+、Cl—、ClO—、SO42— D.NH4+、C6H5O-、SiO32-、HCO3-
23、某溶液能使红色的石蕊试纸先变蓝色后褪色,则该溶液中可能大量共存的离子组是
A.K+、I—、AlO2—、MnO4— B.Na+、S2—、NO3—、SO42—
C.Al3+、NH4+、NO3—、F— D.K+、Cl—、ClO—、CO32—
24、下列各组溶液中的离子能大量共存,且向溶液中加入NaOH溶液时产生白色沉淀,加入盐酸时放出气体的一组是( )
(A) OH— Ba2+ NO3— K+ (B) Na+ SO42— Cu2+ Cl—
(C) HCO3— Cl— Na+ Ba2+ (D) Fe2+ Fe3+ Br— NO3—
25、将足量CO2通入下列各溶液中,所含离子还能大量共存的是
A.K+、SiO32-、Cl-、NO3- B.H+、NH4+、Al3+、SO42-
C.Na+、S2-、OH-、SO42- D.Na+、C6H5O-、CH3COO-、HCO3-
26、含有下列各组离子的溶液中,通入过量SO2气体后仍能大量共存的是
A.H+、Ca2+、Fe3+、N03- B.Ba2+、Cl-、Al3+、H+
C.Na+、NH4+、I-、HS- D.Na+、Ca2+、K+、Cl-
27、下列各组离子在溶液中能大量共存,且加入过量氨水后也不产生沉淀的( )
A.K+ Ba2+ NO3- SO42- B.H+ NH4+ Al3+ SO42-
C.Na+ AlO2- Cl- OH? D.H+ Cl- CH3COO- NO3-
28、向某溶液里加入过量的氨水或过量的氢氧化钠溶液,均有沉淀产生;若加入铁粉或铜粉,溶液的质量都增加,则该溶液里一定含有下列离子中的
A.Al3+ B.Fe2+ C.Fe3+ D.Cu2+
29、某溶液中可能含有I-、NH4+、Cu2+、SO32-,向该溶液中加入少量溴水,溶液仍为无色,则下列关于该溶液组成的判断正确的是
①肯定不含I- ②肯定不含Cu2+ ③肯定含SO32- ④可能含I-
A.①② B.①②③ C.①③ D.②③④
30、下列各组离子能大量共存于同一溶液中,并且加入过量NaOH溶液或少量稀硫酸时,都能产生白色沉淀的是( )
(A)Ba2+ Mg2+ NO3- CO32- (B)Na+ Al3+ Cl- Ag+;
(C)K+ Ba2+ Cl- HCO3-; (D)NH4+ Ba2+ Fe2+ Cl-;
31、在某种接近中性的含Na+的溶液中,可能还存在NH4+、Fe2+、Br-、CO32-、I-、SO32-6种离子中的几种。①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;②向呈橙黄色的溶液中滴加BaCL2时无沉淀生成;③橙黄色溶液不能使淀粉变蓝。则上述溶液中一定不存在的离子是
A、NH4+、Br-、CO32- B、NH4+、I-、SO32-
C、Fe2+、I-、SO32- D、Fe2+、Br-、CO32
32、下列各组离子以适当比例混合,可以形成碱性透明溶液的为( )
(A)Na+ Al3+ OH— SO42— (B)Na+ Al3+ SO42— Cl—
(C)Mg2+ Na+ AlO2— OH— (D)Ag+ NH4+ OH— NO3—
33、在某澄清、透明的浅黄色溶液中,可能含有下列八种离子:H+、NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、I-,在检验方案设计时初步分析其溶液中最多可含离子(不包括OH-)有( )
A.4种 B.5种 C.6种 D.7种
实验题
34.分别用一种试剂将下列物质中混入的少量杂质除去(括号内为混入的杂质)

35.一学生设计了如下实验方法分离NaCl和CaCl2两种固体混合物

填空和回答下列问题
(1)B物质是 (写化学式)
(2)按此实验方案分离得到的NaCl,经分析含有杂质,是因为上述方案中某一步设计有毛病,这一步的正确设计方案应是 。
(3)若要测定该样品中NaCl和CaCl2的质量比,可称量干燥的B物质和另一物质的质量,这种物质是 。
计算题
36.在某一混合溶液中,经检测含有Na+、Fe3+、Cl-三种离子,有Na+质量为46g,Cl-质量为177.5g,问Fe3+质量为多少g?
37.向一价金属的碘化物中逐滴滴加AgNO3溶液,直到沉淀完全为止,已知生成的硝酸盐溶液质量等于原碘化物溶液的质量,求原硝酸银溶液的质量分数?
38.现有一定质量露置于空气中的KOH样品,测得其含KOH为90%,K2CO3为8%,H2O为2%,现向里加100g质量分数为14.6%的盐酸溶液恰好完全反应,问把溶液蒸发干可得晶体多少g?
真题链接
1.下列离子或分子在溶液中能大量共存,通入CO2后仍能大量共存的一组是
A.K+、Na+、Cl—、NO3— B.K+、Na+、Br—、SiO32—
C.H+、Fe2+、SO42—、Cl2 D.K+、Ag+、NH3·H2O、NO3—
2.常温下,下列各组离子在制定溶液中一定能大量共存的是
A.0.1 mol·L-1的NaOH溶液:K+、Na+、SO42-、CO32-
B.0.1 mol·L-1的Na2CO3溶液:K+、Ba2+、NO3-、Cl-
C.0.1 mol·L-1FeCl3溶液:K+、NH4+、I-、SCN-
D.c(H+)/c(OH-)=1×1014的溶液:Ca2+、Na+、ClO-、NO3-
3.含有下列各组离子的溶液中,通入过量SO2气体后仍能大量共存的是【双】
A.H+、Ca2+、Fe3+、NO- B. Ba2+、Cl-、Al3+、H+
C. Na+、NH4+、I-、HS- D. Na+、Ca2+、K+、Cl-
4.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.甲基橙呈红色的溶液:NH4+、Ba2+、AlO2-、Cl-
C.pH=12的溶液:K+、Na+、CH3COO-、Br-
D.与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3-
5.室温下,下列各组离子在指定溶液中能大量共存的是
A.饱和氯水中 Cl-、NO3-、Na+、SO32-
B.c(H+)=1.0×10-13mol/L溶液中 C6H5O-、K+、SO42-、Br-
C.Na2S溶液中 SO42-、 K+、Cl-、Cu2+
D.pH=12的溶液中 NO3-、I-、Na+、Al3+
6.能在水溶液中大量共存的一组离子是
A. H+、I−、NO3−、SiO32-  B. Ag+、Fe3+、Cl−、SO42−
B. Ag+、Fe3+、Cl−、SO42−
C.K+、SO42-、Cu2+、NO3 D.NH4+、OH-、Cl-、HCO3-
7.将足量CO2通入下列各溶液中,所含离子还能大量共存的是
A.K+、SiO32-、Cl-、NO3- B.H+、NH4+、Al3+、SO42-
C.Na+、S2-、OH-、SO42- D.Na+、C6H5O-、CH3COO-、HCO3-
8.在pH=1的溶液中能大量共存的一组离子或分子是
A.Na+、Mg2+、ClO—、NO3— B.Al3+、NH4+、Br−、Cl−
C.K+、Cr2O72−、CH3CHO、SO42— D.Na+、K+、SiO32−、Cl—
9.(2010广东理综卷?7)能在溶液中大量共存的一组离子是
A.NH4+ 、Ag+、PO43−、Cl— B.Fe3+、H+、I−、HCO3—
C.K+、Na+、NO3−、MnO4— D.Al3+、Mg2+ 、SO42− 、CO32—
10.下列离子组一定 能大量共存的是
能大量共存的是
A.甲基橙呈黄色的溶液中:I−、Cl−、NO3−、Na+ B.石蕊呈蓝色的溶液中:Na+、AlO2−、NO3−、HCO3—
C.含大量Al3+的溶液中:K+、Na+、NO3−、ClO— D.含大量OH一的溶液中:CO32−、Cl−、F−、K+
11.常温下,下列各组离子在指定溶液中能大量共存的是
A.pH=1的溶液中W W W K S 5 U . C O M
:Fe2+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3-
C. =1012的溶液中:NH4+、Al3+、NO3-、Cl-
D.c(Fe3+)=0.1mol·L-1的溶液中:K+、ClO-、SO42-、SCN-
12.  在溶液中能大量共存的一组离子或分子是
在溶液中能大量共存的一组离子或分子是
 A.NH4+、H+、NO3-、HCO3-
A.NH4+、H+、NO3-、HCO3- B.K+ 、Al3+、SO42-、NH3·H2O
B.K+ 、Al3+、SO42-、NH3·H2O
 C.Na+、K+、SO32-、Cl2
C.Na+、K+、SO32-、Cl2 D.Na+ 、CH3COO−、CO32-、OH
D.Na+ 、CH3COO−、CO32-、OH
13.下列各组离子,在溶液中能大量共存、加入NaOH溶液后加热既有气体放出又有沉淀生成的一组是
A.Ba2+ 、NO3-、NH4+、Cl- B. Ca2+、HCO3-、NH4+、AlO2-
C.K+、Ba2+、Cl-、HSO3- D. Mg2+、NH4+、SO42-、K+
14.在下列各溶液中, 离子一定能大量共存的是
离子一定能大量共存的是
 A.强碱性溶液中:K+、Al3+、Cl-、SO42-
A.强碱性溶液中:K+、Al3+、Cl-、SO42-
 B.含有0.1 mol·L−1Fe3+的溶液中:K+、Mg2+、I-、NO3-
B.含有0.1 mol·L−1Fe3+的溶液中:K+、Mg2+、I-、NO3-
C. 含有0.1 mol·L−1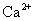 溶液在中:Na+、K+、CO32-、Cl-
溶液在中:Na+、K+、CO32-、Cl-
D. 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42-
-
高中化学必修一全部化学方程式及离子方程式总结
其实你还是自己总结一下比较好,自己总结最后记忆相当深刻的。全套无机方程式氯气、卤素2Na+Cl22NaClCu+Cl2CuCl22…
-
高中化学离子方程式总结
高中化学离子方程式总结.txt跌倒了,爬起来再哭~~~低调!才是最牛B的炫耀!!不吃饱哪有力气减肥啊?真不好意思,让您贱笑了。我能…
-
高中化学离子方程式总结
高中化学离子方程式总结高中化学离子方程式总结在离子反应中,反应物之间物质的量的相对大小有时候决定反应的实质、产物的种类和存在形式,…
-
高中化学全部离子方程式大全总结
高中全部化学离子方程式总结钠及其化合物*1、钠与水反应:2Na++2H2O=2Na++2OH–+H2↑2、钠与硫酸铜溶液:2Na+…
-
与量有关的离子方程式总结
与量有关的离子方程式的书写技巧a生成物与过量的反应物继续反应的情况例AlCl3与NaOH由少到多Al33OHAlOH3AlOH3O…
-
高中化学离子方程式总结
高中化学离子方程式总结高中化学离子方程式总结在离子反应中,反应物之间物质的量的相对大小有时候决定反应的实质、产物的种类和存在形式,…
-
高中化学离子方程式总结
高中化学离子方程式总结.txt跌倒了,爬起来再哭~~~低调!才是最牛B的炫耀!!不吃饱哪有力气减肥啊?真不好意思,让您贱笑了。我能…
-
高中化学必修一全部化学方程式及离子方程式总结
其实你还是自己总结一下比较好,自己总结最后记忆相当深刻的。全套无机方程式氯气、卤素2Na+Cl22NaClCu+Cl2CuCl22…
-
离子共存与离子反应方程式的书写判断规律总结
离子共存与离子反应方程式的书写判断(09)12.下列离子方程式正确的是A.向盐酸中滴加氨水:H++OH-=H2OB.Fe(OH)3…
-
离子共存判断规律总结
1、因发生复分解反应而不能大量共存:(1)H?与OH(2)OH——、弱酸的酸式酸根离子不能大量共存;、NH?4与H?金属活动性顺序…