人教版高中化学必修1实验总结练习
例1 实验室中,不小心将酒精灯碰倒在桌面上燃烧起来,合理而又简单的灭火方法是( )
A.用水冲灭 B.用泡沫灭火器扑灭 C.用嘴吹灭 D.用湿抹布盖灭
例2 下列实验操作不正确的是( )
A.从试剂瓶中取出的药品,若有剩余一般不能再放回原试剂瓶
B.从盛有液溴的试剂瓶中取用溴时不应倾倒,而应将一洁净的长胶头滴管伸到瓶底部来吸取
C.用同一药匙不可取用不同的固体试剂,而应洗净擦干后再取用
D.取用液体试剂时不能直接倾倒,而应用胶头滴管来吸取
F.配制稀硫酸时,可先在量筒中加一定体积的水,再在搅拌下慢慢加入浓硫酸
1.下列实验的操作或实验仪器的使用,能达到实验目的的是( )
A.用10 mL的量筒量取6.12 mL的水 B.用托盘天平称取2.1 5g氯化钠
C.用浓H2SO4干燥Cl2时,气体在洗气瓶中短管进长管出D.用滴管取约1 mL溶液
2.下列实验中,不应该接触管口或瓶口的操作是( )
A.用胶头滴管向试管中加试剂 B.向试管里倾倒液体药品
C.将试剂瓶中的液体倒入量筒中量取 D.将浓H2SO4倒入盛水的烧杯中
3.下列说法正确的是( )
A.化学实验产生的废液应及时倒入下水道 B.实验室的废酸或废碱可用中和法来处理
C.实验剩的钾、钠等金属即时扔进废液缸D.酸洒在实验桌上,立即用氢氧化钠溶液中和
4.下列事故处理方法正确的是( )
A.汽油失火时,立即用水灭火 B.电线短路失火时,立即用泡沫灭火器灭火
C.浓NaOH溶液溅到皮肤上,立即用水冲洗,然后涂上硼酸溶液
D.浓硫酸溅到皮肤上,立即用稀NaOH溶液洗涤。
5.下列实验操作与安全事故处理错误的是( )
A.使用温度计时不慎打破水银球,立即将残破的温度计插入装有硫粉的广口瓶中,尽可能收集散落的水银装入小瓶并水封,残留的水银覆盖上硫粉
B.用试管夹从试管底由下往上夹住距试管口约处
C.稀释浓硫酸时,可先在量筒中加入一定量的水,再边搅拌边慢慢加入浓硫酸
D.把玻璃管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻璃管插入端,缓慢旋进塞孔中
1.下列实验中有关说法正确的是( )
A.用过滤法将硫酸钠溶液与氯化钡溶液混合后生成的硫酸钡分离出来
B.用蒸发的方法可以除去酒精中的水分
C.用过滤的方法可以除去NaOH溶液中的Ba(OH)2
D.用蒸发的方法从含有少量氯化钠的硝酸钾样品中得到硝酸钾晶体
2.下列物质分离和提纯方法属于化学分离提纯法的是( )
A.分离沙子和食盐水溶液 B.将O2和CO2混合气体通入到NaOH溶液中除去CO2
C.分离溶于水中的氯化钠 D。从氯化钠和硝酸钾的混合物中提纯硝酸钾气体
3.下列各除杂质方法中正确的是( )
A.用浓H2SO4除去CO2中的水蒸气 B.用点燃的方法除去CO2中混有的少量CO
C.通过赤热的CuO,以除去O2中的H2 D.以蒸发溶剂的方法,除去酒精溶液中少量的水分
4.欲使CuSO4·5H2O和沙子(主要成分SiO2)的混合物分开,其必要的实验操作为( )
A.溶解 过滤 蒸发结晶 B.加热 溶解 过滤 C.溶解 过滤 蒸馏 D.溶解 过滤 分液
5.从海水中提取粗盐的主要操作是( )
A.过滤 B.结晶 C.蒸发结晶 D.分液
6.过滤和蒸发都用到的仪器是( )
A.漏斗 B.蒸发皿 C.铁架台 D.玻璃棒
7.除去白砂糖中少量的沙子,应采取的操作步骤其中正确的是( )
A.溶解→结晶 B.溶解→过滤→蒸发结晶
C.溶解→过滤 D.加入适当的试剂,将沙子溶解
8.粗盐的提纯,常常加入一些化学试剂,使一些可溶性的杂质沉淀下来,过滤而除去,同时采用必要的操作,下列操作顺序正确的是( )
①加BaCl2 ②加NaOH ③加Na2CO3 ④加稀盐酸 ⑤过滤
A.①②③④⑤ B.⑤④③②①
C.①②③⑤④ D.③①②⑤④
1、做焰色反应实验时所用的铂丝,每次用完后都要 ( )
A.用滤纸擦干净后才能使用
B.用水多洗几次
C.用稀盐酸洗涤后,再灼烧到无颜色时为止
D.先用稀盐酸洗涤,后用水洗涤
2、下列装置所示的实验中,能达到实验目的的是 ( )

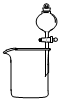

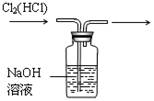

3、容量瓶上需标有:①温度 ②浓度 ③容量 ④压强 ⑤刻度线 ⑥酸式或碱式六项中的 ( )
( )
A、①③⑤ B、③⑤⑥ C、①②④ D、②④⑥
4、过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4 等杂质,通过如下几个实验步骤
可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入
过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤正确的操作顺序是( )
A.③②①⑤④ B.①②③⑤④ C.②③①④⑤ D.③⑤②①④
5、现有三组溶液:①含有水份的植物油中除去水份 ②回收碘的CCl4溶液中的CCl4 ③用食用酒精浸泡中草药提取其中的有效成份。分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
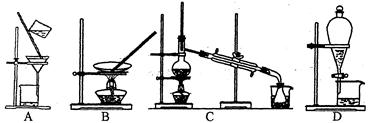
6、下列实验操作或仪器的使用图示中正确的是 ( )

7、实验室欲用NaOH固体配制1.0 mol·L-1的NaOH溶液240 mL。
(1)配制溶液时,一般可以分为以下几个步骤:
①称量 ②计算 ③溶解 ④倒转摇匀 ⑤转移 ⑥洗涤 ⑦定容 ⑧冷却。
其正确的操作顺序为_______________ _.本实验必须用到的仪器有天平、药匙、玻璃棒、烧杯、胶头滴管、还有____ ____.
(2)使用容量瓶前必须进行的一步操作是________ .
(3)在配制过程中,其他操作都是正确的,下列操作会引起浓度偏高的是________ .
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
⑥定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线
8、海带含有丰富的碘,为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:

请填写下列空白:
(1)步骤⑤的实验操作名称是 。
(2)步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤应选择的实验装置是 。
9、在新制的氯水参加的反应中,有如下几种情况:
(1)向FeCl2和KSCN的混合溶液中加入氯水,现象是 ,氯水中起作用的主要微粒是 ,反应的离子方程式是 。
(2)向AgNO3溶液中加入氯水,现象是 ,氯水中起作用的主要微粒是 ,反应的离子方程式是 。
(3)向氯水中滴加石蕊试液,溶液变红,起作用的微粒是 ,然后又褪色,起作用的微粒是 。
10、实验室通常用如右图所示的装置来制取氨气。回答下列问题:
 (1)制取氨气时反应的化学方程式为:
(1)制取氨气时反应的化学方程式为:
。
(2)收集氨气时必须使用干燥的集气装置的原因是 。
(3)下列操作不能用于检验NH3的是( )
A.气体使湿润的酚酞试纸变红
B.气体能使湿润的红色石蕊试纸变蓝
C.气体与蘸有浓H2SO4的玻璃棒靠近
D.气体与蘸有浓盐酸的玻璃棒靠近
11、某学生设计的用浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图:

(1)写出甲中发生反应的离子方程式:
(2)乙中盛的试剂是 ;作用是 。
丙中盛的试剂是 。
(3)若将制得的少量氯气通入无色的饱和碘化钾溶液中,溶液变 色,其离子方程式是 ,向所得溶液中加入四氯化碳,振荡后静置,则溶液分为两层,下层是显 色,是 ,这种操作叫做 。
除氨气外,还可以用该装置制取的常见气体是 。
1、 (24分)把18.0 mol/L的浓硫酸稀释成2.00 mol/L的稀硫酸100 ml,实验操作如下。
(1)请把正确操作步骤(用1、2、3……表示)的序号填入括号内,并回答有关问题。
( )将配好的稀硫酸倒入试剂瓶中,贴好标签
( )盖好容量瓶塞,反复颠倒,摇匀
( )用量筒量取_______ml的18.0 mol/L的浓硫酸
( )将_______沿烧杯内壁慢慢注入盛有少量_______的烧杯中
( )用少量蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液也全部转移到容量瓶中
( )将已冷却至室温的硫酸溶液沿玻璃棒注入_______ml的容量瓶中
( )改用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度线相切
( )继续向容量瓶中加蒸馏水,直到液面接近刻度线_______cm处
(2)下列操作对所配溶液浓度造成的后果,请用“偏高”“偏低”或“无影响”表示:
①未洗涤稀释过浓硫酸的小烧杯_______;
②使用经蒸馏水洗涤后未干燥的小烧杯稀释浓硫酸_______;
③加水时不慎超过了刻度线,又将超出部分用吸管吸出_______;
④配溶液用的容量瓶用蒸馏水洗涤后未经干燥_______;
⑤定容时俯视刻度_______;
⑥倒转容量瓶摇匀后,液面降至刻度线下,再加水至刻度。_______
2、除去下列主体物质中的杂质,请选用合适的试剂,写出主要反应的离子方程式。
(1)除去硫酸钠溶液中的少量碳酸钠:试剂________;离子方程式___________________。
(2)除去HNO3溶液中的少量HCl:试剂________;离子方程式________________________。
(3)除去CuCl2溶液中的少量CuSO4:试剂________;离子方程式________________________。
 (4)Fe2+(Cu2+),:试剂 ,离子方程式
(4)Fe2+(Cu2+),:试剂 ,离子方程式
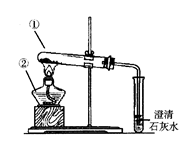
3、(7分)某实验小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,设计实验如下图所示。
(1)写出仪器的名称:①______________;②______________。
(2)两个实验依据的反应的化学方程式都为
①________________________________;
②___________________________________。
(3)实验Ⅰ、Ⅱ均能鉴别这两种物质,与实验Ⅰ相比,实验Ⅱ最主要的优点是(填选项序号)______。
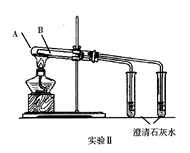 A.实验Ⅱ比Ⅰ复杂 B.实验Ⅱ比Ⅰ安全
A.实验Ⅱ比Ⅰ复杂 B.实验Ⅱ比Ⅰ安全
C.实验Ⅱ比Ⅰ操作简便
D.实验Ⅱ可以做到用一套装置同时进行两个对比实验,而Ⅰ不行
(4)若用实验Ⅱ验证碳酸钠和碳酸氢钠的稳定性,则试管A中装入的固体最好是__________________。
 (5)氢氧化钙微溶于水,实验室制备饱和澄清石灰水的方法是将氢氧化钙悬浊液静置后取上层清液。若想快速从氢氧化钙悬浊液得到饱和澄清石灰水的方法为____________________。
(5)氢氧化钙微溶于水,实验室制备饱和澄清石灰水的方法是将氢氧化钙悬浊液静置后取上层清液。若想快速从氢氧化钙悬浊液得到饱和澄清石灰水的方法为____________________。
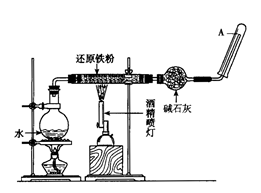
4、(10分)在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气反应的实验”。请回答该实验中的问题。
(1)写出该反应的化学方程式___________________。
(2)实验前必须对整套装置进行的操作是_________。
(3)碱石灰的作用是___________________________。
(4)如果要在A处玻璃管口处点燃生成的气体,则必须对该气体进行_____________,检验这一操作的目的是______________________________。
5、下图是实验室制取SO2并验证SO2某些性质的装置图。试回答:
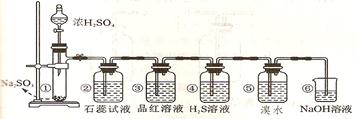
①中发生反应的化学方程式为 。
②中的实验现象为 ,此实验说明SO2是 氧化物。
③的品红溶液 ,证明SO2有 。
④中的实验现象为 ,此实验说明SO2有 性。
⑤中的实验现象为 ,此实验说明SO2有 性。
⑥的作用是 ,反应方程式是 。
6、氨气与灼热的氧化铜反应生成铜、氮气和水。利用下图所示实验装置可测定氨分子的组成(图中夹持、固定装置均略去。回答下列问题)。
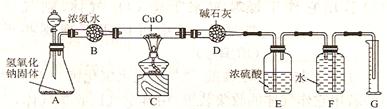
(1)写出氨气与氧化铜反应的化学方程式 。
(2)在A的锥形瓶中放入氢氧化钠固体的目的是 。
(3)在干燥管B里不能选用的干燥剂是(填序号) 。
①碱石灰 ②生石灰 ③五氧化二磷 ④氢氧化钠
(4)在C的玻璃中观察到的现象是 。
(5)E装置中盛有浓硫酸的目的是 。
 7、实验室中所用少量氯气是用下列方法制取的, 4HCl(浓)+MnO2
7、实验室中所用少量氯气是用下列方法制取的, 4HCl(浓)+MnO2 Cl2↑+MnCl2+2H2O
Cl2↑+MnCl2+2H2O
试回答下列问题:
(1)该反应是氧化还原反应吗? ,如果是氧化还原反应,请指出 是氧化剂, 是还原剂,写出该反应的离子方程式 。
(2)集气瓶A中盛装的是饱和食盐水(注:氯气在饱和食盐水中溶解度很小,而氯化氢在饱和食盐水中的溶解度则很大),其作用是 。
(3)氯气溶入水显酸性,且氯气有毒,并有剧烈的刺激性,若吸入大量氯气,可中毒死亡,所以氯气尾气直接排入大气中,会污染环境。实验室中可采用 溶液来吸收有毒的氯气。
8、请用下列四个装置连接成一套连续装置,试验湿润的有色布条在氯气中能褪色,而干燥的有色布条在氯气中不能褪色。氯气从连续实验装置的左边玻璃导管口导入,并依次通过各装置。
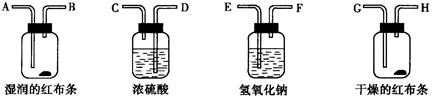
就此实验,完成下列填空:
(1)连接上述装置的正确顺序是(填字母)
氯气→( )( )接( )( )接( )( )接( )( )
(2)这个实验中,湿润的红布条褪色,而干燥的红布条未褪色,可见漂白的物质是______。
(3)在你设计的这一套实验装置中,最后一个实验装置的作用是__________________,发生反应的化学方程式是_____________________________________。
9、为了验证木炭可被浓H2SO4氧化成CO2,选用下图所示仪器(内含物质)组装成实验装置:
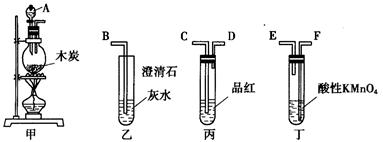
(1)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母):
接______,______接______,______接______;
(2)仪器乙、丙应有怎样的实验现象才表明已检验出CO2?乙中_________,丙中______________;
(3)丁中酸性KMnO4溶液的作用是_____________________________;
(4)写出甲中反应的化学方程式_________________________________。
10、解释钠投入滴有酚酞试液的水中,产生下列现象的原因:
(1)钠浮在水面上 ;(2)钠熔化成闪亮的小球 ;
(3)钠小球在水面四处游动,并发出“嘶嘶”声 ;
(4)滴有酚酞试液的水变红 ;
(5)钠与水反应的离子方程式为 。
-
高中化学人教版必修一第二、三章实验总结
化学必修一实验总结化学物质及其变化物质的分类科学探究操作方法:取三个小烧杯,分别加入二十五毫升蒸馏水、二十五毫升硫酸铜溶液和二十五…
-
人教版高中化学必修1实验总结练习
实验练习题例1实验室中不小心将酒精灯碰倒在桌面上燃烧起来合理而又简单的灭火方法是A用水冲灭B用泡沫灭火器扑灭C用嘴吹灭D用湿抹布盖…
-
必修一二化学实验步骤总结
必修一二化学实验整理作者高一三班组季荣1112粗盐的提纯实验步骤1粗盐溶解称取约4g粗盐加约12mL水2过滤制作一个过滤器组装过滤…
-
高中化学人教版必修一第一章实验总结
化学必修一实验总结第一章从实验学化学化学实验基本方法实验1-1粗盐提纯原理:运用过滤、蒸发的方法提纯粗盐。操作方法:称取适量粗盐溶…
-
高中化学必修一实验超细总结
高中化学必修一实验超细总结1镁条在空气中燃烧发出耀眼强光放出大量的热生成白烟同时生成一种白色物质2木炭在氧气中燃烧发出白光放出热量…
-
高一化学必修一实验总结
高一化学必修一实验总结1.镁条在空气中燃烧:发出耀眼强光,放出大量的热,生成白烟同时生成一种白色物质。2.木炭在氧气中燃烧:发出白…
-
高中化学人教版必修一第二、三章实验总结
化学必修一实验总结化学物质及其变化物质的分类科学探究操作方法:取三个小烧杯,分别加入二十五毫升蒸馏水、二十五毫升硫酸铜溶液和二十五…
-
高中化学人教版必修一第一章实验总结
化学必修一实验总结第一章从实验学化学化学实验基本方法实验1-1粗盐提纯原理:运用过滤、蒸发的方法提纯粗盐。操作方法:称取适量粗盐溶…
-
高一化学必修一知识点总结
必修1内容梳理从实验学化学一、化学实验安全1、(1)做有毒气体的实验时,应在通风橱中进行,并注意对尾气进行适当处理(等)。进行易燃…
-
高中化学必修一知识点总结
必修1全册基本内容梳理从实验学化学一化学实验安全11做有毒气体的实验时应在通风厨中进行并注意对尾气进行适当处理吸收或点燃等进行易燃…
-
高中化学人教版必修一第四章实验总结
化学必修一实验总结第四章非金属及其化合物第一节无机非金属材料的主角——硅实验4-1操作方法:在试管中加入少量硅酸钠溶液,滴入少量酚…