化学平衡知识点总结
化学反应限度知识点总结:
一、化学平衡状态的特征:
1、逆——可逆反应 (研究对象)
2、等—— v正=v逆≠0(本质)
3、动—— 平衡时正逆反应均未停止(动态平衡)
4、定—— 平衡时各组分含量不变(结果)
5、变—— 外界条件改变时,平衡可能发生移动 (平衡移动)
二、可逆反应达到化学平衡状态的标志:
1、绝对标志:
(1)v正=v逆
①对于同一种物质而言,该物质的生成速率=它的消耗速率
②对不同物质而言,反应速率之比等于计量系数之比,但必须是不同方向的反应速率。(同边异向,异边同向)
(2)反应混合物中各组分的含量保持不变
①各组分的浓度不随时间的改变而改变。
②各组分的质量分数、物质的量分数、体积分数不随时间的改变而改变。
③各组分的质量、物质的量、气体体积不随时间的改变而改变。
(3)反应物的转化率、产物的产率保持不变。
(4)绝热体系中温度保持不变。
(5)对于有色物质参与的反应,体系的颜色保持不变。
(6)若反应物或生成物中有非气态(固体或液体),则气体的平均相对分子质量、密度不变的状态为化学平衡状态。
2、可能标志:以反应m A(g)+n B(g)=p C(g)为例:


3、不可能标志:
任何有关质量、物质的量、物质的量浓度、体积、反应速率等的比例关系都不能作为达到平衡的判断依据。
第二篇:化学反应速率化学平衡知识点总结
第二章 化学反应速率化学平衡知识点总结
要点一 化学反应速率大小的比较 (一)化学反应速率 1.表示方法
通常用单位时间内反应物浓度的_______________或生成物浓度的 _______________来表示。 2.数学表达式:,单位为
对于Δc(反应物)=c(初)-c(末), 对于Δc(生成物)=c(末)-c(初)。Δt表示反应所需时间,单位为 等。
3.单位 一般为_______________或_____________或______________ 。
4、对某一具体的化学反应来说,用不同物质 的浓度变化来表示化学反应速率时,数值往往不同,其数值之比等于 。 (二)根据化学方程式对化学反应速率的计算 求解化学反应速率的计算题一般按以下步骤: ①写出有关反应的化学方程式;
②找出各物质的起始量、转化量、某时刻量; ③根据已知条件列方程式计算。
例如:反应 mA + nB pC
起始浓度 (mol/L) a b c
转化浓度(mol/L) x 某时刻浓度(mol/L) a-x 要点二 化学反应速率大小的比较
(1)同一化学反应速率用不同物质表示时数值,但比较反应速率的快慢不能只看数值的大小,而要通过转化换算成同一物质表示,再比较数值的大小。
(2)比较化学反应速率与化学计量数的比值,如aA+bB==pY+qZ ,即
v(A)v(B)v
(A)v(B)
比较 a 与 b 若 a? b, 则A表示的反应速率比B大。 (3)注意反应速率单位的一致性。
(4)注意外界条件对化学反应速率的影响规律。 在反应A+3B
2C+2D中,若某条 件下v(A)=0.15 mol/ (L·min) , 则此时用v(B)表示该反应的
化学反应速率为v(B)= _________ ;若起始条件下,物质C的物质的量为0,经过5秒后,C的物质的量浓度为0.45 mol/L,则用v(C)表示该反应的化学反应速率为 _________ 。 (三) 化学反应速率的测定
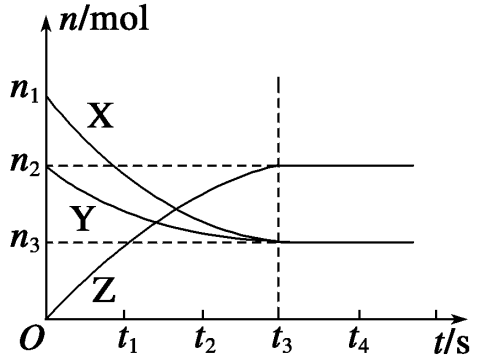
按图安装两套装置,通过分液漏斗分别加入40 mL 1 mol/L和 40 mL 4 mol/L的硫酸,比较二者收集10 mL H2所用的时间。 实验现象:两套装置中加入H2SO4溶液后都立即产生气泡,但加入1 mol/L硫酸的装置中产生气泡的速率较_________,收集10 mL H2用的时间较_________ ;加入4 mol/L硫酸的装置中产生气泡的速率较_________ ,收集10 mL H2用的时间较 _________ 。 四. 化学反应速率图象及其应用
物质的量(或浓度)—时间图象及其应用
例如:某温度时,在定容(V L)容器中,X、Y、 三种物质的物质的量随时间的变化曲线如图所示。 根据图象可进行如下计算:
(1)某物质的反应速率、转化率, 如:V(X)=( n1- n3) /vt3 mol/(L·s), Y的转化率= (n2-n3)/n2 ×100%。 (2)确定化学方程式中的化学计量数之比
如X、Y、Z三种物质的化学计量数之比为(n1-n3)∶(n2-n3)∶n2。
①、在同一反应体系中用不同物质来表示反应速率时,其 是可以 的,但是这些数值都表示 。表示化学反应速率时,必须指明以 表示。 ②化学反应速率实际是 的平均速率,而不是 速率。
因为大部分反应不等速进行,随着各组分浓度的变化,反应速率也会变。开始时,速率快,随着反应的进行速率会减慢。所以我们在表示反应速率使用的是平均速度,我们定义也是平均速率。 ③不能用 体和 体来表示反应速率。
在一定温度下,固体和纯液体物质单位体积里的物质的量保持不变,即物质的量浓度为常数,因此它们的化学反应速率也被视为常数,所以不能用它们表示速率。但固态反应物的颗粒大小是影响反应速率的条件之一,即颗粒越小,表面积越大,反应速率越快 ④化学反应速率用 值表示。
⑤对于同一化学反应,用 表示 时,其 比一定 化学方程式中相应的 。例如:N2+3H2=2NH3中, υ(N2):υ(H2):υ(NH3)= 要点三 有效碰撞理论
(1)有效碰撞:能够发生的碰撞。
(2)能够发生有效碰撞的分子,必须具备:①;②。有效碰撞是发生化学反应的充分条件。
(3)活化分子:能够发生的分子。但活化分子的每一次碰撞,不一定都是有效碰撞,即发生化学反应。
(4)活化能:
【重点】化学反应的快慢本质上是由单位体积内的活化分子数...........
决定的,单位体积内活化分子数越多,则化学反应速率越快,反之则慢。
注:在其他条件具备时,若一反应较难进行,则其主要原因可能是:①参加反应的分子的能量普遍较低;②单位时间内反应物中活化分子有效碰撞次数少;③反应物分子中活化分子百分数较小。

一、浓度对化学反应速率的影响:
观察实验2-2,得出浓度对化学反应速率是如何影响的?并用有效碰撞模型解释? 结论:当其它条件不变时,增加反应物的浓度,可以 反应的速率。
解释:在其他条件不变时,增加反应物的浓度,活化分子百分数 ,单位体积内活化分子的数量 ,有效碰撞的频率 ,导致反应速率增大。 注意:
1.一个反应的速率主要取决于 的浓度,与 的浓度关系不大....(填反应物或产物) 2.对于可逆反应,增大反应物浓度,正反应速率 ,逆反应速率瞬时 ,随着反应是进行,正反应速率 、逆反应速率 。
3.固体和纯液体的浓度是一个常数,所以增加这些物质的量,不会影响反应的速率。 【图】1、浓度与反应速率的关系图:

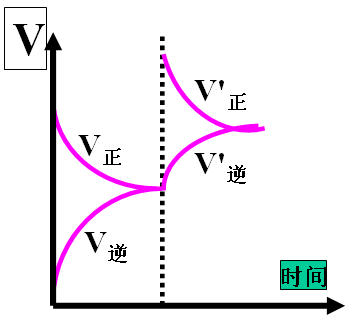
2、对于可逆反应,当加入反应物时,速率变化图如上右: 二、压强对化学反应速率的影响 思考并回答下列问题:
1、一定温度下,一定质量气体的体积与其所受的压强有何关系?
2、对于有气体参加的反应来说,当温度一定时,增大体系的压强(减少容器体积),相当于 反应物的浓度,反应速率会 ;减小体系压强(增大容器体积),相当于 反应物的浓度,反应速率会 。
注意:对于气体反应体系,有以下几种情况: ①恒温时:
增加压强―引起―→体积缩小―引起―→浓度增大―引起
―→反应速率加快。 ②恒温恒容时:
①充入气体反应物(按反应开始物料之比,即投料比)―引起―→浓度增大―引起―→压强增大―引起―→速率加快(对于可逆反应,正反应速率 ,逆反应速率瞬间 ,随着反应的进行,正反应速率 ,逆反应速率 )
②充入“惰气”―引起―→压强增大,但各物质的浓度不变,反应速率不变。 ③恒温恒压时:
充入:“惰气”―引起―→体积增大―引起―→各反应物浓度减少―引起―→反应速率减慢。 【总结】
1、对于有气体参加的反应而言,改变压强,对化学反应速率产生影响的根本原因是引起浓度改变所致。
2、压强在改变化学反应速率时,对于可逆反应,V(正)和V(逆)变化的倍数不一定...
相等。 三、温度对化学反应速率的影响
观察实验2-3,得出温度对化学反应速率是如何影响的?并用有效碰撞模型解释?
结论:当其它条件不变时,升高温度,反应的速率 ,降低温度,反应的速率 。 强调:这里的反应,包括吸热反应、放热反应、正反应和逆反应。
解释:升高温度,活化分子百分数 ,有效碰撞的频率 ,导致反应速率增大。 【总结】
1、对于可逆反应,温度导致V(正)和V(逆)变化的倍数肯定..不相等。 2、一般地,温度每升高10℃,化学反应速率变成原来的2~4倍。 【图】温度与反应速率的关系。 四、催化剂对化学反应速率的影响
观察实验2-4,得出催化剂对化学反应速率是如何影响的?并用有效碰撞模型解释? 结论:当其它条件不变时,使用应催化剂,反应的速率 。
催化剂的定义:在化学反应里能改变(加快或减慢)其他物质的化学反应速率,而本身的质量和化学性质在反应前后(反应过程中会改变)都没有发生变化的物质叫做催化剂,又叫触媒。 解释:当温度和反应物浓度一定时,使用催化剂可使反应途径发生改变,从而 了反应的活化能,使得活化分子的百分数 ,因此活化分子的数目 ,有效碰撞频率 ,故化学反应速
率加大。 【注意】:
1.催化剂改变化学反应速率的原因仅仅是改变始态到终态的途径,不改变反应的结果,催化剂在反应前后质量不变。例:
(1)在加热条件下: 2Cu + O2 == 2CuO
2CuO +2 CH3CH2OH == 2Cu +2 CH3CHO + 2H2O (2)氮的氧化物破坏臭氧: NO + O3 == NO2 + O2 NO2 + O ==NO + O2
2.能加快反应速率的催化剂叫 ;能减慢化学反应速率的催化剂叫 。 3.对可逆反应而言,正催化剂使正、逆反应速率都加快,且加快的程度 。相反,负催化剂使正、逆反应速率都减小,且减小的程度 。
4.不同的反应需不同的催化剂;催化剂在一定的温度范围内活性最大;催化剂遇有害物质会“中毒”。 5. 对于可逆反应,使用催化剂,V(正)和V(逆)变化的倍数一定..
相等。 【小结】外界条件对化学反应速率的影响程度:催化剂>温度>浓度=压强。即:催化剂对反应速率的影响程度最大,其次是温度,最后是浓度和压强。
图像题是本节常见的考点,解答图象题,首先要看懂图(特别是纵坐标和横坐标的意 义),然后依据化学反应速率的变化规律,进行综合分析推理判断。 分析时一般从以下几方面入手: ① 看清各坐标轴所代表的意义(速率-时间、转化率-时间等); ② 看清曲线的变化趋势(增大、减小、不变、先增大后减小等)。 ③ 看清曲线上点的意义(起点、终点、交点、极值点、转折点等)。
-
化学反应速率与化学平衡知识点归纳
1.化学反应速率:⑴.化学反应速率的概念及表示方法:通过计算式:v=Δc/Δt来理解其概念:①化学反应速率与反应消耗的时间(Δt)…
-
化学平衡知识点总结
化学平衡一化学平衡1可逆反应定义在同一条件下既能向正反应方向进行同时又能向逆反应方向进行的反应叫做可逆反应用代替可逆反应中所谓的正…
-
高中化学《化学平衡》知识点总结 新人教版选修4
安徽省安庆市第九中学高二化学化学平衡知识点总结新人教版选修4一1定义化学平衡状态一定条件下当一个可逆反应进行到正逆反应速率相等时更…
-
化学平衡知识点总结学案
选修四第二章知识总结927帆的自豪是能在风浪中挺起胸膛要点一化学反应速率大小的比较一化学反应速率1表示方法通常用单位时间内反应物浓…
-
化学反应速率、化学平衡知识点总结用
化学反应速率化学平衡知识点总结化学反应速率和平化学衡命题规律化学反应速率和化学平衡是高考的必考内容其主要命题内容有化学反应速率影响…
-
高一化学下册知识点总结
高一化学必修二知识点总结一、元素周期表★熟记等式:原子序数=核电荷数=质子数=核外电子数1、元素周期表的编排原则:①按照原子序数递…
-
化学反应速率与化学平衡知识点归纳
1.化学反应速率:⑴.化学反应速率的概念及表示方法:通过计算式:v=Δc/Δt来理解其概念:①化学反应速率与反应消耗的时间(Δt)…
-
沪科版_高一化学下学期知识点总结
高一下学期化学期末复习要点一硫氮单质及化合物一硫单质S黑火药的使用S2KNO33CK2S3CO2N21硫的物理性质硫是淡黄色晶体脆…
-
高二化学上期知识点_总结
第一章氮族元素一氮族元素N氮P磷As砷Sb锑Bi铋二氮气N21分子结构电子式结构式NN分子里NN键很牢固结构很稳定2物理性质无色无…
-
高二化学上期知识点_总结
第一章氮族元素一氮族元素N氮P磷As砷Sb锑Bi铋20xx010919xx39701444二氮气N21分子结构电子式结构式NN分子…
-
高中化学平衡归纳总结
高中化学平衡的归纳总结化学反应速率与化学平衡一、高考展望:化学反应速率和化学平衡理论的初步知识是中学化学的重要基本理论。从历年高考…