化学平衡知识点总结(1)
化学平衡基础知识
一、化学反应速率
1、概念:化学反应速率通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。
化学反应速率可以用单位时间内化学反应特有的现象(如生成沉淀、气体、颜色变化等)出现的快慢来定性表示。
2、数学表达式:v=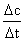 (其中Δc表示某物质浓度的变化量(为正值),若是反应物,表示其浓度的减少(取正值),若是生成物,表示其浓度的增加。常用单位:mol·L-1。Δt为时间的变化。常用单位:s、min、h。
(其中Δc表示某物质浓度的变化量(为正值),若是反应物,表示其浓度的减少(取正值),若是生成物,表示其浓度的增加。常用单位:mol·L-1。Δt为时间的变化。常用单位:s、min、h。
3常用单位:化学反应速率的常用单位是:mol·(L·s)-1、mol·(L·min)-1等。
4、注意事项
⑴化学反应速率是平均速率,而不是瞬时速率。
⑵对于同一化学反应,用不同物质来表示化学反应速率时,数值可能不相同。但这些不同的数值表示的都是同一反应速率。因此,表示化学反应速率时,必须指明用哪种物质表示,在v的后面将该物质的化学式用小括号括起来。
⑶在化学反应中,用不同物质表示的化学反应速率比等于各物质化学计量数比,等于变化的物质的量比或物质的量浓度比。即:对于反应mA+nB=pC+qD 有vA∶vB∶vC∶vD=m∶n∶p∶q
⑷一般不用纯液体或固体来表示化学反应速率
二、影响化学反应速率大小的因素
1、内因:反应物的性质是决定化学反应速率大小的主要因素。如在常温下,K、Na可以与水剧烈反应(反应速率大),而Mg与水反应缓慢。可见它们的反应速率的快慢是由K、Na、Mg的化学性质决定。
2、外因:对于同一个化学反应,当外界条件(如浓度、压强、温度、催化剂等)改变时,化学反应速率会随之变化。
⑴浓度对化学反应速率的影响
结论:当其它条件不变时,增大反应物的浓度,可以加快化学反应速率;减小反应物浓度,可以减慢化学反应速率。
注意:①对于固体物质或纯液体,一般认为其“浓度”为常数,它们的量的改变不会影响化学反应速率。
②固体之间的反应,化学反应速率往往反应物的颗粒大小有关。固体颗粒越小,其单位体积的表面积增大,反应物之间的接触面积增大(将固体粉碎),或增大扩散速率,(对反应物进行搅拌),都能加快化学反应速率。
⑵压强对化学反应速率的影响
结论:当其它条件不变时,对于有气体参加的化学反应,增大压强,化学反应速率加快;减小压强,化学反应速率减慢。
注意:①改变气体的压强,实际上是改变气体物质的量浓度,从而改变化学反应速率。因此在解决有关反应速率问题时,应转换思维,将压强变化转化成浓度的变化来考虑。对于气体反应体系,有以下几种情况:
a恒温时:增加压强 体积缩小
体积缩小 浓度增大
浓度增大 反应速率加快。
反应速率加快。
B恒容时:Ⅰ充入气体反应物 浓度增大
浓度增大 反应速率加快
反应速率加快
Ⅱ充入“惰性气体” 总压强增大,但各物质浓度不变,反应速率不变。(“惰性气体”是指与该反应无关的性质稳定的气体,并不是专指稀有气体)。
总压强增大,但各物质浓度不变,反应速率不变。(“惰性气体”是指与该反应无关的性质稳定的气体,并不是专指稀有气体)。
②压强的变化对固体、液体或溶液的体积影响很小,可以认为改变压强对它们的化学反应速率无影响。
⑶温度对化学反应速率的影响
结论:当其它条件不变时,升高温度,反应物获得能量,反应活性增强,可以增大化学反应速率,反之降低温度,可以减慢化学反应速率。一般温度每升高10℃,化学反应速率通常增大2~4倍,上述结论对放热反应、吸热反应均适用。
⑷催化剂对化学反应速率的影响
结论:催化剂能够改变化学反应速率。能加快化学反应速率的催化剂叫正催化剂,能够减慢化学反应速率的催化剂叫负催化剂,一般情况下不特别说明都指正催化剂。
⑸其它:光、电磁波、超声波、反应物颗粒大小、溶剂等因素也能影响化学反应速率
三、化学平衡
1、可逆反应
⑴定义:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应叫做可逆反应。用“ ”代替“==”。
”代替“==”。
⑵可逆反应中所谓的正反应、逆反应是相对的,一般把向右进行的反应叫做正反应,向左进行的反应叫做逆反应。
⑶在不同条件下能向两个方向进行的反应不叫可逆反应。如:
2H2 + O2 2H2O;2H2O
2H2O;2H2O 2H2↑+ O2↑
2H2↑+ O2↑
⑷可逆反应不能进行到底,在一定条件下只能进行到一定程度后达到平衡状态。
2、化学反应的限度
⑴化学反应的限度就是研究可逆反应在一定条件下所能达到的最大限度。
⑵反应的转化率
反应物的转化率:α=
3、化学平衡
⑴化学平衡状态:在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应物和生成物的浓度保持不变的状态,叫做化学平衡状态,简称化学平衡。
①化学平衡的微观标志(即本质):v正=v逆
②化学平衡的宏观标志:反应混合物中各组分的浓度和体积分数保持不变,即随时间的变化,保持不变。
③可逆反应无论从正反应开始,还是从逆反应开始,或正、逆反应同时开始,都能达到化学平衡。
⑵化学平衡的特征
①逆:化学平衡研究的对象是可逆反应。
②动:化学平衡是动态平衡,反应处于平衡态时,化学反应仍在进行,反应并没有停止。
③等:化学反应处于化学平衡状态时,正反应速率等于逆反应速率,且都不等于零。④定:化学反应处于化学平衡状态时,反应混合物中各组分的浓度保持一定,体积分数保持一定。对反应物,有一定的转化率,对生成物,有一定的产率。
⑤变:化学平衡是有条件的平衡,当外界条件变化,原有的化学平衡被破坏,在新的条件下,平衡发生移动,最终又会建立新的化学平衡。
四、判断可逆反应达到平衡的标志
以可逆反应mA(g) + nB(g)  pC(g) + qD(g)为例
pC(g) + qD(g)为例
1、直接标志
⑴v正=v逆。
具体可以是:①A、B、C、D中任一种在单位时间内的生成个数等于反应掉的个数。②单位时间内生成m mol A(或n molB),同时生成p molC(或q molD)。
⑵各物质的质量或物质的量不再改变。
⑶各物质的百分含量(物质的量分数、体积分数、质量分数)不再改变。
⑷各物质的浓度不再改变。
2、间接标志
⑴若某一反应物或生成物有颜色,颜色稳定不变。
⑵当m+n≠p+q时,恒容下总压强不再改变。(m+n=p+q时,总压强不能作为判断依据
五、有关化学平衡的计算
1、主要类型有:①求起始浓度、转化浓度、平衡浓度。
②求某反应物的转化率、平衡气体混合物中各成分的体积分数等。
2、化学平衡的计算模式—三段式法
设a(mol·L-1)、b(mol·L-1)分别为A、B两物质的起始浓度,mx(mol·L-1)为反应物A的转化浓度,nx(mol·L-1)为反应物B的转化浓度,则
mA(g) + nB(g)  pC(g) + qD(g)
pC(g) + qD(g)
c始(mol·L-1) a b 0 0
Δc(mol·L-1) mx nx px qx
C平(mol·L-1)a-mx b-nx px qx
物质浓度的变化关系
反应物:平衡浓度=起始浓度-转化浓度
生成物:平衡浓度=起始浓度+转化浓度
以上三种浓度中,只有转化浓度之比等于化学方程式中计量数之比
化学平衡知识

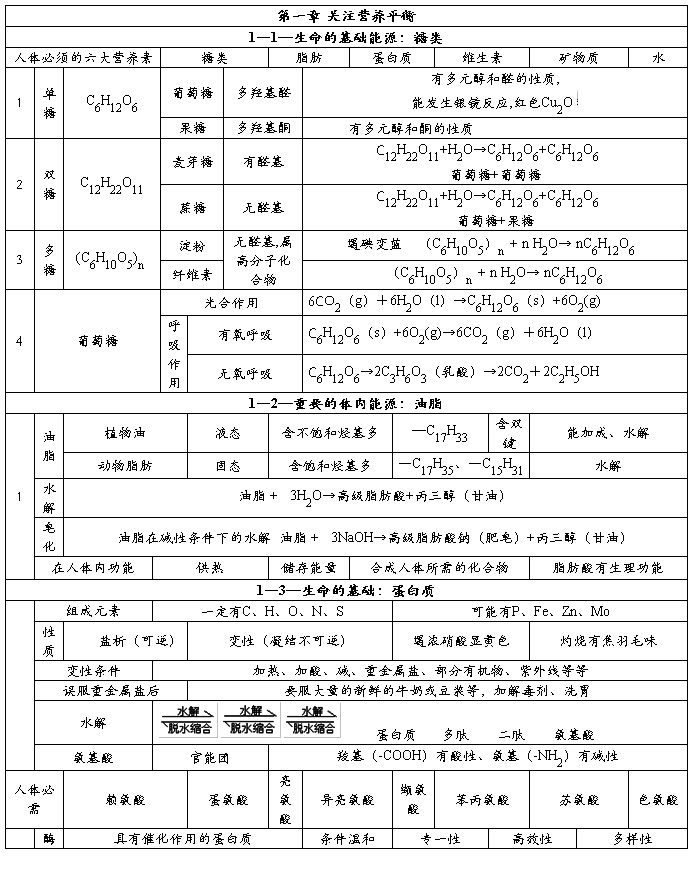
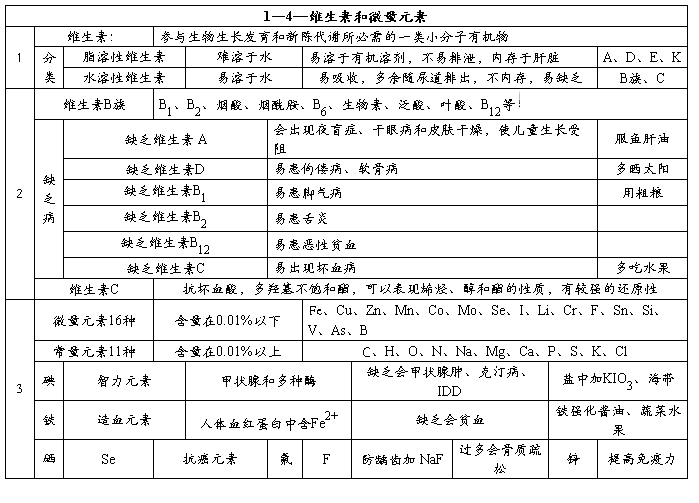
第二篇:化学选修1《第一章 关注营养平衡》知识点总结
化学选修1《第一章 关注营养平衡》知识点总结
-
化学反应速率与化学平衡知识点归纳
1.化学反应速率:⑴.化学反应速率的概念及表示方法:通过计算式:v=Δc/Δt来理解其概念:①化学反应速率与反应消耗的时间(Δt)…
-
化学平衡知识点总结
化学平衡一化学平衡1可逆反应定义在同一条件下既能向正反应方向进行同时又能向逆反应方向进行的反应叫做可逆反应用代替可逆反应中所谓的正…
-
高中化学《化学平衡》知识点总结 新人教版选修4
安徽省安庆市第九中学高二化学化学平衡知识点总结新人教版选修4一1定义化学平衡状态一定条件下当一个可逆反应进行到正逆反应速率相等时更…
-
化学平衡知识点总结学案
选修四第二章知识总结927帆的自豪是能在风浪中挺起胸膛要点一化学反应速率大小的比较一化学反应速率1表示方法通常用单位时间内反应物浓…
-
化学反应速率、化学平衡知识点总结用
化学反应速率化学平衡知识点总结化学反应速率和平化学衡命题规律化学反应速率和化学平衡是高考的必考内容其主要命题内容有化学反应速率影响…
-
高一化学下册知识点总结
高一化学必修二知识点总结一、元素周期表★熟记等式:原子序数=核电荷数=质子数=核外电子数1、元素周期表的编排原则:①按照原子序数递…
-
化学反应速率与化学平衡知识点归纳
1.化学反应速率:⑴.化学反应速率的概念及表示方法:通过计算式:v=Δc/Δt来理解其概念:①化学反应速率与反应消耗的时间(Δt)…
-
沪科版_高一化学下学期知识点总结
高一下学期化学期末复习要点一硫氮单质及化合物一硫单质S黑火药的使用S2KNO33CK2S3CO2N21硫的物理性质硫是淡黄色晶体脆…
-
高二化学上期知识点_总结
第一章氮族元素一氮族元素N氮P磷As砷Sb锑Bi铋二氮气N21分子结构电子式结构式NN分子里NN键很牢固结构很稳定2物理性质无色无…
-
高二化学上期知识点_总结
第一章氮族元素一氮族元素N氮P磷As砷Sb锑Bi铋20xx010919xx39701444二氮气N21分子结构电子式结构式NN分子…
-
高中化学平衡归纳总结
高中化学平衡的归纳总结化学反应速率与化学平衡一、高考展望:化学反应速率和化学平衡理论的初步知识是中学化学的重要基本理论。从历年高考…