高中化学知识点总结:离子共存问题
优思个性教育 高一化学
高中化学知识点总结:离子共存问题
1.由于发生复分解反应,离子不能大量共存。
(1)有气体产生。如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存。
(2)有沉淀生成。如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
(3)有弱电解质生成。如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、AlO2-、SiO32-、CN-、C17H35COO-、 等与H+不能大量共存;一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;NH4+与OH-不能大量共存。
(4)一些容易发生水解的离子,在溶液中的存在是有条件的。如AlO2-、S2-、CO32-、C6H5O-等必须在碱性条件下才能在溶液中存在;如Fe3+、Al3+等必须在酸性条件下才能在溶液中存在。这两类离子不能同时存在在同一溶液中,即离子间能发生“双水解”反应。如3AlO2-+3Al3++6H2O=4Al(OH)3↓等。
2.由于发生氧化还原反应,离子不能大量共存。
(1)具有较强还原性的离子不能与具有较强氧化性的离子大量共存。如S2-、HS-、SO32-、I-和Fe3+不能大量共存。
(2)在酸性或碱性的介质中由于发生氧化还原反应而不能大量共存。
如MnO4-、Cr2O7-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存;SO32-和S2-在碱性条件下可以共存,但在酸性条件下则由于发生2S2-+SO32-+6H+=3S↓+3H2O反应不能共在。H+与S2O32-不能大量共存。
3.能水解的阳离子跟能水解的阴离子在水溶液中不能大量共存(双水解)。
例:Al3+和HCO3-、CO32-、HS-、S2-、AlO2-、ClO-等;Fe3+与CO32-、HCO3-、AlO2-、ClO-等不能大量共存。
4.溶液中能发生络合反应的离子不能大量共存。
如Fe2+、Fe3+与SCN-不能大量共存
5、审题时应注意题中给出的附加条件。
①酸性溶液(H+)、碱性溶液(OH-)、能在加入铝粉后放出可燃气体的溶液
②有色子MnO4-(紫红色),Fe3+(黄色),Fe2+(浅绿色),Cu2+(蓝色),Fe(SCN)2+(血红色)
③MnO4-,NO3-等在酸性条件下具有强氧化性。
优思个性教育 高一化学
④S2O32-在酸性条件下发生氧化还原反应:S2O32-+2H+=S↓+SO2↑+H2O ⑤注意题目要求“大量共存”还是“不能大量共存”。
6、审题时还应特别注意以下几点:
(1)注意溶液的酸性对离子间发生氧化还原反应的影响。如:Fe2+与NO3-能共存,但在强酸性条件下(即Fe2+、NO3-、H+相遇)不能共存;MnO4-与Cl-在强酸性条件下也不能共存;S2-与SO32-在钠、钾盐时可共存,但在酸性条件下则不能共存。
(2)酸式盐的含氢弱酸根离子不能与强碱(OH-)、强酸(H+)共存。 如HCO3-+OH-=CO32-+H2O(HCO3-遇碱时进一步电离);HCO3-+H+=CO2↑+H2O
优思个性教育 高一化学
离子共存问题 练习题
【1】在给定的四种溶液中,加入以下各组离子,各离子组能在原溶液中大量共存的有( )。
A.滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、NO3-
B.pH为11的溶液:Na+、S2-、SO32-、S2O32-
C.水电离出c (OH-)= 的溶液:K+、HCO3-、Br-、Ba2+
D.所含溶质为NaHSO4的溶液:K+、NO3-、SO42- 、 PO43-
【2】下列各组例子中,能在强碱性溶液中共存,且在加入稀盐酸的过程中有沉淀和气体生
A. Na+ NO3- AlO2- SO42- B. Na+ NO3- CO32- K+
C. K+ Cl- AlO2- CO32- D. Na+ Cl- HCO3- Ca2+
【3】某无色溶液,只含有下列八种离子中的某几种: Mg2+、Na+、H+、Ag+、Cl-、HCO3-、成的是( )。 OH-、NO3-。已知该溶液能跟金属铝反应,且放出的气体只有氢气。
①若溶液跟Al反应后有AlO2-生成, 则原溶液一定含有大量的
___________________离子, 还可能含有大量的____________________离子。
②若溶液跟Al反应后有Al3+生成, 则原溶液中一定不含有大_____________离子。
【4】下列各组离子一定能大量共存的是( )。
A、含有大量Fe3+的溶液中:NH4+、Na+、CI-、SCN-
B、在强碱溶液中:Na+、K+、AlO2-、CO32-
C、在c(H+)=10-13mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3-
D、在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
【5】在pH=1的溶液中,可以大量共存的离子是( )。
A.K+、Na+、SO42—、S2O32— B.NH4+、Mg2+、SO42—、Cl—
C.Na+、K+、HCO3—、Cl— D.K+、Na+、AlO2—、NO3—
【6】某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是( )
???——A.K+、Na+、HCO3、NO3 B.Na+、SO2
4、Cl、ClO
???+++C.H+、Mg2+、SO2
4、NO3 D.Ag、K、NO3、Na
【7】一定能在下列溶液中大量共存的离子组是( )
A.含有大量Al3+的溶液:Na+、NH4+、SO42-、Cl-
B.c(H+) = 1×10-13mol·L-1的溶液:Na+、Ca2+、SO42-、CO32-
C.含有大量Fe3+的溶液:Na+、Mg2+、NO3-、SCN-
D.含有大量NO3-的溶液:H+、Fe2+、SO42-、Cl-
+-- 【8】已知某溶液中存在较多的H、SO42、NO3,则溶液中还可能大量存在的离子组是( )
+ A.A13、CH3COO—、C1— B.Na+、NH4+、C1—
C.Mg2+、C1—、Fe2+ D. Mg2+、Ba2+、Br—
【9】室温下,强酸性和强碱性溶液中都不能共存的离子组是( )。 ..
A、NH4+、Cu2+、Cl、NO3 B、K+、Na+、SO32、S2 ----
C、K+、Na+、AlO 2、SO42 D、Ba2+、Fe2+、NO3、Br ----
【10】加入铝粉产生氢气的溶液中,下列各组离子,可能大量共存的是( )
A、NH4+、NO3-、CO32-、Na+ B、Na+、Ba2+、Mg2+、HCO3-
优思个性教育 高一化学
C、NO3-、Ca2+、K+、Cl- D、NO3-、K+、AlO2-、OH-
【11】下列各环境中的离子能大量共存的是( )
A、中性溶液中:Mg2+、Fe3+、SO42、Cl --
B、pH=1的溶液中:Al3+、NH4+、Ca2+、SO42 -
C、c(H+)=1×10-14mol/L的溶液中:Na+、AlO2-、S2、SO32 --
D、使pH试纸变红的溶液中:Fe2+、I-、NO3、ClO-
【12】下列各组离子,在指定环境中一定能大量共存的是 ( )
A.pH=7的溶液中:Al3+、K+、SO42-、HCO3-
B.能使pH试纸变深蓝色的溶液中:S2-、SO32-、S2O32-、SO42-
C.加入铝粉能放出氢气的溶液中:CO32-、AlO2-、I-、NO3-
D.由水电离出的[OH-]=1×10-13mol/L的溶液中:Fe2+、NH4+、ClO-、Cl-
【12】下列各组离子,不能大量共存的是( )
A. Na+、NH4+、C1—、 H+
B. Fe3+、K+、SO42-、HCO3-
C. Al3+、ClO-、SO42-、Cl-
-D. Mg2+、HCO3-、Cu2+、Cl -
?E. Ag+、K+、NO3、Na+
F. NH4+、Al3+、NH4+、ClO-、Cl-
G. K+ 、CI- 、AlO2- 、CO32-
第二篇:高中化学必修一第二章知识点总结及练习
第二章 化学物质及其变化 (大周知识清单)2014.08.17
一、物质的分类
1、分类是学习和研究化学物质及其变化的一种常用的基本方法,它不仅可以使有关化学物质及其变化的知识系统化,还可以通过分门别类的研究,了解物质及其变化的规律。分类要有一定的标准,根据不同的标准可以对化学物质及其变化进行不同的分类。交叉分类和树状分类是常用的分类方法。
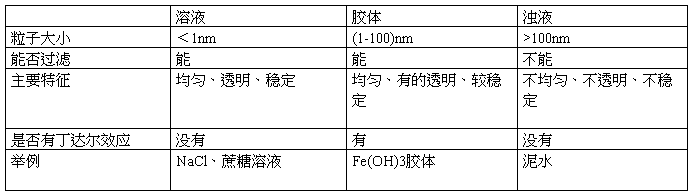
2、分散系及其分类
把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系,叫分散系。被分散的物质称作分散质(可以是气体、液体、固体),起容纳分散质作用的物质称作分散剂(可以是气体、液体、固体)。
溶液、胶体、浊液三种分散系的比较
二、物质的化学变化
1、物质之间可以发生各种各样的化学变化,依据一定的标准可以对化学变化进行分类。
(1)、根据反应物和生成物的类别以及反应前后物质种类的多少可以分为:
A、化合反应(A+B=AB)
B、分解反应(AB=A+B)
C、置换反应(A+BC=AC+B)
D、复分解反应(AB+CD=AD+CB)
(2)根据反应中是否有离子参加可将反应分为:
A、离子反应:有离子参加的一类反应。主要包括复分解反应和有离子参加的氧化还原反应。
B、分子反应(非离子反应)
(3)根据反应中是否有电子转移可将反应分为:
A、氧化还原反应:反应中有电子转移(得失或偏移)的反应
实质:有电子转移(得失或偏移)
特征:反应前后元素的化合价有变化
B、非氧化还原反应
2、离子反应
(1)、电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。酸、碱、盐都是电解质。
酸:电离时生成的阳离子全部是氢离子的化合物
碱:电离时生成的阴离子全部是氢氧根离子的化合物。
盐:电离时生成金属离子(或铵根离子)和酸根离子的化合物
在水溶液中或熔化状态下都不能导电的化合物,叫非电解质。
注意:①电解质、非电解质都是化合物,不同之处是在水溶液中或融化状态下能否导电。②电解质的导电是有条件的:电解质必须在水溶液中或熔化状态下才能导电。③能导电的物质并不全部是电解质:如铜、铝、石墨等。④非金属氧化物(SO2、SO3、CO2)、大部分的有机物为非电解质。
(2)、离子方程式:用实际参加反应的离子符号来表示反应的式子。它不仅表示一个具体的化学反应,而且表示同一类型的离子反应。
复分解反应这类离子反应发生的条件是:生成沉淀、气体或水。
书写方法:
写:写出反应的化学方程式
拆:把易溶于水、易电离的物质拆写成离子形式
删:将不参加反应的离子从方程式两端删去
查:查方程式两端原子个数和电荷数是否相等
(3)、离子共存问题
所谓离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。
A、结合生成难溶物质的离子不能大量共存:如Ba2+和SO42-、Ag+和Cl-、Ca2+和CO32-、Mg2+和OH-等
B、结合生成气体或易挥发性物质的离子不能大量共存:如H+和C O 32-,HCO3-,SO32-,OH-和NH4+等
C、结合生成难电离物质(水)的离子不能大量共存:如H+和OH-、CH3COO-,OH-和HCO3-等。
D、发生氧化还原反应、水解反应的离子不能大量共存(待学)
注意:题干中的条件:如无色溶液应排除有色离子:Fe2+、Fe3+、Cu2+、MnO4-等离子,酸性(或碱性)则应考虑所给离子组外,还有大量的H+(或OH-)。
(4)、离子方程式正误判断(六看)
一看反应是否符合事实:主要看反应能否进行或反应产物是否正确
二看能否写出离子方程式:纯固体之间的反应不能写离子方程式
三看化学用语是否正确:化学式、离子符号、沉淀、气体符号、等号等的书写是否符合事实
四看离子配比是否正确
五看原子个数、电荷数是否守恒
六看与量有关的反应表达式是否正确(过量、适量)
3、氧化还原反应
氧化还原反应概念的发展比较
得氧失氧的观点(狭义)
化合价升降观点(广义)
电子转移观点(本质)
氧化反应
得氧的反应
化合价升高的反应
失去(或偏离)电子的反应
还原反应
失氧的反应
化合价降低的反应
得到(或偏向)电子的反应
氧化还原反应
有氧得失的反应
有化合价升降的反应
有电子转移(得失或偏移)的反应
氧化还原反应中概念及其相互关系如下:
失去电子——化合价升高——被氧化(发生氧化反应)——是还原剂(有还原性)
得到电子——化合价降低——被还原(发生还原反应)——是氧化剂(有氧化性)
-
高中化学知识点总结:离子共存问题及分析
高中化学知识点总结离子共存问题1由于发生复分解反应离子不能大量共存1有气体产生如CO32SO32S2HCO3HSO3HS等易挥发的…
-
高中化学离子共存问题详细讲解
化学离子共存问题一发生复分解反应有气体产生222H与CO3HCO3SO3HSO3SHS等不能共存如CO32S2HSHSO3等易挥发…
-
高中化学知识点总结:离子共存问题
高中化学知识点总结:离子共存问题1.由于发生复分解反应,离子不能大量共存。(1)有气体产生。如CO32-、SO32-、S2-、HC…
-
高二化学离子共存专题总结
六、在指定条件下,判断溶液中不同的离子能否大量共存一、由于发生复分解反应,离子不能大量共存。1、离子间能反应生成难溶或微溶的物质,…
-
高中化学知识点总结:离子共存问题
优思个性教育高一化学高中化学知识点总结离子共存问题1由于发生复分解反应离子不能大量共存1有气体产生如CO32SO32S2HCO3H…
-
高中化学常见考点汇总(离子共存问题)
离子共存问题一、“无色透明”条件型若题目限定溶液“无色”,则不含有色离子,即Fe2+(浅绿色)、Fe3+(黄色)、Cu2+(蓝色)…
-
高中化学知识点总结:离子共存问题及分析__太强太好了!!!
高中化学知识点总结:离子共存问题1.由于发生复分解反应,离子不能大量共存。(1)有气体产生。如CO32-、SO32-、S2-、HC…
-
高二化学离子共存专题总结
六、在指定条件下,判断溶液中不同的离子能否大量共存一、由于发生复分解反应,离子不能大量共存。1、离子间能反应生成难溶或微溶的物质,…
-
高中化学离子共存教案
离子大量共存规律总结有关溶液中离子能否共存问题是中学化学中的常见问题。近几年高考几乎每年都设置判断离子共存问题的试题。从历年高考中…
-
高中化学知识点总结:离子共存问题
高中化学知识点总结:离子共存问题1.由于发生复分解反应,离子不能大量共存。(1)有气体产生。如CO32-、SO32-、S2-、HC…
-
离子共存与离子反应方程式的书写判断规律总结
离子共存与离子反应方程式的书写判断(09)12.下列离子方程式正确的是A.向盐酸中滴加氨水:H++OH-=H2OB.Fe(OH)3…