分析化学实验 钙片中钙含量的测定 实验报告
实 验 报 告
姓名: 班级: 同组人:
项目 钙片中钙含量的测定 课程: 分析化学 学号:
一、实验目的
1、掌握标定EDTA方法。
2、掌握EDTA法测定水中Ca2含量的原理和方法。
二、实验原理
EDTA(Na2H2Y)标准溶液可用直接法配制,也可先配制粗略浓度,再用金属Zn,ZnO,CaCO3或MgSO4·7H2O等基准物质来标定。当用CaCO3标定时,用铬黑T(H3In)做指示剂,在PH=12~13的缓冲溶液中进行,滴定到溶液呈蓝色而指示终点。
钙制剂一般用酸溶解后调节pH=12-13,减少Mg2+干扰。以钙指示剂为指示剂,指示剂与钙离子生成酒红色络合物,当用EDTA注定终点时,游离出指示剂,溶液呈现蓝色。
若测定时室温过低,可将水样加热至30-40℃,滴定时要注意速度不可太快,并不断摇动,使充分反应。
三、仪器和药品
仪器:250mL锥形瓶3个,50mL酸式滴定管1支,25、50mL移液管1支, 10mL量筒1个,250ml,烧杯1个。研钵、250mL容量瓶2个、250mL细口瓶
试剂:0.01mol/LEDTA标准溶液、CaCO3标准溶液、6mol/LNaOH溶液、铬黑T指示剂、钙指示剂、6mol/L HCl、糖钙片
四、内容及步骤
1.以CaCO3为基准物标定EDTA
(1)配制0.01000mol/L钙标准溶液 准确称取CaCO30.25~0.26g,置于250mL烧杯中,加几滴水,滴加6mol/L HCl 5mL直至CaCO3完全溶解,再过量1~2滴,用水冲洗烧杯内壁,然后将溶液移入250mL容量瓶中,再加水至刻度,摇匀。
(2)EDTA(0.01mol/L)配制:称取2g EDTA二钠盐于250ml的烧杯中,加水溶解后稀释至500ml,储于聚乙烯瓶中备用。
(3)EDTA溶液浓渡的标定 用25mL移液管吸钙标准溶液置于250mL锥形瓶中,再加PH=10的缓冲溶液5mL,加水稀释至100mL,加少许(约0.1g)铬黑T指示剂,用待标定的EDTA溶液滴定至溶液由酒红色变为纯蓝色,即为滴定终点。记录EDTA所用体积V(mL)。
(4)钙片中钙含量的测定
将药片放入研钵中研细。准确称取0.2-0.4g研细了的药片,加入10ml蒸馏水,加热,逐滴6mol/L HCl ,边加热边搅拌,至溶解完全。转移到250ml容量瓶中,蒸馏水定容,摇匀。
准确移取上述溶液25.00ml于250ml锥形瓶中,加入6mol/L NaOH溶液5ml,蒸馏水25ml,摇匀,加入钙指示剂少许,用0.01mol/LEDTA标准溶液滴至蓝色。平行滴定三次。计算钙片中CaCO3的百分含量。
五、实验结果记录与计算
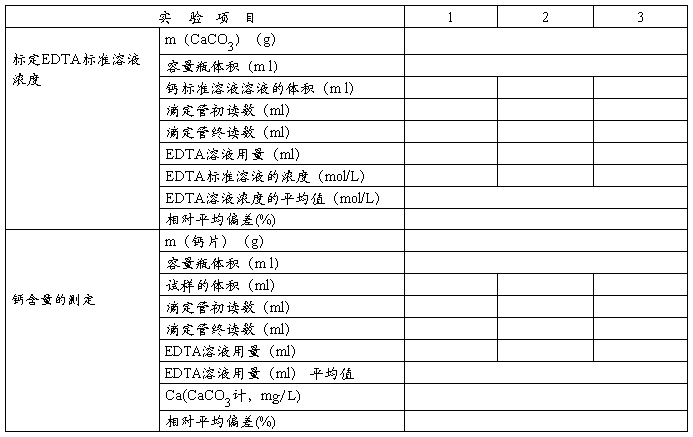
六、思考题:
1、为什么滴定Ca2+、Mg2+总量时要控制溶液pH=10?滴定Ca2时要控制pH=12?
2、推导计算公式。
3、叙述酸式滴定管活塞涂凡士林的方法。容量瓶漏溶液能否涂凡士林?
教师评语:
年 月 日
第二篇:分析化学实验 碱度的测定 实验报告
实 验 报 告
姓名: 班级: 同组人:
项目 碱度的测定 课程: 分析化学 学号:
一、实验目的
1、掌握酸碱滴定法测定碱度的原理和方法。
2、掌握碱度测定结果的计算。
3、熟练滴定操作及相关仪器的操作方法。
二、实验原理
水的碱度主要由碳酸盐、重碳酸盐、及氢氧化物组成,但在某些情况下,如水中存在
磷酸盐、硅酸盐、硼酸盐等也会产生一定的碱度。
碱度的测定是在水样中加入适当的指示剂,用酸标准溶液进行滴定,可分别测出水样
中各种碱度,其反应如下:
OH- + H+ = H2O CO32- + H+ = HCO3- HCO3-+ H+ = H2O + CO2
根据上述到达终点时所用酸的量可计算出溶液中碳酸盐、重碳酸盐及总碱度。
三、仪器和药品
仪器:250mL锥形瓶3个;50mL酸式滴定管1支、20、50 mL移液管、50mL量筒。
试剂:0.1%酚酞指示剂、0.1%甲基橙指示剂、0.1mol/L盐酸标准溶液、0.05000mol/L Na2CO3
四、内容及步骤
(一)0.1mol/L盐酸标准溶液浓度的标定
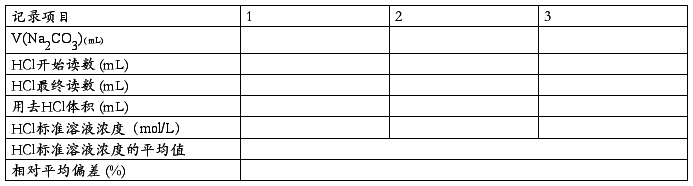
准确量取20.00mL 已配好的0.05000mol/L Na2CO3标准溶液置于3只250mL锥形瓶中,加水约30mL,温热,摇动使之溶解,以甲基橙为指示剂,以0.lmol/LHCl标准液滴定至溶液由黄色转变为橙色,记下HCl标准溶液的消耗用量(3份测定的平均偏差应小于0.2%,否则应重复测定),并计算出HCl标准溶液的浓度。
(二)碱度的测定(双指示剂法)
准确移取水样l00mL于250mL锥形瓶中,加人酚酞指示剂三滴,如呈红色,用0.1mol/L盐酸溶液滴定至颜色刚好消失,记下盐酸溶液的消耗体积(V1);在此溶液中,再加入2滴甲基橙指示剂,继续用标准盐酸溶液滴定至橙色为止,记下盐酸的消耗量(V)。判断水样中碱度的组成及含量。
五、实验结果记录与计算
(一)盐酸标准溶液浓度的标定
(二)碱度的测定
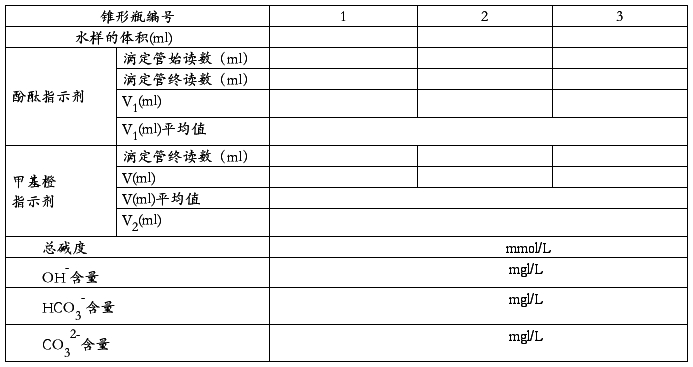
六、思考题:
1、什么叫碱度?测定结果的计算公式如何表示?如何判断碱度组成?
2、滴定管在装满标准溶液前为什么要用此润洗内壁2~3次?为什么?
3、 用于滴定的锥形瓶或烧杯是否需要干燥?要不要用标准溶液润洗?为什么?
教师评语:
年 月 日
-
手持技术测定补钙剂中钙的含量实验报告
化学实验教学研究实验报告实验设计项目手持技术测定补钙剂中钙的含量实验时间星期二上午下午晚上姓名方胜敏学号2220xx3160111…
- 补钙制剂中钙含量的测定
-
钙制剂中钙含量的测定
钙制剂中钙含量的测定EDTA法和KMnO4的比较一实验原理钙制剂中主要成份为碳酸钙淀粉等用IIHCl将其溶解即可而含钙乳钦料奶粉等…
-
补钙剂中钙含量的测定 - 高锰酸钾间接滴定法
高锰酸钾间接滴定法测补钙制剂中钙含量一实验目的1了解沉淀分离的基本要求及操作2掌握氧化还原法间接测定钙含量的原理及方法二实验原理利…
-
补钙剂中钙含量的测定123
补钙制剂中钙含量的测定高锰酸钾间接滴定法一实验目的1了解沉淀分离的基本要求及操作2掌握氧化还原法间接测定钙含量的基本原理及方法二实…
-
沉淀滴定测定酱油中氯化钠含量实验报告
沉淀滴定法测定酱油中的氯化钠含量一实验目的1熟悉沉淀滴定法的基本操作2了解实验原理过程及注意事项3掌握沉淀滴定法对实际样品酱油的分…
-
钻井液中固相含量的测定实验报告
中国石油大学油田化学实验报告实验日期成绩班级学号姓名教师同组者实验四钻井液中固相含量的测定一实验目的1掌握固相含量测定仪的操作方法…
-
乳制品中三聚氰胺的含量的测定(高效液相色谱法)实验报告
20xx级化学教育仪器化学综合性与设计性实验指导老师曹20xx年5月30号一实验目的1通过分析化学综合性实验设计性实验培养学生初步…
-
熏肉制品中亚硝酸盐含量的测定实验报告
熏肉制品中亚硝酸盐含量的测定华南师范大学09化一摘要肉制品是一类深受人民群众喜爱的食品在其生产过程中多采用亚硝酸盐作为发色剂它不仅…
-
五水硫酸铜结晶水含量的测定(综合实验)实验报告
五水硫酸铜结晶水含量的测定一实验目的要求1了解制备五水硫酸铜晶体的方法2测定硫酸铜的结晶水含量二实验内容1五水硫酸铜的提纯2五水硫…
-
硫酸铜晶体中结晶水含量的测定 实验报告
实验二硫酸铜晶体中结晶水含量的测定班级姓名学号实验目的1学习测定晶体中结晶水含量的方法2练习坩埚的使用方法初步学会研磨操作3理解恒…