氧化还原反应知识点总结
知识点:氧化还原反应
概述
所属知识点:
[基本概念]
包含次级知识点:
氧化还原反应的特征 、 氧化反应和还原反应 、 氧化产物和还原产物 、 常见的氧化剂和还原剂 、 双线桥法 、 单线桥法 、 氧化还原反应方程式的配平方法 。
知识点总结
1、氧化还原反应的基本概念:
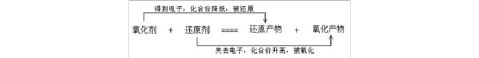
氧化反应和还原反应:氧化反应表现为被氧化的元素化合价升高,其实质是该元素的原子失去电子(或共用电子对偏离)的过程;还原反应表现为被还原的元素化合价降低,其实质是该元素的原子获得电子(或共用电子对偏向)的过程。氧化还原反应的概念可以用下面的式子表示:
2、氧化产物和还原产物:被氧化生成的物质是氧化产物,被还原生成的物质是还原产物。
常见的氧化剂有O2、Cl2、浓硫酸、HNO3、KMnO4、FeCl3等;常见的还原剂有活泼的金属单质、H2、C、CO等。
3、氧化还原中电子转移的表示方法:使用双线桥或单线桥表示出电子转移的方向和数目,二者的区别在于,使用双线桥需要标出电子的得失,而单线桥不需要。
4、氧化还原反应方程式的配平是一个难点,在掌握化合价升降相等的基础上再掌握一些配平时需要的技巧,就可以解决多数的问题。
常见考法
经常以选择题、填空题的形式考查氧化还原反应的基本概念,得失电子的表示方法。以探究题的形式考查氧化还原反应的配平以及相关计算。
误区提醒
比较物质的氧化性、还原性强弱的方法
根据氧化还原反应的化学方程式进行判断:在一个氧化还原反应中,氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。②根据金属活动性顺序判断:金属活动性越强,其还原性越强,即:还原性:K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb>(H)>Cu>Hg>Ag
金属的还原性越强,其失去电子后形成的金属离子的氧化性越弱,即:
氧化性:K+
Fe3+可以和铜反应:2Fe3+ + Cu = 2Fe2+ + Cu2+,因此氧化性:Fe3+> Cu2+。
【典型例题】
在热的稀硫酸溶液中溶解了11.4g硫酸亚铁,当加入50mL 0.5mol·L-1KNO3溶液后,其中Fe2+全部转化成Fe3+,KNO3也反应完全,并有NxOy氮氧化物气体逸出。
FeSO4 + KNO3 + H2SO4 → K2SO4 +Fe2(SO4)3 + NxOy + H2O
(1)推算出x=___________,y=___________
(2)配平该化学方程式
(3)反应中氧化剂为____________________
(4)用短线和箭头标出电子转移的方向和数目
解析:
(1)11.4g硫酸亚铁的物质的量为n(FeSO4)=0.075mol,n(KNO3)=0.025mol。当其中的Fe2+全部被氧化生成Fe3+时,失去0.075mol电子,则KNO3被还原时得到0.075电子,平均每个NO3-得到3个电子,氮元素的化合价由+5降低为+2,即NxOy应为NO,x=1,y=1。
(2)根据题意,FeSO4和KNO3的化学计量数之比为3:1,其他反应物和生成物的系数可根据观察法进行配平。
(3)氧化剂中的元素在反应中化合价降低,该反应的氧化剂应为KNO3。
答案:
(1)x=1,y=1;
(2)6FeSO4 + 2KNO3 + 4H2SO4 == K2SO4 + 3Fe2(SO4)3 + 2NO↑ + 4H2O
(3)KNO3
(4)
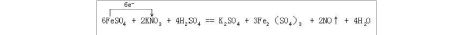
第二篇:氧化还原反应知识点归纳
氧化还原反应知识点归纳
一、概念
1、氧化反应:元素化合价升高的反应
还原反应:元素化合价降低的反应
氧化还原反应:凡有元素化合价升降的化学反应就是氧化还原反应
2、氧化剂和还原剂(反应物)
氧化剂:得电子(或电子对偏向)的物质------氧化性:氧化剂具有的得电子的能力
还原剂:失电子(或电子对偏离)的物质------还原性:还原剂具有的失电子的能力
3、氧化产物:氧化后的生成物
还原产物:还原后的生成物。
4、被氧化:还原剂在反应时化合价升高的过程
被还原:氧化剂在反应时化合价降低的过程
5、氧化性:氧化剂具有的得电子的能力
还原性:还原剂具有的失电子的能力

6、氧化还原反应的实质:电子的转移(电子的得失或共用电子对的偏移
口诀:失电子,化合价升高,被氧化(氧化反应),还原剂;
得电子,化合价降低,被还原(还原反应),氧化剂;
7、氧化还原反应中电子转移(或得失)的表示方法
(1)双线桥法:表示同种元素在反应前后得失电子的情况。用带箭头的连线从化合价升高
的元素开始,指向化合价降低的元素,再在连线上方标出电子转移的数目.


(2)单线桥法:表示反应物中氧化剂、还原剂间电子转移的方向和数目。在单线桥法中,
箭头的指向已经表明了电子转移的方向,因此不能再在线桥上写“得”、“失”
字样.

二、物质的氧化性强弱、还原性强弱的比较。
氧化性→得电子性,得到电子越容易→氧化性越强
还原性→失电子性,失去电子越容易→还原性越强
由此,金属原子因其最外层电子数较少,通常都容易失去电子,表现出还原性,所以,一般来说,金属性也就是还原性;非金属原子因其最外层电子数较多,通常都容易得到电子,表现出氧化性,所以,一般来说,非金属性也就是氧化性。
1、根据金属活动性顺序来判断:
一般来说,越活泼的金属,失电子氧化成金属阳离子越容易,其阳离子得电子还原成金属单质越难,氧化性越弱;反之,越不活泼的金属,失电子氧化成金属阳离子越难,其阳离子得电子还原成金属单质越容易,氧化性越强。


2、根据非金属活动性顺序来判断:
一般来说,越活泼的非金属,得到电子还原成非金属阴离子越容易,其阴离子失电子氧化成单质越难,还原性越弱。

3、根据氧化还原反应发生的规律来判断: 氧化还原反应可用如下式子表示:

规律:反应物中氧化剂的氧化性强于生成物中氧化产物的氧化性,反应物中还原剂的还原性强于生成物中还原产物的还原性。
三、常见的氧化剂还原剂
常见氧化剂(1)非金属性较强的单质:F2、Cl2、Br2、I2、O3、O2等
(2)变价元素中高价态化合物:KClO3、KMnO4、Fe3+盐、K2Cr2O7、
浓H2SO4、HNO3等
(3)其它HClO、MnO2、Na2O2、H2O2、NO2等
常见还原剂(1)金属性较强的单质K、Na、Mg、Al、Fe、Zn
(2)某些非金属单质:H2、C、Si等
(3)变价元素中某些低价态化合物:H2S、HBr、HI、Fe2+及盐,SO2等
五、氧化还原反应方程式的配平方法
1、配平原则:电子守恒、原子守恒、电荷守恒
2、配平的基本方法(化合价升降法)
化合价升降法的基本步骤为:“一标、二等、三定、四平、五查”。
“一标”指的是标出反应中发生氧化和还原反应的元素的化合价,注明每种物质中升高或降低的总价数。

“二等”指的是化合价升降总数相等,即为两个互质(非互质的应约分)的数交叉相乘。

“三定”指的是用跟踪法确定氧化产物、还原产物化学式前的系数。

“四平”指的是通过观察法配平其它各物质化学式前的系数。

“五查”指的是在有氧元素参加的反应中可通过查对反应式左右两边氧原子总数是否相等进行复核(离子反应还应检查电荷数是否相等),如相等则方程式已配平,最后将方程式中“—”改为“=”。
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
-
氧化还原反应知识点归纳
氧化还原反应知识点归纳(氧化还原反应中的概念与规律;氧化还原反应的表示方法及配平。)氧化还原反应中的概念与规律:一、五对概念在氧化…
-
高中化学知识点总结氧化还原反应
燕园教育教师培训手册三氧化还原反应1准确理解氧化还原反应的概念11氧化还原反应各概念之间的关系1反应类型氧化反应物质所含元素化合价…
-
氧化还原反应知识点总结
一氧化还原基本概念1四组重要概念间的关系1氧化还原反应凡是反应过程中有元素化合价变化或电子转移的化学变化叫氧化还原反应氧化还原反应…
-
高一化学之三 氧化还原反应知识点总结
714氧化还原反应知识点一概念氧化还原反应的实质电子的转移电子的得失或共用电子对的偏移口诀失电子化合价升高被氧化氧化反应还原剂得电…
-
氧化还原反应知识点总结
专题四氧化还原反应一氧化还原反应的基本概念1基本概念略氧化还原反应氧化反应还原反应氧化剂还原剂等2知识体系3常见氧化剂1活泼非金属…
-
氧化还原反应知识点总结
一氧化还原基本概念1四组重要概念间的关系1氧化还原反应凡是反应过程中有元素化合价变化或电子转移的化学变化叫氧化还原反应氧化还原反应…
-
氧化还原反应知识点归纳
氧化还原反应知识点归纳一、概念1、氧化反应:元素化合价升高的反应还原反应:元素化合价降低的反应氧化还原反应:凡有元素化合价升降的化…
-
氧化还原反应知识点归纳
氧化还原反应知识点归纳(氧化还原反应中的概念与规律;氧化还原反应的表示方法及配平。)氧化还原反应中的概念与规律:一、五对概念在氧化…
-
氧化还原反应知识点总结
专题四氧化还原反应一氧化还原反应的基本概念1基本概念略氧化还原反应氧化反应还原反应氧化剂还原剂等2知识体系3常见氧化剂1活泼非金属…
-
氧化还原反应知识点总结
一氧化还原基本概念1原反应氧化还原反应的特征元素化合价的升降氧化还原反应的实质电子转移2氧化反应和还原反应在氧化还原反应中反应物所…
-
高一化学下册知识点总结
高一化学必修二知识点总结一、元素周期表★熟记等式:原子序数=核电荷数=质子数=核外电子数1、元素周期表的编排原则:①按照原子序数递…