氧化还原反应知识点归纳
一、氧化还原反应知识点(一课时)
考纲解读 : 1.熟记常见元素的化合价以及化合物中各元素化合价的计算方法。
2.掌握氧化反应和还原反应、氧化性和还原性、氧化剂和还原剂、氧化产物和还原产物的判断方法和各概念之间的关系。命题多以选择题的形式出现。
3.了解常见的氧化还原反应类型.
一、熟记常见元素的化合价以及化合物中各元素化合价的计算方法。
1. 化合价口诀:一价氢钾钠铵银,二价铜钙钡镁锌,亚铁正二铁正三,常用还有铝正三,负一氟氯氢氧根,还有一个硝酸根,负二硫酸碳酸根,氧硫负二记得深!
2. 在化合物中,若无特别说明则氢元素显+1、氧元素显—2.但是在NaH中H显—1,在H2O2和Na2O2氧元素显—1。
3.在一些不常见的化合物中按照化合物化合价代数和为0计算。K2Cr207设Cr元素化合价为X,则(+1)*2+X*2+(—2)*7=0 X=+6
4. 原子团中某元素化合价的计算方法。如 X2072—离子。设X化合价为a,则2a+(—2)*7=—2,则X=+6
二、氧化还原反应概念之间的关系(重点)
氧化还原反应中氧化剂和还原剂、氧化产物和还原产物之间存在如下关系:
 例如:氧化还原反应:CuO + H2 = Cu + H2O 可以这样解析:
例如:氧化还原反应:CuO + H2 = Cu + H2O 可以这样解析:
Cu0→Cu :氧化铜变成单指铜,铜元素化合价从+2降低到0, Cu0为氧化剂,铜元素被还原,氧化铜或铜元素发生还原反应,Cu0生成还原产物Cu。
H2→H2O: 氢气变成水,氢元素化合价从0升高到+1,H2为还原剂,氢元素被氧化,氢气或氢元素发生氧化反应,H2生成氧化产物H2O。
其它氧化还原反应方程式的分析方法与上叙分析方法一样。
三、氧化还原反应类型:
1.一般的氧化还原反应:指氧化剂和还原剂分别属于不同物质的氧化还原反应。
如 :MnO2+4HCl(浓) == MnCl2+Cl2↑+2H2O(氧化剂:MnO2 还原剂:HCl)
2.自身氧化还原反应:指氧化剂和还原剂属于同一种物质的氧化还原反应。如:2KClO3  2KCl + 3O2↑(氧化剂和还原剂都是KClO3 ,氧元素和氯元素化合价发生变化)
2KCl + 3O2↑(氧化剂和还原剂都是KClO3 ,氧元素和氯元素化合价发生变化)
3.歧化反应:指发生在同一物质同一元素之间的氧化还原反应。其反应规律是:所得产物中,该元素一部分价态升高,一部分价态降低,即“中间价→高价+低价”。具有多种价态的元素(如氯、硫、氮和磷元素等)均可发生歧化反应。如 Cl2+2NaOH=NaCl+NaClO+H2O(氯元素的化合价从0分别变成+1和-1,氯气既是氧化剂又是还原剂)
4.归中反应:指含不同价态同种元素的物质问发生氧化还原反应。其反应规律是:反应物中,该元素一部分价态升高,一部分价态降低,该元素价态的变化一定遵循“高价+低价

→中间价”,而不会出现交错现象。如:KClO3+6HCl==KCl+3Cl2+3H2O ;对于归中反应,
可通过分析参加氧化还原反应的元素的来源,从而确定氧化产物、还原产物的物质的量之比。与氧化还原反应的概念有关的练习题。
1.下列化学反应不属于氧化还原反应的是( )
A、3Cl2 + 6KOH =5KCl + KClO3 + 3H2O B、2NO2 + 2NaOH =NaNO3 +NaNO2 +H2O
C、SnCl4 + 2H2O = SnO2 + 4HCl D、3CCl4 + 2K2Cr2O7 = 2CrO2Cl2 + 3COCl2 +2KCl
2. 下列反应中,水作为还原剂的是( )
A、Cl2 + H2O = HCl + HClO B、CaO+ H2O = Ca(OH)2
C、2F2 + 2H2O = 4HF + O2? D、2Na + 4H2O = 2NaOH + H2?
3.P单质在下列反应中4P+3KOH+3H2O=3KH2PO2+PH3的变化是( )
A.被氧化 B.被还原 C.既被氧化又被还原 D.既未被氧化又未被还原
4. 下列变化过程属于还原反应的是( )
A.HCl→MgCl2 B.Na→Na+ C.CO→CO2 D. Fe3+→Fe
5. 下列变化需要加入氧化剂的是( )
A. S2-→HS- B. HCO3-→CO2 C. 2 Cl-→Cl2 D. Cu2+→Cu
6. 在H2SO3+2 H2S=3 H2O+3S↓反应中,被氧化与被还原元素的质量比为( )
A.1:1 B.2:1 C.1:2 D.3:2
7.被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O NaBO2+4H2↑下列说法中正确的是(NaBH4中H元素为-1价)( )
NaBO2+4H2↑下列说法中正确的是(NaBH4中H元素为-1价)( )
A.NaBH4既是氧化剂又是还原剂
B.NaBH4是还原剂,H2O是氧化剂
C.硼元素被氧化,氢元素被还原
D.被氧化的元素与被还原的元素质量比为1:1
8. 反应2KMnO4+16HCl 2MnCl2+2KCl+5Cl2↑+8H2O中,氧化剂是 ,还原剂是 ,若生成71gCl2,被氧化的HCl是 g。
2MnCl2+2KCl+5Cl2↑+8H2O中,氧化剂是 ,还原剂是 ,若生成71gCl2,被氧化的HCl是 g。
第二篇:氧化还原反应知识点归纳
氧化还原反应知识点归纳
(氧化还原反应中的概念与规律;氧化还原反应的表示方法及配平。)
氧化还原反应中的概念与规律:
一、 五对概念
在氧化还原反应中,有五对既相对立又相联系的概念。它们的名称和相互关系是:

二、 五条规律
1、表现性质规律
同种元素具有多种价态时,一般处于最高价态时只具有氧化性、处于最低价态时只具有还原性、处于中间可变价时既具有氧化性又具有还原性。
2、性质强弱规律

3、反应先后规律
在浓度相差不大的溶液中,同时含有几种还原剂时,若加入氧化剂,则它首先与溶液中最强的还原剂作用;同理,在浓度相差不大的溶液中,同时含有几种氧化剂时,若加入还原剂,则它首先与溶液中最强的氧化剂作用。例如,向含有FeBr2溶液中通入Cl2,首先被氧化的是Fe2+
4、价态归中规律
含不同价态同种元素的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价+低价→中间价”的规律。
5、电子守恒规律
在任何氧化—还原反应中,氧化剂得电子(或共用电子对偏向)总数与还原剂失电子(或共用电子对偏离)总数一定相等。
三.物质氧化性或还原性强弱的比较:
(1)由元素的金属性或非金属性比较
<1>金属阳离子的氧化性随其单质还原性的增强而减弱

非金属阴离子的还原性随其单质的氧化性增强而减弱
(2)由反应条件的难易比较
不同的氧化剂与同一还原剂反应时,反应条件越易,其氧化剂的氧化性越强。如:

前者比后者容易发生反应,可判断氧化性: 。同理,不同的还原剂与同一氧化剂反应时,反应条件越易,其还原剂的还原性越强。
。同理,不同的还原剂与同一氧化剂反应时,反应条件越易,其还原剂的还原性越强。
(3)根据被氧化或被还原的程度不同进行比较
当不同的氧化剂与同一还原剂反应时,还原剂被氧化的程度越大,氧化剂的氧化性就越强。如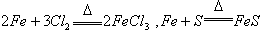 ,根据铁被氧化程度的不同
,根据铁被氧化程度的不同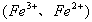 ,可判断氧化性:
,可判断氧化性: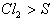 。同理,当不同的还原剂与同一氧化剂反应时,氧化剂被还原的程度越大,还原剂的还原性就越强。
。同理,当不同的还原剂与同一氧化剂反应时,氧化剂被还原的程度越大,还原剂的还原性就越强。
(4)根据反应方程式进行比较
氧化剂+还原剂=还原产物+氧化产物
氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物
(5)根据元素周期律进行比较
一般地,氧化性:上>下,右>左;还原性:下>上,左>右。
(6)某些氧化剂的氧化性或还原剂的还原性与下列因素有关:
温度:如热的浓硫酸的氧化性比冷的浓硫酸的氧化性强。
浓度:如浓硝酸的氧化性比稀硝酸的强。
酸碱性:如中性环境中 不显氧化性,酸性环境中
不显氧化性,酸性环境中 显氧化性;又如
显氧化性;又如 溶液的氧化性随溶液的酸性增强而增强。
溶液的氧化性随溶液的酸性增强而增强。
注意:物质的氧化性或还原性的强弱只决定于得到或失去电子的难易,与得失电子的多少无关。如还原性: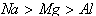 ,氧化性:
,氧化性: 。
。
【注意】氧化还原反应中的不一定:
⑴含有最高价态元素的化合物不一定具有强氧化性。如前述的氯元素的含氧酸及其盐,是价
态越低,氧化性超强。H3PO4中+5价的P无强氧化性。
⑵有单质参加的反应不一定是氧化还原反应。如同素异形体之间的转化。
⑶物质的氧化性或还原性与物质得到或掉失去电子的多少无关。
⑷得到电子难的元素失去电子不一定容易,例如:第ⅣA族的C,既难得到电子,又难失去电
子,与其它原子易以共价键结合。
⑸元素由化合态变为游离态不一定是是氧化反应,也可能是还原反应。
四、常见的氧化剂和还原剂
1、常见的氧化剂
(1)活泼的非金属单质:Cl2、Br2、O2、I2、S等
(2)元素处于高价时的氧化物:CO2、NO2、SO3、MnO2、PbO2等
(3)元素处于高价时的含氧酸:浓H2SO4、HNO3等
(4)元素处于高价时的盐:KClO3、KMnO4、FeCl3、K2Cr2O7等
(5)过氧化物:Na2O2、H2O2等
(6)次氯酸及其盐:HClO、Ca(ClO)2、NaClO等
2、常见的还原剂
(1)活泼的金属单质:Na、Mg、Al、Zn、Fe
(2)某些非金属单质:H2、C、Si
(3)元素处于低价时的氧化物:CO、、SO2
(4)元素处于低价时的酸:HCl、HI、H2S、H2SO3等
(5)元素处于低价时的盐:Na2S、KI、Na2SO3、FeSO4等
氧化还原反应的表示方法及配平
1、表示方法

2、 配平的方法和步骤:
写好化学式,标明化合价;画上双箭头,列出变化价;
升降化合价,公倍求相等;观察再配平,两边添系数。
步骤:(1)标出有变价的元素反应前后的化合价.
(2)用“双桥线”连接反应前后的元素并在桥上或桥下注明化合价升降数.
(3)找出化合价升降数之间的最小公倍数,再依据以上有关原则首先配平有关物质前面的系数.
要求:(1)质量守恒:即反应前后各元素原子的种类和个数相等.
(2)氧化剂和还原剂之间电子转移关系正确.
(3)电荷守恒:反应物总电荷数与生成物总电荷数相等,且电性相同.
常见的氧化还原反应方程式的配平
(1)整体法的应用:
A.还原剂或氧化剂的所有元素完全被氧化或完全被还原,可以看成一个整体,在配平时按各元素的系数比考虑得失电子的总数.如:

分析: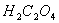 中碳元素的平均价态为+3价,都被氧化到+4价,可考虑整体法
中碳元素的平均价态为+3价,都被氧化到+4价,可考虑整体法
 ×5指
×5指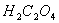 计量数为5
计量数为5
 ×2指
×2指 计量数为2
计量数为2
B.还原剂或氧化剂的元素部分被氧化或部分被还原,不能看成一个整体,要分别考虑.如:

分析:氯气中的氯元素部分被还原,部分被氧化,分别考虑
 ×1指HC1O计量数为1
×1指HC1O计量数为1
 ×1指HC1计量数为1
×1指HC1计量数为1
(2)离子型氧化还原反应配平
离子型氧化还原反应配平时,遵循整体法配平的同时,还可从两边的电荷守恒出发.如

分析: 中的氧元素都被还原为-2价,可用整体法
中的氧元素都被还原为-2价,可用整体法
 ×2指
×2指 计量数为2
计量数为2
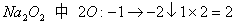 ×3指
×3指 计量数为3
计量数为3
根据电荷守恒,用观察法配平其他化学计量数:

(3) 难点突破:
1.缺项配平:
一般先确定氧化剂、还原剂、氧化产物、还原产物的化学计量数,在通过比较反应物与生成物,确定缺项(一般为 、
、 、
、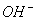 ),最后观察法配平.
),最后观察法配平.
将 固体加入
固体加入 的混合溶液里,加热后溶液显紫色(
的混合溶液里,加热后溶液显紫色( 无色),反应的离子方程式如下:
无色),反应的离子方程式如下:
 试完成并配平方程式.
试完成并配平方程式.
分析:溶液显紫色说明由 生成,
生成, 与
与 的氧元素生成
的氧元素生成 ,所以右边缺项为
,所以右边缺项为 和
和 .
.
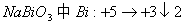 ×5指
×5指 计量数为5
计量数为5
 ×2指
×2指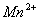 计量数为2
计量数为2
根据电荷守恒,用观察法配平其他化学计量数:
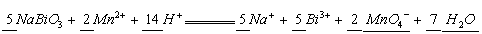
2.零价配平:
复杂的化合物中的化合价无法标出,且仅靠观察法也无法配平,此时可把不知(或难知)化合价的物质看成一个电中性的整体,假设其中所有的元素都为0价,在根据化合价升降配平方程式,不影响配平结果.但需要注意的是:按零价法分析的价态升降根据与该反应实际的价态升降不符,零价法只是配平的一种方法和技巧.
 分析:设
分析:设 中各元素均为0价
中各元素均为0价

 中
中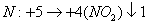
有观察法配平其他化学计量数:

3.均价配平:
适用于有机氧化还原方程式的配平.根据氢元素为+1价,氧元素为-2价,确定碳元素的平均价态,在通过适当方法配平.


用观察法配平其他化学计量数:

-
高中化学知识点总结氧化还原反应
燕园教育教师培训手册三氧化还原反应1准确理解氧化还原反应的概念11氧化还原反应各概念之间的关系1反应类型氧化反应物质所含元素化合价…
-
氧化还原反应知识点总结
一氧化还原基本概念1四组重要概念间的关系1氧化还原反应凡是反应过程中有元素化合价变化或电子转移的化学变化叫氧化还原反应氧化还原反应…
-
高一化学之三 氧化还原反应知识点总结
714氧化还原反应知识点一概念氧化还原反应的实质电子的转移电子的得失或共用电子对的偏移口诀失电子化合价升高被氧化氧化反应还原剂得电…
-
氧化还原反应知识点总结
专题四氧化还原反应一氧化还原反应的基本概念1基本概念略氧化还原反应氧化反应还原反应氧化剂还原剂等2知识体系3常见氧化剂1活泼非金属…
-
氧化还原反应知识点整理
高考知识点整理氧化还原反应一课标及指导意见要求课标要求化学1主题3常见无机物及其应用根据实验事实了解氧化还原反应的本质是电子的转移…
-
氧化还原反应知识点总结
一氧化还原基本概念1四组重要概念间的关系1氧化还原反应凡是反应过程中有元素化合价变化或电子转移的化学变化叫氧化还原反应氧化还原反应…
-
氧化还原反应知识点归纳
氧化还原反应知识点归纳一概念1氧化反应元素化合价升高的反应还原反应元素化合价降低的反应氧化还原反应凡有元素化合价升降的化学反应就是…
-
氧化还原反应知识点归纳
氧化还原反应知识点归纳氧化还原反应中的概念与规律氧化还原反应的表示方法及配平氧化还原反应中的概念与规律一五对概念在氧化还原反应中有…
-
氧化还原反应知识点总结
专题四氧化还原反应一氧化还原反应的基本概念1基本概念略氧化还原反应氧化反应还原反应氧化剂还原剂等2知识体系3常见氧化剂1活泼非金属…
-
氧化还原反应知识点总结
一氧化还原基本概念1原反应氧化还原反应的特征元素化合价的升降氧化还原反应的实质电子转移2氧化反应和还原反应在氧化还原反应中反应物所…
-
高一化学下册知识点总结
高一化学必修二知识点总结一、元素周期表★熟记等式:原子序数=核电荷数=质子数=核外电子数1、元素周期表的编排原则:①按照原子序数递…