氧化还原反应知识点归纳及练习
氧化还原反应知识点归纳
考纲解读
1、掌握氧化还原反应的有关概念。氧化还原反应的概念包括氧化和还原、氧化性和还原性、氧化剂和还原剂、氧化产物和还原产物等。命题多以选择题或填空题的形式出现。
2、综合运用化合价升降和电子转移的观点分析判断氧化还原反应中电子专一的方向和数目,能配平氧化还原方程式。命题常以填空题的形式出现,有时还需判断反应物或生成物。
3、会比较物质氧化性或还原性的强弱,其主要依据是:氧化(或还原)剂的氧化(或还原)性强于氧化(或还原)产物的氧化(或还原)性,命题主要以选择题的形式出现。
4、运用电子得失守恒的规律进行有关的计算,如确定化合价、电荷数、反应物或生成物化学式等。命题多以选择题或填空题的形式出现。
一、 概念
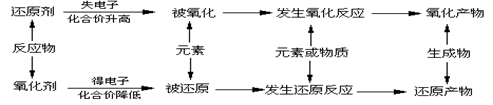
二、氧化还原反应的实质:电子的转移(电子的得失或共用电子对的偏移
口诀:失电子,化合价升高,被氧化(氧化反应),还原剂;
得电子,化合价降低,被还原(还原反应),氧化剂;
三、(1)双线桥法:表示同种元素在反应前后得失电子的情况。用带箭头的连线从化合价升高的元素开始,指向化合价降低的元素,再在连线上方标出电子转移的数目.
化合价降低 +ne- 被还原

氧化剂 + 还原剂 = 还原产物 + 氧化产物


 化合价升高 -ne- 被氧化
化合价升高 -ne- 被氧化

(2)单线桥法:表示反应物中氧化剂、还原剂间电子转移的方向和数目。在单线桥法中,
箭头的指向已经表明了电子转移的方向,因此不能再在线桥上写“得”、“失”
字样.

四、物质的氧化性强弱、还原性强弱的比较。
1、根据金属活动性顺序来判断:
一般来说,越活泼的金属,失电子氧化成金属阳离子越容易,其阳离子得电子还原成金属单质越难,氧化性越弱;反之,越不活泼的金属,失电子氧化成金属阳离子越难,其阳离子得电子还原成金属单质越容易,氧化性越强。


2、根据非金属活动性顺序来判断:
一般来说,越活泼的非金属,得到电子还原成非金属阴离子越容易,其阴离子失电子氧化成单质越难,还原性越弱。

3、根据氧化还原反应发生的规律来判断: 氧化还原反应可用如下式子表示:

规律:反应物中氧化剂的氧化性强于生成物中氧化产物的氧化性,反应物中还原剂的还原性强于生成物中还原产物的还原性。
4、根据(氧化剂、还原剂)元素的价态进行判断:
元素处于最高价只有氧化性,最低价只有还原性,处于中间价态既有氧化又有还原性。
一般来说,同种元素价越高,氧化性越强;价越低还原性越强。如氧化性:Fe3+>Fe2+>Fe,
S(+6价)>S(+4价)等,还原性:H2S>S>SO2,但是,氧化性:HClO4< HClO34< HClO24< HClO。
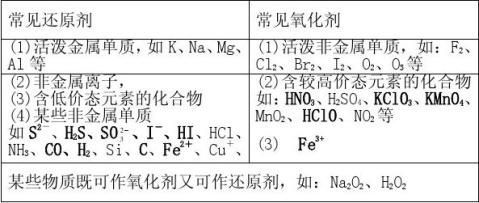
五、常见的氧化剂还原剂
常见氧化剂(1)非金属性较强的单质:F2、Cl2、Br2、I2、O3、O2等
(2)变价元素中高价态化合物:KClO3、KMnO4、Fe3+盐、K2Cr2O7、
浓H2SO4、HNO3等
(3)其它HClO、MnO2、Na2O2、H2O2、NO2等
常见还原剂(1)金属性较强的单质K、Na、Mg、Al、Fe、Zn
(2)某些非金属单质:H2、C、Si等
(3)变价元素中某些低价态化合物:H2S、HBr、HI、Fe2+及盐,SO2等
六、氧化还原反应方程式的配平方法
1、配平原则:电子守恒、原子守恒、电荷守恒
2、配平的基本方法(化合价升降法)
化合价升降法的基本步骤为:“一标、二等、三定、四平、五查”。
【对应练习】
1.(2012·福州高一检测)有关氧化还原反应的下列叙述正确的是( A )
A.氧化剂发生还原反应,还原剂发生氧化反应
B.氧化剂被氧化,还原剂被还原
C.一个氧化还原反应中,氧化剂和还原剂一定是两种不同的物质
D.氧化还原反应中,金属单质只作还原剂,非金属单质只作氧化剂
2.(2013·经典习题选萃)已知有如下反应:
①2BrO+Cl2===Br2+2ClO;②ClO+5Cl-+6H+===3Cl2+3H2O;
③2FeCl3+2KI===2FeCl2+2KCl+I2;④2FeCl2+Cl2===2FeCl3。
下列叙述正确的是( )
A.氧化能力:ClO>BrO>Cl2>Fe3+>I2 B.还原能力:Fe2+>I->Cl-
C.反应ClO+Br-===Cl-+BrO能顺利进行 D.氧化能力:BrO>ClO>Cl2>Fe3+>I2
3.(2013·经典习题选萃)在一定条件下,RO和F2可发生如下反应:RO+F2+2OH-===RO+2F-+H2O,从而可知在RO中,元素R的化合价是( )
A.+4价 B.+5价 C.+6价 D.+7价
4.(2013·试题调研)根据化学方程式,判断有关物质的还原性强弱顺序是( )
I2+SO2+2H2O===H2SO4+2HI;2FeCl2+Cl2===2FeCl3
2FeCl3+3HI===2FeCl2+2HCl+I2
A.I->Fe2+>Cl->SO2 B.Cl->Fe2+>SO2>I- C.Fe2+>I->Cl->SO2 D.SO2>I->Fe2+>Cl-
5.(2013·经典习题选萃)下面三种方法都可以制得Cl2:
①MnO2+4HCl(浓)MnCl2+2H2O+Cl2↑
②2KMnO4+16HCl(浓)===2KCl+2MnCl2+8H2O+5Cl2↑
③O2+4HCl(g)催化剂500℃2H2O+2Cl2
这三种氧化剂的氧化性由强到弱的顺序是( )
A.O2>MnO2>KMnO4 B.KMnO4>MnO2>O2 C.MnO2>KMnO4>O2 D.O2>KMnO4>MnO2
6.(2013·试题调研)已知①N2+3H22NH3
②3Cl2+8NH3===N2+6NH4Cl
判断下列物质的还原性从强到弱的顺序是( )
A.NH4Cl>NH3>H2 B.H2>NH3>NH4Cl C.NH3>NH4Cl>H2 D.H2>NH4Cl>NH3
7.已经X和Y是两种单质,它们之间的反应是X+Y―→X2++Y2-。现有下列叙述,正确的是( )
①X被氧化 ②X是氧化剂 ③Y2-是还原产物 ④X2+具有氧化性 ⑤Y2-具有还原性
⑥Y单质氧化性比X2+氧化性强
A.①②③ B.①②⑥ C.①③④⑤⑥ D.①③④⑤
8.(2013·试题调研)在下列变化中,需要加入合适的还原剂才能实现的是( )
A.H2―→HCl B.CO―→CO2 C.FeCl3―→FeCl2 D.SO2―→SO3
9.已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-<Fe2+<H2O2<I-<SO2,则下列反应中不能发生的是( )
A.2Fe3++SO2+2H2O===2Fe2++SO+4H+ B.I2+SO2+2H2O===H2SO4+2HI
C.H2O2+H2SO4===SO2↑+O2↑+2H2O D.2Fe2++I2===2Fe3++2I-
10.氢化钠(NaH)是一种生氢剂,可发生反应:NaH+H2O===NaOH+H2↑,对这一反应的描述正确的是( )
A.NaH是氧化剂 B.生成1 mol H2转移2 mol电子 C.NaOH是还原产物
D.氧化产物和还原产物的质量比是1:1
二、非选择题
11.(2013·经典习题选萃)在Fe+CuSO4===FeSO4+Cu反应中,________是还原剂,________是氧化剂,________被氧化,________被还原,Cu是________产物,FeSO4是________产物。
12.(2013·试题调研)按要求填空。
(1)在Fe、Fe2+、Fe3+、H+中,
①只有氧化性的是______________________________________,
②只有还原性的是______________________________________,
③既有氧化性又有还原性的是____________________________。
(2)某同学写出以下三个化学方程式(未配平):
①NO+HNO3―→N2O3+H2O
②NH3+NO―→HNO2+H2O
③N2O4+H2O―→HNO3+HNO2
在②、③反应中一定不可能实现的是________;在反应①中氧化剂是________,还原性最强的是________,若该物质消耗30 g,转移电子________mol。
13.(2013·经典习题选萃)一个体重50 kg的健康人体内含铁元素2 g,这2 g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收。所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。请回答下列问题:
(1)维生素C可使食物中的Fe3+转化成Fe2+,在此过程中________是氧化剂,说明维生素C具有________性。
(2)已知下列反应:①H2O2+2Fe3+===2Fe2++O2↑+2H+,②2Fe2++H2O2+2H+===2Fe3++2H2O。
反应①中生成1 mol O2转移电子的物质的量为________,反应①、②的总反应方程式为____________________________ ____________________________________________________________________________________________________________________,
在该反应中Fe3+的作用为________________ _______________________________________________________。
1、A 2、D、3、B 4、D 5、B 6、B 7、C 8、C 9、CD 10、C 11、【答案】 Fe CuSO4 Fe CuSO4 还原 氧化
12、【答案】 (1)①Fe3+、H+ ②Fe ③Fe2+ (2)② HNO3 NO 1 13、【答案】 (1)Fe3+ 还原 (2)2 mol 2H2O2===2H2O+O2↑ 催化剂
第二篇:氧化还原反应知识点复习与练习
氧化还原反应知识点复习与练习
1、氧化还原反应
定义:有化合价变化的反应就叫做氧化还原反应。(判断的依据) 本质:有电子转移(得失或偏移)
2、氧化反应:化合价升高,失去电子的反应叫氧化反应。
还原反应:化合价降低,得到电子的反应叫还原反应。
3、氧化还原反应实质的表示方法
(1)电子得失法即双线桥法
a、两条线桥从反应物指向生成物,且对准同种元素
b、要标明"得"、"失"电子,且数目要相等。
c、箭头不代表电子转移的方向。
(2)电子转移法即单线桥法
a、一条线桥表示不同元素原子得失电子的情况。
b、不需标明"得"、"失"电子,只标明电子转移的数目。
c、箭头表示电子转移的方向。
d、单线桥箭头从还原剂指向氧化剂。
5、氧化还原反应与四种基本反应类型的关系
(1)置换反应都是氧化还原反应。
(2)化合反应不都是氧化还原反应,有单质参加的化合反应是氧化还原反应。
(3)分解反应不都是氧化还原反就,有单质生成的分解反应才是氧化还原反应。
(4)复分解反应都不是氧化还原反应。
6、
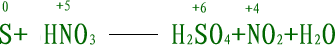

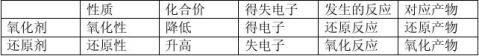
7、氧化性还原性强弱的判断 (1)氧化性:氧化剂>氧化产物 (2)还原性:还原剂>还原产物
(3)金属单质的还原性看金属活动顺序表:
K Ba Ca Mg Al Mn Zn Fe Sn Pb (H) Cu Hg Ag Au
失电子能力逐渐减弱,还原性逐渐减弱
单质还原性强,其对应的离子的氧化性就弱。
金属离子的氧化性看金属活动顺序表倒过来的顺序。例如下列几种阳离子氧化性
++2+2+3+
由强到弱的顺序是:Ag>Cu>Fe>Al>K(注:Fe3+>Cu2+) (4)非金属离子的还原性强弱看非金属活动顺序表倒过来的顺序:
S2->I->Br->O2->Cl->F-
8、氧化还原方程式的配平
一般用"化合价升降法"或"电子得失法"配平。配平原则是"化合价升降总数相等 "或"得失电子总数相等"。下面以硫与浓硝酸反应为例,说明配平的一般步骤: (1)标变价:标出氧化剂、还原剂、氧化产物、还原产物中价变元素的化合价。
(2)求总数:求得失电子数的最小公倍数,以确定氧化剂、还原剂、氧化产物和 还原产物四大物质前的系数。
(3)配系数:观察配平两边其他物质的系数,并进行检查,最后改"----"为"==="号。
1、某元素在化学反应中由化合态变为游离态,则该元素( )
A.一定被氧化 B.一定被还原 C.既可能被氧化,也可能被还原 D.以上都不是
2、下列叙述中,正确的是( )
A、含金属元素的离子一定是阳离子
B、在氧化还原反应中,非金属单质一定是还原剂
C、某元素从化合态变为游离态时,该元素一定被还原
D、金属阳离子被还原不一定得到金属单质
3、在H2SO3+2 H2S=3 H2O+3S反应中,被氧化与被还原元素的质量比为( )
A.1:1 B.2:1 C.1:2 D.3:2
4、离子M2O7X-与S2-能在酸性溶液中发生如下反应:aM2O7X- +3S2- +cH+==2M3+ +eS? +fH2O,
则M2O7X-中M的化合价为( )
A、+4 B、+5 C、+6 D、+7
5、已知X2、Y2、Z2、W2四种物质的氧化能力为:W2>Z2>X2>Y2,下列氧化还原反应能发生的是( )
A、2W- + Z2 = 2Z- +W2 B、2X- + Z2 = 2Z- + X2
C、2Y- + W2 = 2W- + Y2 D、2Z- + X2 = 2X- + Z2
6、已知:Ni+CuSO4=NiSO4+Cu Cu+2AgNO3=Cu(NO3)2+2Ag
则下列判断正确的是( )
A.还原性:Ni>Cu>Ag B.氧化性:Ni2+ >Cu2+ >Ag+
C.还原性:Ni<Cu<Ag D.氧化性:Ni2+ <Cu2+ <Ag+
7、用下列方法均可制得氧气:
(1)2KClO3
(3)2HgO2KCl+3O2↑(2)2Na2O2+2H2O===4NaOH+O2↑ 2Hg+O2↑ (4)2KMnO4K2MnO4+MnO2+O2↑
若要制得相同质量的氧气,反应中电子转移数目之比为
A.3∶2∶1∶4 B.1∶1∶1∶1
C.2∶1∶2∶2 D.1∶2∶1∶1
8、近年来,我国储氢碳管研究获得重大进展,电弧法合成碳纳米管,长伴有大量物质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:__C+___K2Cr2O7+__H2SO4(稀 ) → ___CO2+__K2SO4+ Cr2(SO4)3+ __ ___
(1)完成并配平上述反应的化学方程式(2)此反应的氧化剂______,还原剂______
(3)硫酸在上述反应中表现出的性质是____________(填选项编号)
A.酸性 B.氧化性 C.吸水性 D.脱水性
(4)上述反应若产生11克气体物质,则转移电子的数目___________
9、油画的白色颜料含有PbSO4,久置后会变成PbS使油画变黑,如果用双氧水擦拭则可恢复原貌.试写出反应的方程式:_________ _______________________
10、臭氧(O3)是一种有鱼腥气味的淡蓝色气体.它具有比O2更强的氧化性.已知臭氧能使湿的碘化钾淀粉试纸变蓝,反应中有氧气产生.则反应的方程式是 ,反应中氧化产物是 ,还原产物是 .
12、根据反应(1)Fe+Cu2+=Fe2++Cu(2)2Fe3++Cu=+Cu2++2Fe2+(3)2Fe2++Cl2=2Fe3++2Cl- (4)HClO+H++Cl-=H2O+Cl2,可以判断出各粒子的氧化性由强到弱的顺序正确的是()A.HClO>Cl2>Fe3+>Cu2+ B.Cl2>HClO>Fe3+>Cu2+
C.Cl2>Fe3+>HClO>Cu2+ D.HClO>Cl2>Cu2+>Fe3
-
氧化还原反应知识点归纳
氧化还原反应知识点归纳氧化还原反应中的概念与规律氧化还原反应的表示方法及配平氧化还原反应中的概念与规律一五对概念在氧化还原反应中有…
-
高中化学知识点总结氧化还原反应
燕园教育教师培训手册三氧化还原反应1准确理解氧化还原反应的概念11氧化还原反应各概念之间的关系1反应类型氧化反应物质所含元素化合价…
-
氧化还原反应知识点总结
一氧化还原基本概念1四组重要概念间的关系1氧化还原反应凡是反应过程中有元素化合价变化或电子转移的化学变化叫氧化还原反应氧化还原反应…
-
高一化学之三 氧化还原反应知识点总结
714氧化还原反应知识点一概念氧化还原反应的实质电子的转移电子的得失或共用电子对的偏移口诀失电子化合价升高被氧化氧化反应还原剂得电…
-
氧化还原反应知识点总结
专题四氧化还原反应一氧化还原反应的基本概念1基本概念略氧化还原反应氧化反应还原反应氧化剂还原剂等2知识体系3常见氧化剂1活泼非金属…
-
氧化还原反应知识点总结
一氧化还原基本概念1四组重要概念间的关系1氧化还原反应凡是反应过程中有元素化合价变化或电子转移的化学变化叫氧化还原反应氧化还原反应…
-
氧化还原反应知识点归纳
氧化还原反应知识点归纳一概念1氧化反应元素化合价升高的反应还原反应元素化合价降低的反应氧化还原反应凡有元素化合价升降的化学反应就是…
-
氧化还原反应知识点归纳
氧化还原反应知识点归纳氧化还原反应中的概念与规律氧化还原反应的表示方法及配平氧化还原反应中的概念与规律一五对概念在氧化还原反应中有…
-
氧化还原反应知识点总结
专题四氧化还原反应一氧化还原反应的基本概念1基本概念略氧化还原反应氧化反应还原反应氧化剂还原剂等2知识体系3常见氧化剂1活泼非金属…
-
氧化还原反应知识点总结
一氧化还原基本概念1原反应氧化还原反应的特征元素化合价的升降氧化还原反应的实质电子转移2氧化反应和还原反应在氧化还原反应中反应物所…
-
高一化学下册知识点总结
高一化学必修二知识点总结一、元素周期表★熟记等式:原子序数=核电荷数=质子数=核外电子数1、元素周期表的编排原则:①按照原子序数递…